Анемия при воспалении легкого
Течение внебольничной пневмонии средней степени тяжести у пациентов с железодефицитной анемией. Результаты проведенных исследований.
Т.М. Церах, А.Е. Лихачева, В.А. Матюшко, Белорусский государственный медицинский университет, УЗ «9-я ГКБ», г. Минск
В работе представлены результаты клинических исследований продолжительности пневмоний у больных железодефицитной анемией.
В настоящее время по-прежнему актуальными являются вопросы диагностики, лечения и профилактики внебольничных пневмоний [18, 21]. Обсуждается этиологическая роль хламидийной инфекции пневмоний у детей [14]. Активно изучается состояние иммунитета [16] и особенности гемостаза у больных внебольничной пневмонией [17].
Известно, что дефицит микроэлемента железа влияет на функцию всех органов человека [10].
Имеются указания, что гемотокрит ниже 30% (0,3), а также гемоглобин менее 90г/литр ассоциируются с тяжестью течения внебольничных пневмоний и являются одним из показаний госпитализации этих пациентов [9].
Цель и задачи
Изучить течение внебольничной пневмонии средней степени тяжести у пациентов с железодефицитной анемией.
Материалы и методы
Под наблюдением находилось 50 пациентов внебольничными пневмониями средней тяжести в двух группах. В первой из них – 30 больных, у которых кроме пневмонии имело место железодефицитной анемии средней степени тяжести (гемоглобин 80-100 г/л), снижение микроэлемента железа и ферритина. Мужчин – 5, женщин – 25, в возрасте 19-45 лет. Давность анемии устанавливалась анамнестически. Продолжительность ее от 1 месяца до 5 лет имеется у 8 больных, от 5 до 10 лет – у 13 больных, 9 пациентов об анемии вообще не знали.
Уровень сывороточного железа определялся методом с феррозином и был сниженным, колебался в пределах: 4,5-8,5мкмоль – у мужчин и 3,2-5,3мкмоль – у женщин. Под наблюдение не брались пациенты с анемией хронического заболевания. Для сравнения взята сопоставимая по клинической характеристике группа больных пневмониями (2-ая) – 20 человек, у которых не было дефицита железа и железодефицитной анемии.
Пациенты в обеих группах получали негемотоксичные антибиотики, поливитамины, физиотерапию и, по показаниям – сердечнососудистые, разжижающие мокроту средства. Больные 1-й группы, кроме того, — препараты железа. Лечение проводилось под контролем клинических и лабораторно-инструментальных методов обследования, в том числе рентгена и исследования функции внешнего дыхания.
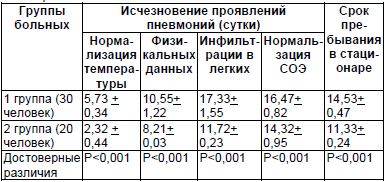
Таблица 1
 Исчезновение проявлений пневмонии
Исчезновение проявлений пневмонии
Результаты и обсуждение
Средние сроки исчезновения основных проявлений пневмонии в сутках представлены в Таблице 1.
Как видно из таблицы, выздоровление пациентов с железодефицитной анемией происходило достоверно медленнее, чем без таковой. У пациентов 1-ой группы значительно дольше сохранялась повышенная температура, физикальные проявления пневмонии (укорочение перкуторного звука, хрипы, усиление бронхофонии), инфильтрация в легких по рентгенологическим данным, продолжительнее оставались воспалительные изменения в крови (ускорение СОЭ, лейкоцитоз, палочкоядерный сдвиг влево). Средняя продолжительность пребывания в стационаре у пациентов пневмониями и железодефицитной анемией было достоверно продолжительнее, чем у больных пневмониями без таковой (Р<0,001).
Замедленное разрешение проявлений пневмонии у пациентов с железодефицитной анемией, по-видимому, во многом связано с дефицитом в организме у них микроэлемента железа. Известно, что это жизненно необходимый, эссенциальный микроэлемент, является не только молекулярной основой гемоглобина, миоглоюина, но и входит в состав около 25 ферментов, в том числе цитохромов, пероксидазы, каталазы, НАДНдегидрогеназы и других. Железо участвует в транспорте кислорода и электронов, участвует в процессе роста клеток иммунной системы, т.е. влияет на иммунитет [1, 11, 12].
Таким образом, мы получили еще одно доказательство влияния содержания микроэлемента железа при железодефицитном состоянии на скорость разрешения пневмонии, что во многом связано с иммунитетом.
Влияние как эссенциальных, так и токсических микроэлементов на организм человека в настоящее время интенсивно изучается [2, 3, 4, 5, 6, 7, 14, 15, 19, 20]. Материалом для определения микроэлементов могут служить кровь, волосы, моча пациентов [1, 13]. Доказано положительное влияние на иммунитет жизненно необходимых и отрицательное влияние на организм человека токсических микроэлементов.
Выводы
- Внебольничная пневмония у пациентов с железодефицитной анемией гораздо более серьезная проблема, чем пневмония без железодефицитного состояния.
- Разрешение пневмонии у пациентов с железодефицитной анемией происходит значительно медленнее, чем при отсутствии таковой.
Литература
- Алексеенко, И. Ф. Железодефицитные состояния / И. Ф. Алексеенко. М., 1996. С. 192.
- Бурцева, Т. И. Зависимость элементарного состава волос от содержания биоэлементов в рационе питания / Т. И. Бурцева, И. А. Рудакова // Микроэлементы в медицине. 2007. Вып. 1, Т. 8, №1. С. 57–60.
- Гурин, В. Н. Содержание свинца в организме при сердечно-сосудистых заболеваниях / В. Н. Гурин, А. Г. Мрочек, И. Н. Семененя // Здравоохранение. 2008. №1. С. 21–23.
- Громашевский, И. В. Получение, оценка качества и безопасность источников эссенциальных микроэлементов / И. В. Громашевский [и др.] // Микроэлементы в медицине. 2007. Вып. 1, Т. 8, № 1. С. 21–23.
- Гресь, Н. А. Микроэлементозы человека. Метаболические и функциональные взаимодействия. Сообщение IV. Обзор литературы / Н. А. Гресь, И. В. Тарасюк, Е. Л. Ставрова // Медицина. Научно-практический журнал. 2005. № 3. С. 43–47.
- Гресь, Н. А. Токсические элементозы. Сб. «Эндоэкология детей Беларуси. 15 лет после катастрофы на ЧАЭС» / Н. А. Гресь [и др.]. Минск, 2001. С. 23–25.
- Кузнецова, Е. Г. Токсические микроэлементы и их роль в развитии нефропатий у детей / Е. Г. Кузнецова [и др.] // Нефрология, научнопрактический журнал. 2007. Т. 11, № 2. С. 31–38.
- Кравченко, Ю. В. Онкологические аспекты развития окислительного стресса при токсическом воздействии кадмия / Ю. В. Кравченко [и др.] // Микроэлементы в медицине. 2005. Т. 6, № 1. С. 32–36.
- Королева, Е. Б. Внебольничная пневмония / Е. Б. Королева, Л. Б. Постникова. Н. Новгород, 2004.
- Левитан, Б. Н. Дефицит железа в клинической практике / Б. Н. Левитан, Е. А. Попов. Астрахань, 2006.
- Левитан, Б. Н. Железодефицитная анемия / Б. Н. Левитан, Е. А. Попов. Астрахань, 2005.
- Левина, А. А. Клинические, биохимические и социальные аспекты железодефицитной анемии / А. А. Левина, Н. В. Цветаева, Т. И. Колошейнова // Гематология и трансфузиология. 2001. № 3. С. 51–56.
- Мачулина, Л. Н. Содержание некоторых токсических микроэлементов в пуповинной крови здоровых новорожденных г. Минска. Сб. «Микроэлементарные нарушения и здоровье детей Беларуси после катастрофы на ЧАЭС» / Л. Н. Мачулина [и др.]. 1997. С. 80–81.
- Охлопкова, К. А. Хламидийная этиология заболеваний нижних отделов дыхательных путей у детей раннего возраста / К. А. Охлопкова [и др.] // Педиатрия. 2001. № 5. С. 40–42.
- Протасова, О. В. Исследование взаимосвязи между балансом содержания макро-и микроэлементов в организме с развитием морфологических дезинтеграций в биологических жидкостях и тканях / О. В. Протасова [и др.] // Физиология человека. 2005. Т. 33, № 2. С. 104–109.
- Трубникова, Е. Г. Состояние иммуноцито-кинового статуса у пожилых больных с внебольничной пневмонией / Е. Г. Трубникова, М. К. Яценко, И. А. Михайлова // Клиническая геронтология. 2004. Т. 10, № 9. С. 14–15.
- Полунина, О. С. Особенности гемостаза при внебольничной пневмонии у пациентов старших возрастных групп / О. С. Полунина [и др.] // Клиническая геронтология. 2004. Т. 10, № 9. С.
- Сторожаков, Г. И. Диагностика и лечение пневмоний: учеб. пособие / Г. И. Сторожаков, А. А. Каробиненко. М., 2008.
- Фомин, И. Н. Оценка элементарного статуса работников металлургического производства: методологический аспект / И. Н. Фомин [и др.] // Микроэлементы в медицине. 2007. Вып. 1, Т. 8, № 1. С. 25–29.
- Шувалов, Н. А. Баланс макро-и микроэлементов в крови и тканях при экспериментальном токсическом гепатите и возможные пути коррекции. автореф. канд. дисс. / Н. А. Шувалов. 2005.
- Чучалин, А. Г. Внебольничная пневмония у взрослых. Практические рекомендации по диагностике, лечению, профилактике / А. Г. Чучалин. М., 2003.
- Johansson, E. Alternations in nickel and cadmium concentration in erythrocyts disease and plasma of patients with Parkinsonis / E. Johansson [et al.] // Микроэлементы в медицине. 2007. Вып. 1, Т. 8, № 1. С. 63–67.
Анемия – это снижение в крови количества красных телец крови – эритроцитов ниже 4,0х109/л, или снижение уровня гемоглобина ниже 130 г/л у мужчин и ниже 120 г/л у женщин. Анемия при беременности характеризуется снижением гемоглобина ниже 110 г/л.
Это не самостоятельное заболевание, анемия встречается как синдром при целом ряде заболеваний и приводит к нарушению снабжения кислородом всех органов и тканей организма, что, в свою очередь, провоцирует развитие множества других заболеваний и патологических состояний.
Степени тяжести
В зависимости от концентрации гемоглобина, принято выделять три степени тяжести малокровия:
- анемия 1 степени регистрируется, когда уровень гемоглобина снижается больше, чем на 20% от нормального показателя;
- анемия 2 степени характеризуется снижением содержания гемоглобина примерно на 20−40% от нормального уровня;
- анемия 3 степени — самая тяжелая форма заболевания, когда гемоглобин снижается больше, чем на 40% от нормального показателя.
Однозначно показать, что у больного — 1 степень или же более тяжелая стадия может только анализ крови.
Причины
Что это такое: анемия, то есть малокровие, — это ни что иное, как недостаток в крови гемоглобина. А именно гемоглобин переносит кислород по всем тканям организма. То есть малокровие вызывается именно недостатком кислорода в клетках всех органов и систем.
- Характер питания. При недостаточном употреблении железосодержащих продуктов питания может развиться железодефицитная анемия, это более характерном для групп населения, где уже имеется высокий уровень алиментарной анемии;
- Нарушение в работе ЖКТ (при нарушениях процесса всасывания). Так как всасывание железа происходит в желудке и верхнем отделе тонкой кишки, при нарушении процесса всасывания, слизистой оболочкой пищеварительного тракта, развивается данное заболевание.
- Хроническая кровопотеря (желудочно-кишечных кровотечения, кровотечений из носа, кровохарканья, гематурия, маточные кровотечения). Принадлежит к одной из самых главных причин железодефицитных состояний.
Таким образом, причиной анемии может считаться недостаток в организме именно железа, что влечет за собой недостаток гемоглобина и, как следствие, недостаточное снабжение организма кровью.
Железодефицитная анемия
Самая распространенная форма анемии. В ее основе лежит нарушение синтеза гемоглобина (переносчика кислорода) вследствие дефицита железа. Она проявляется головокружением, шумом в ушах, мельканием мушек перед глазами, одышкой, сердцебиением. Отмечаются сухость кожи, бледность, в углах рта появляются заеды, трещины. Типичными проявлениями бывают ломкость и слоистость ногтей, их по перечная исчерченность.
Апластическая анемия
Это чаще приобретенное острое, подострое или хроническое заболевание системы крови, в основе которого лежит нарушение кроветворной функции костного мозга, а именно резкое снижение его способности вырабатывать клетки крови.
Иногда апластическая анемия начинается остро и быстро развивается. Но чаще болезнь возникает постепенно и не проявляется яркими симптомами довольно длительное время.К симптомам апластической анемии относятся все симптомы, характерные при недостатке эритроцитов, тромбоцитов и лейкоцитов в крови.
В12-дефицитная анемия
Возникает при недостатке в организме витамина В12, который необходим для роста и созревания эритроцитов в костном мозге, а также для правильной работы нервной системы. По этой причине одними из отличительных симптомов В12-дефицитной анемии являются покалывание и онемение в пальцах, шаткая походка.
В крови обнаруживаются эритроциты особой увеличенной формы. Недостаток витамина В12 может наблюдаться у пожилых людей, при болезнях пищеварительного тракта, при наличии паразитов – ленточных червей.
Гемолитическая анемия
Гемолиз происходит под воздействием антител. Это могут быть антитела матери, направленные против эритроцитов ребенка при несовместимости ребенка и матери по резус-антигену и гораздо реже по антигенам системы АВО. Антитела против собственных эритроцитов могут быть активными при обычной температуре или только при охлаждении.
Они могут появляться без видимой причины или в связи с фиксацией на эритроцитах чуждых для организма неполных антигенов-гаптенов.
Признаки
Перечислим основные признаки анемии, которые могут тревожить человека.
- бледность кожных покровов;
- учащение пульса и дыхания;
- быстрая утомляемость;
- головная боль;
- головокружение;
- шум в ушах;
- пятна в глазах;
- мышечная слабость;
- затруднение концентрации внимания;
- раздражительность;
- вялость;
- небольшое повышение температуры.
Симптомы анемии
Среди симптомов анемии ведущими считаются проявления непосредственно связанные с гипоксией. Степень клинических проявлений зависит от выраженности снижения числа гемоглобина.
- При лёгкой степени (уровень гемоглобина 115- 90 г/л), могут наблюдаться общая слабость, повышенная утомляемость, снижение концентрации внимания.
- При средней (90-70 г/л) больные жалуются на отдышку, учащённое сердцебиение, частую головную боль, нарушение сна, шум в ушах, снижение аппетита, отсутствие полового влечения. Пациенты отличаются бледностью кожных покровов.
- В случае тяжёлой степени (гемоглобин менее 70 г/л) развиваются симптомы сердечной недостаточности.
При анемии симптомы во многих случаях себя не проявляют. Обнаружить болезнь можно только при лабораторных исследованиях крови.
Диагностика заболевания
Для того чтобы понять как лечить анемию важно определить ее вид и причину развития. Основным методом диагностики данного заболевания является исследование крови больного.
Нормальными значениями количества гемоглобина в крови считаются:
- для мужчин 130-160 грамм на литр крови.
- для женщин 120-147 г/л.
- для беременных женщин нижняя граница нормы 110гл.
Лечение анемии
Естественно, методы лечения анемий коренным образом различаются в зависимости от вида малокровия, вызвавшего ее причины и степени тяжести. Но основной принцип лечения анемии любого вида один — необходимо бороться с причиной, вызвавшей понижение гемоглобина.
- При анемии, вызванной потерей крови, надо как можно быстрее остановить кровотечение. При большой кровопотере, угрожающей жизни, применяют переливание донорской крови.
- При железодефицитной анемии надо употреблять продукты, богатые железом, витамином B12 и фолиевой кислотой (они улучшают усвоение железа и процессы кроветворения), врач может также назначить лекарственные препараты, содержащие эти вещества. Часто эффективны оказываются народные средства.
- При анемии, спровоцированной инфекционными заболеваниями и интоксикацией, необходимо лечить основное заболевание, проведение неотложных мер по детоксикации организма.
В случае анемии, немаловажным условием для лечения является здоровый образ жизни — правильное сбалансированное питание, чередование нагрузок и отдыха. Необходимо так же избегать контакта с химическими или отравляющими веществами и нефтепродуктами.
Питание
Важной составляющей лечения является диета с продуктами, богатыми веществами и микроэлементами, которые необходимы для процесса кроветворения. Какие продукты нужно кушать при малокровии у ребенка и взрослого человека? Вот список:
- мясо, колбасы;
- субпродукты — особенно печень;
- рыба;
- яичные желтки;
- продукты из цельнозерновой муки;
- семена — тыквы, подсолнечника, кунжута;
- орехи — особенно фисташки;
- шпинат, капуста, брюссельская капуста, фенхель, листья петрушки;
- свекла;
- черная смородина;
- ростки, зародыши пшеницы;
- абрикосы, чернослив, инжир, финики;
Следует избегать употребления напитков, содержащих кофеин (например, чая, кофе, колы), особенно во время еды, т.к. кофеин мешает всасыванию железа.
Препараты железа при анемии
Препараты железа при малокровии куда более эффективны. Всасываемость данного микроэлемента в пищеварительном тракте из препаратов железа в 15-20 раз выше, чем из продуктов питания.
Это позволяет результативно применять препараты железа при анемии: быстрее поднять гемоглобин, восстановить запасы железа, устранить общую слабость, быструю утомляемость и другие симптомы.
- Ферретаб композит (0154г фумарата железа и 0.0005г фолиевой кислоты). Дополнительно желателен прием аскорбиновой кислоты в суточной дозе 0,2-0,3г).
- Сорбифер дурулес ( 0,32 г сульфата железа и 0,06г витамина С) выпускается в драже суточная дозировка в зависимости от степени анемии 2-3 раза в сутки.
- Тотема – выпускается во флаконах по 10 миллилитров ,содержание элементов ткое же как и в сорбифере . Применяется внутрь, может разводится водой, возможно назначение его при непереносимости таблетированных форм железа. Суточная доза 1- 2 приема.
- Фенюльс (0,15г, сульфата железа, 0,05г витамина С,витамины В2, В6,0,005г пантотената кальция.
- Витамин В12 в ампулах по1 мл 0,02% и 0,05%.
- Фолиевая кислота в таблетках по 1мг.
- Ампульные препараты железа, для введения внутримышечно и внутривенно продаются только по рецепту и требуют проведения инъекций только в стационарных условиях из за высокой частоты аллергических реакций на эти препараты.
Нельзя принимать препараты железа совместно с лекарственными средствами, снижающими их всасывание: Левомицитин, Препараты кальция, Тетрациклины, Антациды. Как правило, препараты железа назначают до еды, если в лекарственном средстве нет витамина С, то требуется дополнительный прием аскорбиновой кислоты в суточной дозе 0,2-0.3г.
Для каждого пациента специально рассчитывается суточная потребность в железе, а также длительность курса лечения, учитывается всасывание конкретного назначаемого препарата и содержание железа в нем. Обычно назначаются длительные курсы лечения, в течение 1,5-2 месяцев принимаются лечебные дозы, а в последующие 2-3 месяца — профилактические.
Последствия
Железодефицитная анемия, не вылеченная на ранней стадии, может иметь тяжелые последствия. Тяжелая степень переходит в сердечную недостаточность, соединенную с тахикардией, отеками, пониженным артериальным давлением. Иногда люди попадают в больницу с резкой потерей сознания, причиной которой является недолеченная, либо не выявленная вовремя анемия.
Поэтому, если вы заподозрили у себя данный недуг или склонны к низкому гемоглобину, то стоит раз в три месяца сдавать контрольный анализ крови.
Анемия воспаления (AI, также называемая анемией хронического заболевания) является распространенной анемией, которая вызывается основным воспалительным заболеванием ( инфекции, аутоиммунные заболевания , рак, хроническое заболевание почек — CKD). При анемии воспаления гемоглобин редко ниже 8 г / дл. Эритроциты обычно имеют нормальный размер и имеют нормальное содержание гемоглобина, но их количество уменьшается (нормоцитарная, нормохромная анемия). В некоторых случаях, особенно если воспалительное заболевание имеет продолжительный характер, количество эритроцитов может быть незначительно уменьшено в размере и содержании гемоглобина.
В то время как анемия воспаления может поражать людей любого возраста, пожилые люди с большей вероятностью будут иметь этот тип анемии, потому что они чаще имеют хронические заболевания, вызывающие воспаление. Диагноз ставится, когда концентрации железа в сыворотке крови низкие, несмотря на наличие достаточных запасов железа, о чем свидетельствует низкий уровень ферритина в сыворотке. Концентрация сывороточного трансферрина также снижается во время хронического воспаления, но этот эффект является запаздывающим показателем из-за длительного периода полураспада трансферрина (около 8 дней) по сравнению с железом (около 1,5 часа).
В условиях воспаления AI может быть трудно отличить от железодефицитной анемии, причем, эти два состояния могут сосуществовать. При анемии воспаления эритропоэз ограничивается железом вследствие опосредованной гепсидином гипоферремии, а продукция эритроцитов подавляется цитокинами, действующими на предшественников эритроидов. . Снижение эритропоэза не может компенсировать укороченную продолжительность жизни эритроцитов, вызванную усилением эритрофагоцитоза цитокиновыми активированными макрофагами. Лечение должно быть направлено на основное заболевание. Если это невозможно, а анемия ограничивает качество жизни или выполнение повседневных действий, комбинация эритропоэз-стимулирующих агентов и железа, вводимого внутривенно, может быть эффективной, но ее следует применять только после тщательного рассмотрения риска и пользы.
«Анемия критических заболеваний» имеет сходную картину, но развивается в течение нескольких дней у пациентов, которые госпитализированы в отделения интенсивной терапии с инфекциями, сепсисом или другими воспалительными состояниями. «Анемия критических заболеваний» может усугубляться частыми диагностическими флеботомиями или повышенной желудочно-кишечной кровопотерей, как это часто бывает в таких условиях.
«Анемия старения» является хронической анемией, сходной с анемией воспаления, но часто встречающейся у пожилых людей без определенного диагноза предрасполагающего основного заболевания. Распространенность этой анемии увеличивается с возрастом, и детальные исследования часто выявляют признаки воспаления, включая повышенный уровень С-реактивного белка в сыворотке или других биомаркеров воспаления. Анемия хронического заболевания почек обычно приписывается дефициту эритропоэтина, но накапливающиеся доказательства способствуют более сложному патогенезу с большим компонентом анемии воспаления, обострения которого могут проявляться как «резистентность к эритропоэтину».
Традиционным золотым стандартом для диагностики анемии воспаления была анемия с гипоферремией или с низким насыщением трансферрина, несмотря на присутствие окрашиваемого прусским синим железа в макрофагах костного мозга. Основным ошибочным диагностическим признаком, который также сопровождается анемией и гипоферремией, является железодефицитная анемия, при которой в макрофагах костного мозга нет окрашиваемого железа. Низкий уровень сывороточного ферритина (менее 15 нг / мл для населения в целом, в некоторых лабораториях, использующих возрастные и гендерные нормы), высокоспецифичен для дефицита железа (генетический дефицит L-ферритина является чрезвычайно редким исключением ) и эффективно исключает анемию воспаления, которая диагностируется, когда анемия и гипоферремия сопровождаются низким уровнем ферритина в сыворотке. Сывороточный ферритин повышается при воспалении, что частично отражает прямую воспалительную регуляцию синтеза ферропортина и частично потому, что сывороточный ферритин происходит из макрофагов, где его синтез увеличивается путем секвестрации железа , что происходит во время воспаления. Предполагается, что дефицит железа сосуществует с анемией воспаления, когда ферритин недостаточно повышен для интенсивности воспаления. Сывороточный ферритин также увеличивается при повреждении тканей, особенно печени.
Определение того, что представляет собой «неадекватно низкий» ферритин, может быть трудным на практике, потому что даже пациенты с очень высоким сывороточным ферритином могут реагировать на внутривенную терапию железом, повышая гемоглобин. В принципе, ограничения ферритина сыворотки может быть обойдена путем анализа дополнительных маркеров дефицита железа менее подверженых воздействию воспаления, наиболее заметным здесь является растворимый рецептор трансферрина. Когда анемия является клинически значимой и подозревается компонент дефицита железа у пациента с анемией воспаления, может быть целесообразным провести терапевтическое испытание внутривенного введения железа. Современные препараты железа для внутривенного введения достаточно безопасны, но очень редкие реакции на их введение и возможность обострения существующего или скрытого инфекционного процесса должны быть включены в анализ риска-пользы.
. По оценкам, старение населения и высокая распространенность хронических инфекций и воспалительных заболеваний во всем мире делают анемию воспаления второй по частоте причиной анемии в мире после дефицита железа. Этот порядок может в конечном итоге измениться, так как железодефицитная анемия более эффективно лечится или предотвращается с помощью пищевых добавок железа и мер общественного здравоохранения, которые лечат кишечные паразитарные инфекции.
Уже самые ранние исследования анемии воспаления показали, что это расстройство является следствием умеренного снижения выживаемости эритроцитов в сочетании с нарушением продукции эритроцитов. Повышенная деструкция эритроцитов в основном связана с активацией макрофагов воспалительными цитокинами, но другие гемолитические механизмы могут вносить вклад в специфические воспалительные заболевания. Подавление продукции эритроцитов имеет два основных компонента: ограничение железа и прямое влияние цитокинов на эритропоэтические предшественники. Эти эффекты в совокупности ограничивают эритропоэтический ответ на эритропоэтин, который становится недостаточным для компенсации увеличенного разрушения эритроцитов. В некоторых ситуациях выработка эритропоэтина также может быть снижена, возможно, из-за воздействия цитокинов на почечные клетки, которые вырабатывают гормон. При тяжелом воспалении или когда первичная патология поражает почки, снижение почечной экскреции гепсидина способствует накоплению гепсидина и ограничению железа.
Эксперименты с перелитыми эритроцитами показали, что эритроциты от пациентов с анемией воспаления и от нормальных контролей дольше выживали у здоровых реципиентов, чем у пациентов с анемией воспаления. Сокращение выживаемости эритроцитов при анемии воспаления объясняется активацией макрофагов воспалительными цитокинами, которые заставляют макрофаги глотать и разрушать эритроциты преждевременно. Анемия и чрезмерный эритрофагоцитоз являются характерными признаками синдромов активации макрофагов, особенно связанных с системным ювенильным ревматоидным артритом. Здесь лечение, нацеленное на IL-1 или IL-6, оказывается эффективным, что указывает на важную (хотя и косвенную) роль этих цитокинов в патогенезе чрезмерного эритрофагоцитоза. В мышиной модели множественные цитокины, включая интерферон-γ и IL-4, были вовлечены в активацию макрофагов для эритрофагоцитоза. За исключением молниеносных гемофагоцитарных состояний, которые, к счастью, редки, эритрофагоцитоз при анемии воспаления лишь незначительно увеличивается и может быть легко компенсирован, если продуцирование эритроцитов также не нарушается.
Концентрации железа в плазме находятся под гомеостатическим контролем печеночного железа, регулирующего гормон гепсидин, и обычно поддерживаются в диапазоне 10-30 мкМ. Гепсидин действует, регулируя доставку железа в плазму от макрофагов, которые рециркулируют стареющие эритроциты, от дуоденальных энтероцитов, которые поглощают пищевое железо, и от гепатоцитов, участвующих в хранении железа. Молекулярная мишень гепсидина является единственным известным клеточным экспортером железа ферропортина , экспрессируется на клеточных мембранах в тканях, которые доставляют железо в плазму. Связывание гепсидина с ферропортом вызывает эндоцитоз ферропорта и его последующий протеолиз в лизосомах. Потеря ферропортина из клеточных мембран вызывает пропорциональное снижение экспорта железа в плазму. Производство гепсидина гепатоцитами, в свою очередь, регулируется концентрацией железа в плазме и печени, а также воспалительными цитокинами, главным образом, IL-6. Воспалительные стимулы, вводимые людям или экспериментальным животным, вызывают снижение концентрации железа в сыворотке крови в течение нескольких часов. Ответ зависит от вызванного воспалением повышения концентрации гепсидина в плазме. Повышенный уровень гепсидина расщепляет клеточный ферропортин, задерживает железо в макрофагах, гепатоцитах и кишечных энтероцитах, так что меньше железа поступает в плазменный трансферрин. Отсек плазменного железа затем быстро истощается из-за продолжающегося поглощения железа предшественниками эритроида.
Природный эксперимент, синдром железо-резистентной железодефицитной анемии (IRIDA) , дает важное представление о роли гепсидина в регуляции эритропоэза и как патогенного компонента анемии воспаления. В остальном здоровые дети с IRIDA страдают от тяжелой микроцитарной, гипохромной анемии и гипоферремии, которые плохо реагируют на лечение пероральным введением железа и не полностью даже на лечение железом внутривенно . Большинство пациентов с IRIDA имеют гомозиготные или сложные гетерозиготные мутации в гене, кодирующем трансмембранную сериновую протеазу TMPRSS6 (также называемую матриптазой-2), что приводит к высоким или неуместно повышенным уровням гепсидина в сыворотке. Опосредованный гепсидином блок в абсорбции железа в двенадцатиперстной кишке, вероятно, ответственен за неэффективность пероральной терапии железом, а индуцированная гепсидином задержка железа в макрофагах снижает ответ на заместительную терапию железом внутривенно. Важно отметить, что пациенты с IRIDA продолжают иметь микроцитоз и гипохромию даже после терапии железом, что указывает на то, что синтез гемоглобина нарушается больше, чем выработка эритроцитов.
Анализ микрочипов эритробластов показал, что интерферон-γ способствует транскрипции PU.1 и его генов-мишеней в зависимости от IRF-1, но не влияет на GATA-1 или его мишени. PU. 1 и GATA-1 противодействуют активности друг друга, поэтому ожидается, что увеличение PU.1 будет способствовать развитию миелопоэза за счет эритропоэза. Во время инфекций вирусами или внутриклеточными патогенами, которые, как известно, индуцируют интерферон-γ, этот механизм может обеспечить достаточную продукцию моноцитов и макрофагов за счет временного нарушения эритропоэза. Используют ли другие воспалительные цитокины сходный или иной механизм, еще предстоит определить.
Потенциальные методы лечения анемии воспаления включают переливания эритроцитов, обычно предназначенные для лечения тяжелой и острой симптоматической анемии, и стимуляторы эритропоэза (ESAs): эритропоэтин и его производные, имитаторы или индукторы, когда они становятся доступными) с добавлением железа внутривенно или без него. Анти-IL-6 агенты (тоцилизумаб — одобрен для лечения ревматоидного артрита и ювенильного ревматоидного артрита , силтуксимаб ) и другие анти-цитокиновые препараты, которые косвенно понижают уровни IL-6, уже одобрены для лечения тяжелых воспалительных заболеваний.
Категория сообщения в блог:
