Что такое иммунный ответ при воспалении
Оглавление темы «Селезенка. Лимфатические узлы. Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Механизмы, контролирующие иммунную систему.»: Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Ранний защитный воспалительный ответ.Ранний защитный воспалительный ответ призван препятствовать внедрению и распространению возбудителя, по возможности быстро удалять его из организма. Ранний защитный воспалительный ответ разыгрывается в течение первых 4 сут после внедрения возбудителя. Ранний защитный ответ против внедрившихся в организм патогенных микроорганизмов обеспечивается факторами врожденного иммунитета, к которым относятся фагоцитирующие клетки крови и тканей, естественные киллеры, циркулирующие в крови белковые молекулы, обладающие защитными свойствами (компоненты системы комплемента и др.), а также межклеточные медиаторы — цитокины. Ранний воспалительный ответ стимулирует последующий специфический иммунный ответ, влияет на его форму, способствуя развитию наиболее эффективного против конкретного микроорганизма специфического иммунного ответа.
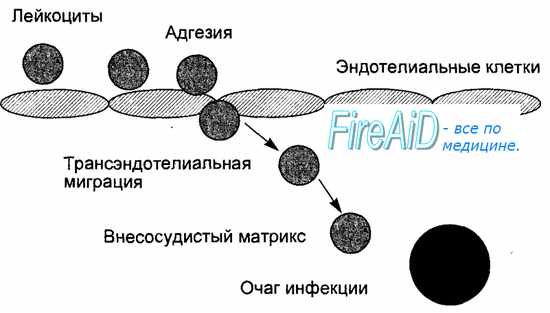
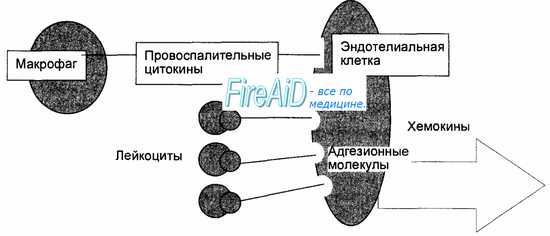
Ранний воспалительный ответ начинается с привлечения лейкоцитов из кровяного русла в очаг инфекции с последующей их активацией для удаления возбудителя (рис. 8.6). Мобилизация лейкоцитов в очаг инфекции стимулируется провоспалительными цитокинами, а опосредуется адгезионными молекулами на поверхности лейкоцитов и эндотелиальных клеток, а также молекулами хемокинов и их рецепторами. Провоспалительные цитокины (туморнекротизирующий фактор—ТНФ, интерлейкин-1 — ИЛ-1) продуцируются и секретируются макрофагами при фагоцитозе возбудителя. Под действием этих цитокинов на поверхности эндотелиальных клеток, появляются адгезионные молекулы вначале для нейтрофилов, а затем для моноцитов и лимфоцитов, ответственные за прилипание лейкоцитов к эндотелию сосудов. Кроме того, активированные цитокинами эндотелиальные клетки продуцируют хемокины, достигающие высокой концентрации на уровне очага инфекции (рис. 8.7). Этим обеспечивается прочная адгезия лейкоцитов к эндотелиальным клеткам с последующей их трансэндотелиальной миграцией и выходом в ткани в направлении очага инфекции (см. рис. 8.6). Таким образом, ранний воспалительный ответ проявляется инфильтрацией очага инфекции фагоцитирующими клетками, где эти клетки получают дополнительные сигналы активации от микробных продуктов и компонентов (липополисахарид клеточной стенки бактерий), от компонентов активированной системы комплемента и от провоспалительных цитокинов, в том числе, от гамма-интерферона, продуцируемого и секретируемого активированными естественными киллерами. Активированные фагоцитирующие клетки приобретают повышенную способность убивать захваченных микробов, что способствует удалению возбудителя. Активированные под влиянием провоспалительных цитокинов эндотелиальные клетки продуцируют молекулы вазодилататоров, под действием которых усиливается местный кровоток, повышается проницаемость сосудов для макромолекул фибриногена, который, покидая сосуды, превращается в фибрин, что способствует ограничению очага инфекции. В случае попадания в организм небольшого количества низковирулентных возбудителей ранний воспалительный ответ подавляет очаг инфекции.
Удаление из кровяного русла попавших в кровь единичных бактериальных клеток является функцией системы комплемента. Большая часть компонентов комплемента синтезируются гепатоцитами и мононуклеарными фагоцитами. Компоненты комплемента (С1, С2, СЗ, С4, С5, С6, С7, С8, С9, факторы В и D) содержатся в крови в неактивной форме. При попадании в кровяное русло бактерий на их поверхности каскад ферментативных реакций ведет к последовательной активации компонентов системы комплемента («альтернативный путь активации») с формированием мембран-атакующего комплекса (С5—С9), вызывающего лизис бактерий. В процессе активации системы комплемента накапливаются фрагменты, которые опосредуют разные биологические эффекты: привлечение лейкоцитов в очаг инфекции или воспаления (хемотаксис) — фрагмент С5а, усиление фагоцитоза (опсонизацию) — СЗb, индукцию синтеза и секреции медиаторов воспаления — С3а, С5а. (При развитии специфического иммунного ответа и появлении в кровяном русле комплексов антиген—антитело другой каскад ферментативных реакций ведет к активации системы комплемента — «классический путь активации») — Также рекомендуем «Представление антигена. Распознавание антигена. Взаимодействие Т-хелперов ( Тh1 ) с антигенпредставляющими клетками.» |
Схематическое представление первичной и вторичной иммунной реакции
Иммунный ответ — это сложная многокомпонентная, кооперативная реакция иммунной системы организма, индуцированная антигеном, уже распознанным как чужеродный, и направленная на его элиминацию. Явление иммунного ответа лежит в основе иммунитета. Иммунный ответ зависит от:
- антигена — свойства, состав, молекулярная масса, доза, кратность попадания, длительность контакта;
- состояния организма (иммунологическая реактивность);
- условий внешней среды.
Иммунный ответ различается врождённый и приобретённый (или адаптивный). Врождённый — это распознавание чужеродных раздражителей благодаря унаследованным механизмам, в то время как приобретённый иммунный ответ использует для распознавания рецепторы, число которых почти ничем не ограничено и они формируются в организме каждого человека. Приобретённый иммунный ответ может гибко реагировать на чужеродный раздражитель: если тот будет сочтён не опасным, то данный раздражитель в будущем больше не будет вызвать реакции (иммунологическая толерантность). Если же раздражитель классифицирован как опасный, последует продуктивный иммунный ответ, и чужеродные цели-раздражители будут устранены.
Иммунный ответ действует на вторжение болезнетворных микроорганизмов в организм (бактерии, вирусы, грибки, паразиты) либо патологически изменённые клетки собственного тела (злокачественная опухоль). Иммунный ответ против нормальных клеток организма может возникать, когда собственные вещества организма ошибочно воспринимаются как чужеродные (аутоиммунные заболевания). Кроме этого, безвредные вещества из окружающей среды также ошибочно могут быть классифицированы как опасные и вызывать реакцию (аллергия). С другой стороны, если патогенам удаётся избежать иммунного ответа, то это приводит к ускользанию от иммунного ответа (нем. Immunevasion).
Механизмы, которые вызывают устранение вторгнувшихся в организм патогенов в ходе иммунного ответа, чрезвычайно разнообразны. Система комплемента состоит из самоорганизующихся белковых комплексов, которые помечают агента или могут напрямую убить его. Микробицидные вещества высвобождаются клетками вне иммунной системы, также могут быть активированы разнообразные макрофаги и клетки-киллеры, а антитела начнут связываться с высокоспецифичными чужеродными структурами. Обычно несколько таких эффекторных механизмов действуют одновременно с тем, чтобы обеспечить полное удаление патогенов из организма. Тем не менее, чрезмерная реакция иммунной системы должна предотвращаться, так как это может привести к серьёзным повреждениям или даже некрозу тканей, а также летальному исходу (анафилактический или септический шок, гиперцитокинемия). Кроме того, значительная реакция против собственного тела также должна быть исключена, чтобы предотвратить аутоиммунные заболевания. Таким образом, в иммунной системе присутствует множество регуляторных механизмов для того, чтобы соблюдался баланс между защитным и вредным иммунным ответом.
Врождённый иммунный ответ[править | править код]
Во врождённом иммунном ответе участвует большое разнообразие типов клеток и переменных факторов, что в совокупности образует тесно связанную и скоординированную форму защитной системы. Это обусловлено характеристиками возбудителей иммунной реакции, которые распознаются врождёнными рецепторами — отсюда термин «врождённая иммунная реакция». Такой иммунный ответ происходит быстро и эффективно: через считанные минуты после проникновения в организм большинство болезнетворных микроорганизмов обнаруживаются и обезвреживаются, а спустя несколько часов они полностью устранены.
Приобретённый иммунный ответ[править | править код]
Посредством фагоцитоза активированные вирусом макрофаги затем «назначаются» иммунной системой для специфического или адаптивного приобретённого иммунного ответа. В свою очередь он различается на 2 вида: гуморальный и клеточный иммунный ответ.
Гуморальный иммунный ответ[править | править код]
Гуморальный иммунный ответ организма представляет собой антитела против патогенов, в основном находящихся в жидкости крови и лимфы, а также в бесклеточной плазме или в сыворотке крови. Специфические антитела, также называемые иммуноглобулинами, — это белковые молекулы, которые продуцируются и высвобождаются плазматическими клетками и действуют в кровяном и лимфатическом потоках.
Плазматические клетки являются потомками активированных B-лимфоцитов. Активация B-лимфоцита происходит путём связывания соответствующего антигена с распознающим антигены B-клеточным рецептором. Это специфические иммуноглобулины, закреплённые в клеточной мембране B-клетки.
Гиперчувствительность и аллергия[править | править код]
Гиперчувствительность (создаваемая антителами анафилаксия и клеточно-опосредованная аллергия) является приобретённым иммунным ответом с «памятью». Такой иммунный ответ может наступать в качестве контактного дерматита против химически чистых веществ после первичного или нескольких повторных контактов с аллергеном. Клеточно-опосредованным иммунным ответом может являться отторжение экзогенных трансплантированных органов.
Литература[править | править код]
- Jörg Hacker, Jürgen Heesemann. Molekulare Infektionsbiologie. — 1-е издание. — Heidelberg, Berlin: Spektrum Akademischer Verlag, 2000. — ISBN 3-86025-368-9.
- Michael T. Madigan, John M. Martinko. Brock Biology of Microorganisms. — 11-е международное издание. — Upper Saddle River, NJ., USA: Pearson Prentice Hall, 2006. — 992 с. — ISBN 978-0131443297.
- Peter F. Zipfel, Peter Kraiczy, Jens Hellwage: Das tägliche Versteckspiel: Wie Mikroorganismen der Immunabwehr entgehen. Biologie in unserer Zeit 32(6), S. 371 — 379 (2002), ISSN 0045-205X
- Diethard Baron, Jürgen Braun, Andreas Erdmann: Grüne Reihe. Genetik. Materialien S II. (Lernmaterialien)
- Charles A. Janeway, Paul Travers, Mark Walport: Immunobiology. B&T; 6. Auflage (2005) ISBN 0815341016.
Воспаление — это первая линия иммунной защиты и реализуется клетками и гуморальными факторами, для которых стимулом их функциональной активности является само повреждение. Однако не только повреждение инициирует воспаление. Нельзя исключить участие в этом процессе бактериальных липополисахаридов и пептидогликанов, которые несвойственны нормальным клеткам. Однако нам представляется, что наиболее универсальной мишенью для ориентации иммунокомпетентных клеток и гуморальных факторов на реализацию воспалительной реакции являются концевые сахара (манноза) мембранных гликопротеинов и гликолипидов, освобождающиеся в результате повреждения, трансформации, усиленной пролиферации или старения клетки. Это, так называемое «универсальное чужое» без дифференциации на индивидуальные антигены. Совершенно прав А.А. Ярилин (1999), который говорит, что «на уровне первой линии защиты понятие антиген не имеет смысла». Мы не будем останавливаться на деталях и этапах воспалительного процесса, которые достаточно хорошо описаны и всем известны. Выделим только главное, необходимое для понимания логики иммунитета и возможных механизмов его участия в повреждении.
Основными действующими лицами воспаления являются нейтрофилы, макрофаги/моноциты, NK-клетки, иногда эозинофилы, система комплемента, воспалительные цитокины (ИЛ-1, ИЛ-6, ФНО-альфа, интерфероны), белки острой фазы, БАВ (кинины, гистамин, гепарин, простагландины, лейкотриены и др.). В своем взаимодействии они способствуют локализации и уничтожению патогена. Главный удар на себя в этом процессе берут нейтрофилы и макрофаги/моноци- ты. Нейтрофилы не только фагоцитируют, но и могут осуществлять внеклеточный цитолиз, а также секрецию цитокинов и других БАВ. Благодаря возможности развития внеклеточного цитолиза, длительно существующее воспаление может способствовать повреждению собственных тканей и приобретать все черты локального аутоиммунного процесса, особенно если для участия в ликвидации патогена привлекаются эозинофилы, известные своим приоритетом в реализации внеклеточного цитолиза.
Чрезвычайно важным является участие в воспалении макрофагов/моноцитов. Становится понятной столь значимая роль этих клеток в презентации антигена и запуске специфичного иммунного ответа. Первично контактируя с патогеном макрофаги/моноциты не только участвуют в его ликвидации, но и презентируя его антигены инициируют присоединение следующего более мощного этапа, включающего весь арсенал иммунной системы (клеточный, гуморальный иммунитет, ГНТ, ГЗТ) уже специфически ориентированный на данные антигены. Естественно, что это относится к тимусзависимым антигенам, однако в последнее время появились данные о существовании презентации и при тимуснезависимых антигенах. Специфический этап — это не только более мощный, но и более качественный этап защиты, поскольку специфическая ориентация практически исключает возможность повреждения нормальных структур организма, существующую при обычном воспалении. Специфический этап лимитирует возможности повреждения организма патогеном. Надо думать, что подключение специфического этапа снимает необходимость в воспалительной реакции, а время развертывания этого этапа определяет длительность существования клинической картины заболевания. Логическим завершением этого этапа является не только полноценная и качественная санация от патогена, но и создание иммунологической памяти, обеспечивающей оперативную защиту при повторном попадании антигена без какого-либо ущерба для организма.
Таким образом, длительное существование воспалительного процесса (хроническое воспаление) однозначно свидетельствует о несостоятельности специфического этапа иммунного ответа, связанного со структурными или функциональными дефектами в иммунной системе и всегда является риском развития иммунопатологии.
Приведенные данные позволяют более четко представить логику взаимосвязи неспецифического и специфического в обеспечении рационального и качественного иммунного ответа. Вместе с тем, нет единого мнения о центральной роли макрофагов/моноцитов, участвующих в воспалительной реакции, в инициации специфического этапа. А.А. Ярилин (1999) считает, что эти клетки не могут значимо участвовать в презентации антигена, поскольку они не мигрируют в лимфатические узлы и в активированном состоянии делят антиген на слишком мелкие фрагменты. Однако известный факт более качественного иммунитета после перенесенной болезни по сравнению с вакцинацией позволяет считать, что презентация антигена из очага воспаления обеспечивает лучший иммунный ответ по сравнению с другими источниками. По крайней мере, для кожи такие клетки известны — это клетки Лангерганса или белые эпидермиоциты, которые, захватывая в очаге поражения антиген, мигрируют в лимфоузлы по пути трансформируясь в дендритные клетки. Что касается слизистых — требуются дальнейшие исследования, однако не считаться со значимостью макрофагов/моноцитов в этом процессе в настоящее время нельзя.
Иммунная система. ВоспалениеИммунная система и процесс воспаления участвуют в защите организма от проникающих в него микроорганизмов, отвечая на повреждение. Однако неадекватная активация этих систем приводит к широкому спектру воспалительных нарушений. Воспаление характеризуется следующими признаками: • расширением сосудов, ведущим к покраснению тканей; Физиология воспалительного процесса обладает некоторыми сходными характеристиками с физиологией повреждения. Реакции, которые они опосредуют, имеют цель обеспечить ответ организма на вторжение микроорганизмов, стресс или увеличение местного кровотока в области повреждения, обеспечивая тем самым миграцию в эту область лейкоцитов и других форменных элементов крови. Реакции обеспечивают выполнение большого количества важных процессов: возникновение боли в попытке уменьшить степень повреждения, изменение местной среды для уменьшения концентрации повреждающих веществ и миграцию лейкоцитов для уничтожения микроорганизмов.
Кроме того, многие аутакоиды, выделяемые в ответ на повреждение или инфекцию, вызывают увеличение сосудистой проницаемости, приводящее к отеку, и обеспечивают процесс регенерации и защиты ткани, который в случае неадекватности может приводить к изменению функции ткани. Ключевой дополнительной характеристикой иммунного ответа является способность лимфоцитов распознавать чужеродные белки (антигены), которые могут быть поверхностными белками на патогенах или, у некоторых людей, совершенно безвредными белками (такими как пыльца растений или чешуйки кожи животных), вызывающими аллергические реакции. Лимфоциты образуются из стволовых клеток костного мозга, затем в тимусе развиваются Т-лимфоциты, а в костном мозге — В-лимфоциты. Т-лимфоциты имеют на своей поверхности антигенные Т-клеточные рецепторы. Т-лимфоциты специфически распознают антигены, ассоциированные с главным комплексом гистосовместимости (HLA-антигены), на антигенпрезентирующих клетках — макрофагах и дендритных клетках. В случае активации Т-лимфоцитов посредством антигена через Т-клеточные рецепторы продуцируются растворимые белки, называемые цитокинами, которые передают сигнал Т-лимфоцитам, В-лимфоцитам, моноцитам/макрофагам и другим клеткам. Т-лимфоциты классифицируют на два подвида: — Также рекомендуем «В-лимфоциты. Причины начала воспаления» Оглавление темы «Препараты влияющие на иммунную систему»: |