Что такое воспаление крови у новорожденного

Полицитемия у новорожденных – синдром увеличенной концентрации клеточных элементов крови (в большей степени эритроцитов). В клинике отмечается угнетение ЦНС и признаки полнокровия: вишневый цианоз, учащение дыхания и сердцебиения и др. Сгущение крови проявляется нарушениями микроциркуляции, приводящими к полиорганной недостаточности с возможным развитием инфарктов в различных органах. Диагноз подтверждается лабораторно на основании показателя центрального венозного гематокрита выше 65%. Лечение полицитемии у новорожденных – частичная обменная гемотрансфузия. Также проводится терапия основного заболевания.
Общие сведения
Полицитемия у новорожденных связана с увеличением общего числа клеток крови всех трех ростков, поэтому с этим синдромом не стоит путать эритроцитоз, когда возрастает только количество эритроцитов. Тем не менее, в данном случае эритроцитарный росток подвержен усиленному росту в большей степени. Синдром наблюдается у 0,4-12% новорожденных, чаще встречается у недоношенных детей, однако поздние роды также увеличивают риск развития полицитемии у новорожденных, поскольку при перенашивании происходит обезвоживание, приводящее к сгущению крови. Актуальность синдрома в педиатрии связана с отдаленными последствиями гипоксии, особенно для мозга, что в той или иной степени всегда влечет за собой неврологические последствия. Ребенок может отставать в развитии, страдать от нарушений социальной адаптации и т. д.
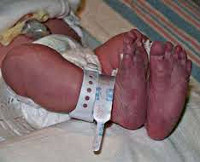
Полицитемия у новорожденных
Причины полицитемии у новорожденных
Увеличение количества клеток крови, особенно эритроцитов, связано с недостаточным поступлением кислорода, при этом гипоксия может развиваться и внутриутробно, и уже после рождения. В первом случае причиной становятся патологии плаценты, поскольку именно через плацентарные сосуды плод получает кислород. Это может быть фетоплацентарная недостаточность, аномалии сосудов плаценты, туберкулезное поражение и др. Определенную роль играют вредные привычки матери, в частности, курение, которое тоже способствует внутриутробной гипоксии. Недостаточное поступление кислорода наблюдается также при имеющихся у матери пороках сердца. Изредка в патогенезе участвует позднее перевязывание пуповины, которое приводит к существенной гиперволемии в первые часы жизни малыша.
Полицитемия у новорожденных связана и с множеством причин со стороны ребенка. К развитию данного состояния приводят пороки сердечно-сосудистой системы и легочного аппарата, внутриутробные инфекции, заболевания надпочечников и щитовидной железы. Некоторые генетические дефекты также могут проявляться увеличением числа клеток крови. Такое нарушение встречается при хромосомных аномалиях – болезни Дауна, синдроме Беквита-Видемана, трисомии 13 и др. Гемоглобинопатии, при которых эритроциты труднее расстаются с молекулой кислорода, также приводят к гипоксии и, как следствие, к полицитемии у новорожденных.
Патогенез данного состояния обусловлен высокой вязкостью крови, нехарактерной для ребенка такого возраста. В результате все внутренние органы начинают страдать от повышенной нагрузки. Это имеет особое значение в случае жизненно важных органов (сердца, легких и головного мозга), однако нарушения деятельности остальных органов и систем также могут способствовать утяжелению состояния ребенка и ухудшению прогноза. Большинство клинических симптомов полицитемии у новорожденных фактически отражают последствия нарушений микроциркуляции, связанных с множественной закупоркой капилляров эритроцитарными сладжами (скоплениями клеток).
Классификация и симптомы полицитемии у новорожденных
Выделяют первичную и вторичную полицитемию у новорожденных. Первичная (истинная) полицитемия связана с поражением гемопоэтического ростка, из-за чего наблюдается неадекватно высокий рост количества эритроцитов, лейкоцитов и тромбоцитов. Доброкачественная семейная полицитемия также относится к первичным формам патологии. Все остальные варианты являются реакцией на изменения в среде (например, на гипоксию) или во внутренних органах (пороки развития и др.), а потому считаются вторичными. Полицитемия у новорожденных делится на нормоволемическую и гиперволемическую, при последней увеличено не только количество клеток крови, но и объем ее жидкой фракции.
Основной симптом полицитемии у новорожденных, свидетельствующий о полнокровии, – это плетора. Представляет собой характерный вишневый оттенок кожи, сочетающийся с периферическим цианозом. Ребенок внешне вялый, плохо сосет, отмечается гипотония, мышечная дистония, тремор, судороги, возможны приступы апноэ. Реже встречается повышенная нервная возбудимость. Дыхание и сердцебиение учащены, поскольку организм пытается справиться с увеличенным объемом крови и ее повышенной вязкостью. Отмечаются явления полиорганной недостаточности, проявляющиеся сниженным сердечным выбросом, легочной гипертензией, респираторным дистресс-синдромом.
Могут наблюдаться признаки внутрижелудочковых кровоизлияний и инфарктов мозга. Со стороны желудочно-кишечного тракта отмечаются такие симптомы, как срыгивание и рвота, иногда развивается некротический энтероколит новорожденных и даже спонтанная перфорация стенки кишечника. Нередко присоединяется клиника острой почечной недостаточности, которая проявляется наличием белка или крови в моче, дизурическими явлениями и др. Возможен тромбоз почечных вен и приапизм. Как видно из приведенного перечня симптомов, клиника полицитемии у новорожденных многообразна и неспецифична, что существенно осложняет своевременную постановку точного диагноза. Примерно в 40% случаев симптомы слабо выражены или отсутствуют.
Диагностика полицитемии у новорожденных
Полицитемия у новорожденных не имеет каких-либо патогномоничных проявлений. Заподозрить патологию при физикальном осмотре педиатру позволяет плетора. В целом диагноз базируется на результатах лабораторных исследований. Важным показателем является центральный венозный гематокрит, который при данном состоянии превышает 65%. Биохимические анализы крови всегда обнаруживает гипогликемию, гипокальциемию, гипомагниемию. Остальные диагностические мероприятия нацелены на выявление причины полицитемии у новорожденных.
Пороки сердца подтверждаются ЭКГ и ЭхоКГ-диагностикой. Аномалии развития и заболевания легких определяются при рентгенологическом исследовании. При подозрении на каждую конкретную нозологию используются свои методы диагностики. При этом важно понимать, что полицитемия у новорожденных может быть вариантом нормы. Также важно отличать данное состояние от сгущения крови, когда полицитемия является относительной и происходит вследствие уменьшения объема жидкой части крови. Это случается при обезвоживании, например, при длительной фототерапии или нахождении под источником лучистого тепла, проблемах с энтеральным питанием (частое срыгивание, жидкий стул, в том числе инфекционного генеза) и др.
Лечение полицитемии у новорожденных
Тактика терапии определяется двумя составляющими: центральным венозным гематокритом и наличием или отсутствуем клинических проявлений. Часто показатели центрального венозного гематокрита соответствуют полицитемии у новорожденных, а состояние ребенка остается хорошим, признаки нарушения микроциркуляции отсутствуют. В этом случае рекомендуется выжидательная тактика с постоянным мониторингом гематокрита и состояния внутренних органов. Исключение составляют случаи, когда венозный гематокрит превышает 70%. Это является показанием к началу терапевтических мероприятий даже без наличия симптомов.
Если полицитемия у новорожденных проявляется клинически, единственным способом лечения становится частичная обменная гемотрансфузия. По специально выведенной формуле определяется объем крови, который забирается у ребенка. Вместо него производят переливание физиологического раствора. Таким способом достигают гемодилюции, то есть восстановления нормальной концентрации клеточных элементов крови, что приводит к устранению микроциркуляторных расстройств. Белковые растворы не применяются, поскольку могут стать причиной повышения концентрации фибриногена, что также нетипично для состава крови новорожденного, а потому представляет дополнительную опасность.
Прогноз и профилактика полицитемии у новорожденных
Прогноз определяется основным заболеванием, но, как правило, остается неблагоприятным. В большинстве случаев причиной полицитемии у новорожденных становится гипоксия, а она является губительной для головного мозга, поскольку приводит к необратимым деструктивным изменениям. В дальнейшем такие дети могут отставать в развитии (ЗПР, ЗРР, олигофрения), возможна инвалидность. Особую опасность представляют бессимптомные случаи, которые могут оставаться незамеченными в течение долгого времени. Профилактика полицитемии у новорожденных возможна на внутриутробном этапе и заключается в устранении возможных причин гипоксии. Осуществляется лечение фетоплацентарной недостаточности и коррекция соматического состояния матери, беременной женщине рекомендуют отказаться от вредных привычек и др.
Воспаление крови – сепсис – возникает из-за развития бактериальной (стафилококковой, стрептококковой и других) инфекции в кровяных клетках. Прогрессирует это заболевание стремительно и приводит к сильному истощению организма, а без терапии может даже убить человека. Как распознать в домашних условиях и в лаборатории воспаление крови и вылечить его?
Причины воспаления крови
Как часто человек получает незначительные травмы и царапины? Почти каждый день нарушается целостность кожного покрова, часто повреждения заживают быстро и без последствий. Если же рана была глубокой, то на ее месте формируется зона воспаления, в которой активно развиваются бактерии. В таком состоянии они изолированы от других тканей организма, поэтому не так опасны.
Если оставить глубокую рану без лечения антибиотиками и стерильной повязки, то возбудитель инфекции может попасть в кровяное русло и вызывать сепсис. Воспаление крови происходит не в самой плазме, а в кровяных клетках: эритроцитах, тромбоцитах и лейкоцитах, реже затрагивается костный мозг, который «вырабатывает» эти клетки.
Основные причины сепсиса:
- бактериальная инфекция в тканях;
- развитие патогенных микроорганизмов во внутренних органах;
- прорыв воспалительной зоны и высвобождение бактерий в кровь.
Последствия воспаления крови
Чем опасен сепсис догадаться несложно. Во-первых, за короткое время воспаление уничтожает множество клеток крови, из-за этого происходят негативные изменения в работе иммунной системы, хуже транспортируется кислород и нарушается свертываемость крови. Во-вторых, когда бактерии разрушают клетки крови, из них в плазму выделяется множество токсических отходов, которые за короткое время поражают почки и печень.
Без лечения воспаление крови усиливается, иммунная система сильно угнетается, у человека держится постоянно высокая температура. Из-за этого нарушается структура белков крови, происходит сбой в работе печени и почек, человек может умереть.
Симптомы воспаления крови
Симптомы сепсиса появляются через 3-4 дня после его возникновения. За это время разрушаются первые зараженные клетки, высвобождаются токсичные отходы бактерий, и начинается воспаление. Человек испытывает в это время такие симптомы:
- резкое ухудшение самочувствия;
- головокружение;
- повышенная температура 38-39 градусов;
- тошнота, пожелтение кожи;
- ухудшение аппетита.
Через некоторое время состояние больного значительно ухудшается. Из-за большого количества свободного билирубина в крови, который вышел из зараженных эритроцитов, нарушается работа печени и почек, желтеет склера глаз, изменяется стул и цвет мочи.
В больницу желательно обратиться сразу же, если температура 38-39 градусов держится дольше 2 дней, но при этом симптомов простуды или гриппа нет. Своевременная терапия поможет быстро справиться с сепсисом и избежать осложнений на почки и печень.
Методы определения сепсиса
Точно определить, есть ли воспаление крови у пациента, и каковы его причины, может только лабораторный анализ. Существует несколько методик, позволяющих выявить сепсис.
Бактериальный анализ
Чтобы провести анализ на сепсис, можно сделать бактериальный посев крови на питательную среду. Когда вырастут колонии бактерий, подсчитав их количество и рассмотрев в микроскоп мазок из культуры, врач может точно определить диагноз и разновидность патогена, что необходимо для дальнейшего лечения.
Недостаток этого метода диагностики состоит в том, что он может показать наличие или отсутствие бактерий в крови только через 3-5 дней после его проведения, ведь микроорганизмам нужно время, чтобы вырасти и сформировать колонии. Но такой анализ дает полную информацию о виде возбудителя сепсиса и позволяет правильно подобрать антибиотики.
Анализ на лейкоциты
Лейкоциты – защитные клетки крови, участвующие в иммунных реакциях. Существуют разные виды этих «защитников», и работают они в разных участках организма. Например, лейкоциты-макрофаги чистят ткани от инфекций, а базофилы, лимфоциты и нейтрофилы следят за состоянием жидких тканей: лимфы и крови.
Во время воспаления крови происходят изменения в работе костного мозга, он начинает воспроизводить лейкоциты в больших количествах, чтобы быстрее справиться с инфекцией и спасти организм. С повышенной скоростью вырабатываются такие клетки, как моноциты и базофилы, а также макрофаги. Анализ на лейкоциты поможет точно показать, есть ли у человека сепсис.
В крови здорового человека в зависимости от его возраста и стиля жизни на один литр приходится от 4,5 до 8,5 миллиарда лейкоцитов. Такое количество позволяет нормально функционировать иммунной системе. Если же лейкоциты в крови превышают норму, то такое изменение говорит либо об аллергической реакции, либо о воспалительном процессе.
Анализ на лейкоциты стоит дороже, но дает быстрый эффект.
Точный результат можно получить уже на 2-3 день после манифестации воспаления, ведь иммунные клетки начинают активно делиться почти сразу после проникновения инфекции. Но анализ на лейкоциты имеет существенный недостаток – он не может определить разновидность патогена, поэтому для лечения будут использовать антибиотики широкого спектра, а это сложнее переносится организмом.
Лечение воспаления крови
После того как врач направил пациента на анализ и поставил по его результатам диагноз, он может начать лечение воспаления крови. Сразу стоит отметить, что терапия сепсиса проводится только в больничных условиях под присмотром квалифицированного специалиста, никакие народные или домашние методы не помогут избавиться от бактериальной инфекции, а лишь усугубят ситуацию.
Антибиотики
Главное лекарство, которое используется для лечения сепсиса – антибиотики. Если анализ показал вид патогена, то врач может выбрать определенную направленность препарата. Когда болезнь развивается стремительно и возможности определить вид бактерий нет, то используются антибиотики широкого спектра. Второй вариант сложнее переносится организмом, ведь эти медикаменты содержат больше активных веществ, поэтому дольше разрушаются в печени, также они могут убить не только бактериальные клетки, но и собственную микрофлору человека.
Пребиотики
Совместно с антибиотиками всегда назначают пребиотики, ведь первая группа медикаментов в любом случае будет вызывать изменения в составе микрофлоры кишечника, а это может привести к дисбактериозу и грибковым инфекциям. Курс пребиотиков начинается на 4-5 день лечения.
Очищение от токсинов
Сепсис сопровождается сильной интоксикацией, вызывающей патологические изменения в печени и почках. Чтобы облегчить работу этих органов и быстрее вывести токсины, больному ставят капельницу с физиологическим раствором и определенными препаратами, ускоряющими выведение токсинов.
Противовоспалительные лекарства
Сепсис сопровождается сильным воспалением и температурой, такие симптомы нарушают работу всего организма, поэтому их нужно быстро снять. Для этого используются препараты на основе интерферона и ибупрофена. Они быстро снимают воспаление, болевой синдром, жар и слабость.
Профилактика
Сепсис возникает из-за неправильного ухода за ранами или отсутствия лечения бактериальных инфекций, поэтому лучшей профилактикой его будет своевременное обращение к врачу при травмах и воспалительных процессах, следование его рекомендациям. Часто воспаление крови возникает из-за использования методик домашнего лечения разных инфекционных заболеваний, поэтому от них тоже стоит отказаться.
Воспаление крови развивается стремительно, нарушает работу организма и без лечения может привести к летальному исходу. Возникает оно из-за неправильного ухода за ранами или отсутствия лечения инфекций. Обращаться к врачу нужно сразу, обнаружив у себя симптомы сепсиса, ведь домашнее лечение тут бессильно.
Лейкоцитоз и лейкопения у детей
Изменения белой крови могут выражаться в увеличении и снижении числа лейкоцитов. Повышение числа лейкоцитов (у детей выше 10х109/л) называется лейкоцитозом, снижение (менее 5х109/л) _ лейкопенией. Важно знать, за счет каких форменных элементов белой крови происходит повышение или снижение числа лейкоцитов. Изменение числа лейкоцитов чаще может происходить за счет нейтрофилов или лимфоцитов. Реже наблюдается изменение числа эозинофилов и моноцитов. Нейтрофильный лейкоцитоз — абсолютный нейтрофилез — свойствен септическим и гнойно-воспалительным заболеваниям (сепсис, пневмония, гнойные менингиты, остеомиелит, аппендицит, гнойный холецистит). Нейтрофилез при гнойно-септических заболеваниях сопровождается некоторым омоложением — сдвигом в лейкоцитарной формуле влево до палочкоядерных и юных, реже до миелоцитов. Менее выражен нейтрофилез при дифтерии, скарлатине. При злокачественных заболеваниях крови у детей — гемопатиях (особенно при лейкозах) — может наблюдаться особенно высокий лейкоцитоз, характерной особенностью которого является наличие в периферической крови незрелых форменных элементов (лимфо- и миелобластов). При хроническом лейкозе лейкоцитоз особенно высок (несколько сотен тысяч), причем в формуле белой крови присутствуют все переходные формы лейкоцитов. При остром лейкозе в формуле крови обычно наблюдается hiatus leicemicus, когда в периферической крови присутствуют как особенно незрелые клетки, так и в небольшом числе зрелые (сегментоядерные нейтрофилы) без переходных форм. Лимфоцитарный лейкоцитоз — абсолютный лимфоцитоз — свойствен бессимптомному инфекционному лимфоцитозу (иногда выше 100х109/л), коклюшу — (20…30)х 109/л, инфекционному мононуклеозу. При первых двух заболеваниях — лимфоциты зрелые, при инфекционном же мононуклеозе необычной формы — широкоцитоплазменные. Лимфоцитоз за счет незрелых клеток — лимфобластов — свойствен лимфоидному лейкозу. Относительный лимфоцитоз отмечается при вирусных инфекциях (грипп, острые респираторно-вирусные заболевания, корь, краснуха и др.).
Эозинофильные лейкемоидные реакции в виде нарастания числа эозинофилов в периферической крови свойственны аллергическим заболеваниям (бронхиальная астма, сывороточная болезнь), гельминтозам (аскаридоз, токсокароз и др.) и протозойным инфекциям (лямблиоз и др.). Иногда наблюдаются моноцитарные лейкемоидные реакции, природа которых не всегда ясна. Относительный моноцитоз свойствен коревой краснухе, малярии, лейшманиозу, дифтерии, ангине Венсана-Симановского, эпидемическому паротиту и др.
Лейкопении чаще наблюдаются за счет снижения содержания нейтрофилов — нейтропении. Нейтропенией у детей считается снижение абсолютного числа лейкоцитов (нейтрофилов) на 30% ниже возрастной нормы. Нейтропении могут быть врожденными и приобретенными. Часто они возникают после приема лекарственных препаратов (особенно цитостатических — 6-меркаптопурина, циклофосфана и др., используемых при лечении онкологических больных, а также сульфаниламидов, амидопирина), в период выздоровления от брюшного тифа, при бруцеллезе, в период сыпи при кори и краснухе, при малярии. Лейкопении свойственны вирусным инфекциям, а также ряду заболеваний, отличающихся особо тяжелым течением.
Нейтропения в сочетании с тяжелой анемией отмечается при гипопластической анемии. Относительная и абсолютная лимфопения наблюдается при иммунодефицитных состояниях. Она развивается через несколько месяцев от начала клинических признаков иммунодефицита (преимущественно за счет Т-лимфоцитов).
Геморрагический синдром у детей
Под термином «геморрагический синдром» понимают повышенную кровоточивость в виде кровотечений из слизистых оболочек носа, появления кровоизлияний в кожу и суставы, желудочно-кишечных кровотечений и т. д. В клинической практике целесообразно выделять несколько типов кровоточивости.
- При гематомном типе определяются обширные кровоизлияния в подкожную клетчатку, под апоневрозы, в серозные оболочки, в мышцы и суставы с развитием деформирующих артрозов, контрактур, патологических переломов. Наблюдаются профузные посттравматические и послеоперационные кровотечения, реже — спонтанные. Выражен поздний характер кровотечений, т. е. спустя несколько часов после травмы. Гематомный тип характерен для гемофилии А и В (дефицит VIII и IX факторов).
- Петехиально-пятнистый, или микроциркуляторный, тип характеризуется петехиями, экхимозами на коже и слизистых оболочках, спонтанными или возникающими при малейших травмах кровотечениями — носовыми, десневыми, маточными, почечными. Гематомы образуются редко, опорно-двигательный аппарат не страдает. Послеоперационные кровотечения, кроме кровотечений после тонзиллэктомии, не отмечаются. Часты и опасны кровоизлияния в головной мозг; как правило, им предшествуют петехиальные кровоизлияния в кожу и слизистые оболочки. Микроциркуляторный тип наблюдается при тромбоцитопениях и тромбоцитопатиях, при гипо- и дисфибриногенемиях, дефиците X, V и II факторов.
- Смешанный (микроциркуляторно-гематомный) тип характеризуется сочетанием двух ранее перечисленных форм и некоторыми особенностями: преобладает микроциркуляторный тип, гематомный тип выражен незначительно (кровоизлияния преимущественно в подкожную клетчатку). Кровоизлияния в суставы редки. Такой тип кровоточивости наблюдается при болезни Виллебранда и синдроме Виллебранда-Юргенса, поскольку дефицит коагулянтной активности плазменных факторов (VIII, IX, VIII + V, VII, XIII) сочетается с дисфункцией тромбоцитов. Из приобретенных форм такой тип кровоточивости может быть обусловлен синдромом внутрисосудистого свертывания крови, передозировкой антикоагулянтов.
- Васкулитно-пурпурный тип обусловлен экссудативно-воспалительными явлениями в микрососудах на фоне иммуноаллергических и инфекционно-токсических нарушений. Наиболее распространенным заболеванием этой группы является геморрагический васкулит (или синдром Шенлейна-Геноха). Геморрагический синдром представлен симметрично расположенными, преимущественно на конечностях в области крупных суставов, элементами, четко отграниченными от здоровой кожи. Элементы сыпи выступают над ее поверхностью, представлены папулами, волдырями, пузырьками, которые могут сопровождаться некрозом и образованием корочек. Возможно волнообразное течение, «цветение» элементов от багряного до желтого цвета с последующим мелким шелушением кожи. При васкулитно-пурпурном типе возможны абдоминальные кризы с обильными кровотечениями, рвотой, макро- и (чаще) микрогематурией.
- Ангиоматозный тип характерен для различных форм телеангиэктазий. Наиболее частый тип — болезнь Рандю-Ослера. При этом типе кровоточивости нет спонтанных и посттравматических кровоизлияний в кожу, подкожную клетчатку и другие органы, но имеются повторные кровотечения из участков ангиоматозно-измененных сосудов — носовое, кишечное, реже — гематурия и легочные.
Клиническое выделение этих вариантов кровоточивости позволяет определять комплекс лабораторных исследований, необходимых для уточнения диагноза или причины геморрагического синдрома.
Недостаточность костномозгового кроветворения
Миелофтиз может развертываться остро, когда наблюдается поражение какими-то миелотоксическими факторами, например большой дозой бензола или проникающей радиацией. Иногда такая реакция возникает у детей вследствие индивидуальной высокой чувствительности к антибиотикам (например, левомицетину), сульфаниламидам, цитостатикам, средствам противовоспалительным или обезболивающим. При тотальном поражении всех ростков костномозгового кроветворения говорят о «панмиелофтизе», или тотальной аплазии кроветворения. Общие клинические проявления могут включать в себя высокую лихорадку, интоксикацию, геморрагические сыпи или кровотечения, некротическое воспаление и язвенные процессы на слизистых оболочках, локальные или генерализованные проявления инфекций или микозов. В крови — панцитопения при отсутствии признаков регенерации крови, в пунктате костного мозга — обеднение клеточными формами всех ростков, картина клеточного распада и опустошения.
Гораздо чаще недостаточность кроветворения у детей проявляется как медленно прогрессирующее заболевание, и его симптоматика соответствует наиболее вовлеченному ростку кроветворения. В педиатрической практике могут встречаться больные с врожденными конституциональными формами недостаточности кроветворения.
Конституциональная апластическая анемия, или анемия Фанкони, в наиболее типичных случаях выявляется после 2-3 лет, но иногда и в старшем школьном возрасте. Дебютирует заболевание с возникновения моноцитопении либо анемии, либо лейкопении, либо тромбоцитопении. В первом огучае поводом для обращения являются общая слабость, бледность, одышка, боли в сердце. При втором варианте — упорные по течению инфекции и поражения слизистой оболочки полости рта, при третьем варианте дебюта — повышенная кровоточивость и «синяки» на коже. В течение нескольких недель, иногда месяцев и редко дольше, происходит закономерный переход в бицитопению (два ростка) и, наконец, панцитопению периферической крови. Костномозговой недостаточности у большинства больных сопутствуют множественные аномалии скелета и особенно типична аплазия одной из лучевых костей. Собственно анемия при такой панцитопении отличается явной тенденцией к увеличению размеров циркулирующих эритроцитов (макроцитарная анемия), нередко и лейкоцитов. При цитогенетическом исследовании подтверждается эффект повышенной «ломкости» хромосом в лимфоидных клетках.
Наиболее значимые врожденные заболевания, сопровождающиеся моноцитопеническим синдромом по периферической крови, представлены ниже.
Эритробластная аплазия:
- врожденная гипопластическая анемия;
- Блекфена-Дайемонда;
- транзиторная эритробластопения детского возраста;
- транзиторная аплазия при заболеваниях с хроническим гемолизом эритроцитов.
Нейтропения:
- болезнь Костманна;
- синдром Швекма’на-Дайемонда;
- циклическая нейтропения.
Тромбоцитопения:
- тромбоцитопения при аплазии лучевой кости;
- амегакариоцитарная тромбоцитопения.
Многие заболевания крови у детей, равно как и негематологические заболевания, проявляются цитопеническими синдромами вне зависимости от врожденной недостаточности костномозгового кроветворения. В этих случаях наблюдается либо преходящая приобретенная низкая продуктивность кроветворения, как это бывает, например, при недостаточности питания, либо относительная недостаточность кроветворения при большой скорости потерь клеток крови или их разрушения.
Низкая эффективность эритропоэза, имитирующая клинически гипопластическую анемию, может возникать при недостаточности естественных физиологических стимуляторов эритропоэза. К ним можно отнести гипоплазию почек или хроническую почечную недостаточность с выпадением продукции эритропоэтина.
Недостаточность щитовидной железы также нередко проявляется упорной анемией. Иногда причину ингибирования эритропоэза можно видеть в нескольких факторах патогенеза основного соматического заболевания, включающих в себя и нарушения питания, и миелодепрессивный эффект хронического воспаления, и нередкие побочные эффекты применяемых лекарственных средств.
Алиментарно-дефицитные, или «нутритивные», анемии
В странах или ре-гионах с широкой распространенностью голодания детей по типу белково-энергетической недостаточности анемизация является естественной спутницей голода и по генезу всегда полиэтиологична. Наряду с факторами пищевой недостаточности, в ее происхождении серьезную роль играют многочисленные острые и хронические инфекции, гельминтозы и паразитозы. В странах с несколько более устроенной жизнью и санитарной культурой алиментарные анемии чаще всего выявляются у детей раннего возраста, где ограниченный ассортимент продуктов питания не дает возможности сбалансированного обеспечения всем комплексом необходимых нутриентов. Особенно критической представляется обеспеченность железом детей, родившихся преждевременно или с низкой массой тела. При преждевременных родах ребенок лишается периода накопления нутриентов (депонирования), относящегося по срокам к последним неделям беременности. У них отсутствуют необходимые новорожденному депо жировых энергетических веществ и, в частности, железа, меди и витамина В12. Грудное молоко, особенно у плохо питающейся кормящей матери, не может компенсировать отсутствия депонированных компонентов питания. Дефицит железа представляет собой опасность для кислородного обеспечения как через дефицит гемоглобина крови, так и через нарушения тканевых механизмов передачи кислорода от крови к тканям. Отсюда и особая настороженность педиатров, наблюдающих детей раннего возраста, в отношении обеспеченности ребенка адекватным питанием и предупреждения его анемизации. Введение в питание ребенка цельного коровьего молока или его смесей также может отразиться на обеспечении его железом в конце 1-2-го года жизни. Здесь нередко возникают потери железа с эритроцитами, выходящими в просвет кишечника диапедезом. Наконец, в подростковом периоде, особенно у девушек, начавших менструировать, снова появляется высокая вероятность необеспеченности железом и возникновения малокровия. Педиатрическая практика пользуется несколькими лабораторными подходами к выявлению начавшегося дефицита железа, в частности через определение содержания ферритина, насыщения трансферрина железом и т. д. Однако первой линией диагностики являются, несомненно, гематологические исследования, направленные на относительно раннее выявление начальных признаков анемизации.
Перечень нутриентов, дефицит которых закономерно приводит к анемизации, а иногда и лейкопении, может быть довольно широким. Уже указывалось на сочетание дефицитов железа и меди в раннем возрасте и при расстройствах питания во всех возрастных группах. Описаны и случаи мегалобластной анемии у детей с дефицитом витамина или фолиевой кислоты, или тиамина, гипохромная анемия при дефиците витамина В6, гемолитическая анемия при недостатке витамина Е у маловесных детей.
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11], [12], [13]
Гемоглобинопатии у детей
Они довольно широко распространены у представителей этнических групп, вышедших из Африки, Азии, Среднего Востока и Средиземноморья. Заболевания этой группы обусловлены носительством и генетической наследуемостью аномальных структур глобина в составе гемоглобина. Представителями этой группы, встречающимися наиболее часто, являются серповидно-клеточная анемия и талассемии (большая и малая). Общими проявлениями гемоглобинопатий являются хроническая анемия, сплено- и гепатомегалия, гемолитические кризы, полиорганные поражения вследствие гемосидероза или гемохроматоза. Интеркуррентные инфекции провоцируют кризы основного заболевания.
Ключ к распознаванию — биохимическое исследование гемоглобина. Распознавание возможно уже в I триместре беременности по данным биопсии трофобласта.
Острые лейкозы у детей
Лейкозы являются самой частой формой злокачественных новообразований у детей. При этом подавляющее большинство острых лейкозов исходят из лимфоидной ткани (85%). Это связано, вероятно, и с исключительно бурным темпом роста лимфоидных образований у детей, превосходящим темпы роста любых других органов и тканей организма. Кроме самой мощной ростовой стимуляции через системы гормона роста и инсулина, лимфоидные образования дополнительно стимулируются и многочисленными инфекциями, иммунизациями, а также травмами. Выявлено, что «пик» частоты детских лейкозов приходится на возрастной период от 2 до 4 лет, и наивысшая частота лейкозов наблюдается у самых благополучных по семье, бытовому окружению и питанию детей. Своеобразным исключением являются дети с болезнью Дауна, также имеющие высокий риск возникновения лейкозов.
В клинической картине лейкоза сочетаются признаки вытеснения нормального гемопоэза с анемией, тромбоцитопенией и нередко геморрагическими проявлениями, гиперпластические изменения кроветворных органов — увеличение печени, селезенки, лимфатических узлов, нередко десен, яичек у мальчиков и любых внутренних органов, на которые распространяется опухолевая пролиферация. Главный путь в диагностике — констатация разрастания анаплазированных гемопоэтических клеток в миелограмме или биоптатах костей. Вот уже более 20 лет как острый лимфобластный лейкоз у детей перестал быть фатальным заболеванием. Применение современных схем полихимиотерапии, иногда в сочетании с пересадками костного мозга, гарантирует либо длительное выживание, либо практическое излечение болезни у большинства больных.
Другие морфологические формы острых лейкозов могут протекать более упорно, и отдаленные результаты их лечения пока несколько хуже.
[14], [15], [16], [17], [18], [19], [20], [21], [22], [23], [24], [25], [26], [27], [28], [29]
