Цитокины адгезии при воспалении
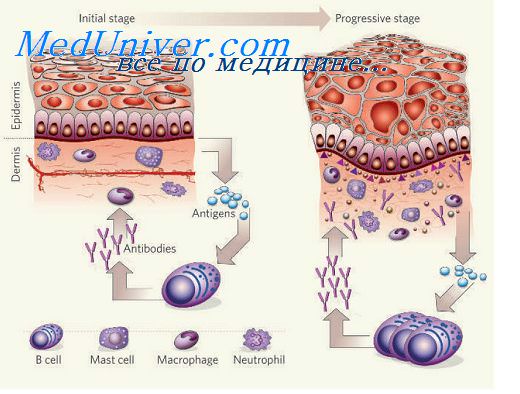
Молекулы адгезии. Роль молекул адгезии при воспалении.Движение лейкоцитов в очаг воспаления начинается с серии адгезионных событий, каждое из которых касается лейкоцитов определенного типа: нейтрофилов, моноцитов или лимфоцитов. Циркулирующие лейкоциты обычно вступают лишь в мимолетные контакты с эндотелиальными клетками посткапиллярных венул: лейкоциты как бы «скользят» по поверхности эндотелия сосудистой стенки. Эта фаза обеспечивается взаимодействием вначале Р-, а затем L- и Е-селектинов с углеводными компонентами мембран клеток. L-селектин экспрессирован на большинстве лейкоцитов. селектин эндотелиальных клеток опосредует адгезию нейтрофилов и моноцитов к эндотелию. Е-селектин экспрессируется на активированных эндотелиальных клетках и поддерживает адгезию лимфоцитов. Лигандами селектинов служат сиалил-фукозилированные олигосахариды в составе многих гликопротеинов и гликолипидов мембран клеток, например, муциноподобные молекулы. Муциноподобный домен содержит клеточная адгезионная молекула — мукозный адрессин (MAdCAM-1), которая за счет взаимодействия с L-селектином обеспечивает возврат лимфоцитов в мукозноассоциированную лимфоидную ткань. Фаза скольжения происходит без активации лейкоцитов, однако скользящие лейкоциты при контактах с поверхностью эндотелия получают сигналы активации, что ведет к их иммобилизации. Наступает вторая фаза прочной адгезии, опосредованная усилением способности лейкоцитарных интегринов связываться с лигандами из суперсемейства иммуноглобулинов на эндотелиальных клетках. В качестве сигналов активации могут служить воздействия цитокинов (хемокинов): MIP-ip, MCP-1, IL-8, MIF, PAF, С5а-фракции комплемента, которые способны связываться с глюкозамингликанами поверхности эндотелиальных клеток и действовать на «скользящие» лейкоциты.
Интегрины — это большое семейство молекул клеточной поверхности, представители которых обнаружены на большинстве типов клеток. Интегрины опосредуют взаимодействие клеток с их микроокружением, обеспечивая адгезию клетка — клетка и клетка — матрикс. Интегрины — это гетеродимеры гликопротеинов, состоящие из различных комбинаций а- и (J- цепей. Описано более 20 разных представителей интегринов. На лейкоцитах экспрессированы: LFA-1, Macl, pl50,95. Лигандами для LFA-1 являются : ICAM-1, ICAM-2, ICAM-3, для Macl -ICAM-1. Эти интегрины опосредуют адгезию к эндотелию нейтрофилов, базофилов, эозинофилов, моноцитов и лимфоцитов. В отличие от нейтрофилов остальные типы клеток могут адгезироваться к цитокин-активированным эндотелиальным клеткам через интегрины VLA-4 к лигандам VCAM-1. На поверхности эндотелиальных клеток лигандами интегринов служат молекулы, имеющие структурную гомологию с иммуноглобулинами. К ним относятся интерклеточные адгезионные молекулы: ICAM-1, ICAM-2, ICAM-3, васкулярно-клеточная адгезионная молекула — VCAM1. Последняя эксирессируется преимущественно на активированных эндотелиальных клетках. Следующая после прочной адгезии стадия трансмиграции лейкоцитов через эндотелий контролируется частично теми же интегринами, взаимодействующими с молекулами ICAM-1, расположенными и на внутренней, и на латеральной, и на базальной поверхности эндотелиальных клеток. Описаны и другие молекулы, облегчающие трансмиграцию лейкоцитов: например CD31 (РЕСАМ-1), обнаруженные и на эндотелиальных клетках, и на тромбоцитах, нейтрофилах, моноцитах, лимфоцитах. За трансмиграцию моноцитов отвечает интегрин CD18, но после активации эндотелиальных клеток под влиянием IL-1 и TNF-a трансмиграция идет при участии интегринов а, взаимодействующих с молекулой VCAM-1. Все стадии адгезии и трансмиграции зависят от активации эндотелиальных клеток, которая проявляется усилением экспрессии на них адгезионных молекул. Экспрессия Е-селектина усиливается в самые ранние стадии воспаления тромбином, гистамином или активированной системой комплемента, и не требует синтеза белка de novo. Роль стимуляторов на этой стадии могут играть различные оксиданты. — Также рекомендуем «Молекулы адгезии в подострой фазе воспаления.» Оглавление темы «Воспаление легких.»: |
Цитокины при воспалении. Миграцию ингибирующий фактор.Миграцию ингибирующий фактор (MIF) был впервые описан в 60-е годы как продукт активированных Т-лимфоцитов. Только через 25 лет удалось клонировать соответствующий ген, получить рекомбинантный белок и специфические моноклональные антитела. Биологическая активность MIF может быть охарактеризована как негативный хемотаксический эффект: торможение миграции фагоцитирующих клеток (гранулоцитов, моноцитов, макрофагов). Благодаря такому действию этот цитокин участвует в мобилизации фагоцитирующих клеток в очаг инфекции или воспаления на последнем этапе аккумуляции клеток в очаге. Кроме того, у MIF описаны и другие свойства провоспалительного цитокина. Наряду с TNF-a и IL-1 он участвует в каскаде реакций эндотоксического шока, возможно, контролируя уровень TNF-a. Этот цитокин участвует в качестве эффекторной молекулы в развитии клеточного иммунного ответа, реакций ГЗТ. Уровень продукции MIF, как правило, повышается при инфекциях и воспалительных процессах.
Изучение способности мононуклеаров крови к усиленной продукции MIF давно используется в качестве одного из тестов для оценки функциональной активности Т-лимфоцитов и специфической сенсибилизации клеток (реакция торможения миграции лейкоцитов -РТМЛ). В последние годы показано, что продуцентами MIF кроме активированных Т-лимфоцитов могут быть моноциты и макрофаги, которые отвечают продукцией и секрецией MIF, наряду с другими провоспалительными цитокинами, на индукцию ЛПС. Кроме того, пресинтезированный MIF был обнаружен в передней доле гипофиза и была показана способность клеток передней доли гипофиза отвечать продукцией MIF на индукцию ЛПС. Усиленную секрецию цитокина in vivo вызывал кортикотропин-релизинг фактор (CRF), что было расценено как компонент стрессорной реакции. В связи с. этим возникло предположение о том, что MIF может выполнять функции контр-регулятора иммунного ответа по отношению к глюкокортикоидам, которые известны как наиболее сильные ингибиторы воспаления и клеточного иммунного ответа. В физиологических концентрациях глюкокортикоиды индуцируют секрецию MIF макрофагами и Т-лимфоцитами, хотя секрецию других провоспалительных цитокинов те же глюкокортикоиды подавляют. Очевидно, MIF контролирует противовоспалительные эффекты глюкокортикоидов. Так, например, MIF блокировал протективный эффект дексаметазона на модели эндотоксического шока. Показана способность MIF противостоять ингибирующему действию глюкокортикоидов на секрецию макрофагами провоспалительных цитокинов: TNF-а, IL-1, IL-6, IL-8. Уровень MIF может повышаться как следствие глюкокортикоидной терапии. Повышенный уровень MIF контролирует иммуносупрессирующие эффекты глюкокортикоидов: эндогенных или введенных для лечения. Отсюда анти — MIF стратегия может быть полезна для повышения иммуносупрессивного и противовоспалительного действия глюкокортикоидов. — Также рекомендуем «Интерферон — гамма. Значение и функции интерферона гамма при воспалении.» Оглавление темы «Воспаление легких.»: |
Адгезия и миграция нейтрофилов при воспалении в легких.Быстрый выход неитрофилов из сосудистого русла по направлению к очагу воспаления или инфицированным тканям является ключевым этапом в системе защиты организма от внедрения микроорганизмов. В легких 2/3 неитрофилов, находящихся в сосудистом русле, прилипают к эндотелию, образуя пристеночный пул неитрофилов. В последних исследованиях охарактеризованы молекулы, участвующие в адгезии неитрофилов к эндотелиальным клеткам. Молекулы адгезии (адгезины) неитрофилов представлены р,-интегринами (LFA-1, Мас-1, р150,95) и L-селектином]. Исключительно важная роль интегринов может быть проиллюстрирована повышенной частотой развития инфекции у больных с дефицитом интегринов. У этих больных наблюдается нейтропения и нарушение адгезии и хемотаксиса неитрофилов. Будучи иммобилизованными на каких-либо клетках, нейтрофилы переходят в состояние поляризации, с чего начинается процесс трансмиграции (проникновение неитрофилов из кровотока в ткани). В индукции трансмиграции неитрофилов участие L-селектина представляется крайне важным, так как его шеддинг обязателен для начала этого процесса. Большинство медиаторов, участвующих в адгезии неитрофилов, также вовлечены в регуляцию их миграции. Однако от концентрации этих медиаторов зависит то, на какую из двух активностей неитрофилов (адгезию или миграцию) будет оказано воздействие. Так, С5а в высоких концентрациях повышает адгезию неитрофилов и снижает их миграцию, в то время как обратная закономерность наблюдается при его концентрации менее 1 пМ. Более того, миграция нейтрофилов в ответ на С5а, связанный с субстратом, реализуется благодаря механизму, получившему название haptotaxis. С его помощью нейтрофилы проникают через эндотелиальный барьер, интерстициатьную ткань и, возможно, через эпителиальный слой. Различные структуры, встречающиеся на пути нейтрофилов, могут влиять на их миграционную способность. Эффективность различных хемоаттрактантов различна в условиях in vitro, a in vivo зависит от особенностей и состояния барьеров. Так, LTB4 лучше индуцирует миграцию нейтрофилов через эндотелий, нежели FMLP, в то время как последний, наоборот, индуцирует прежде всего миграцию через эпителиальный слой. Основная роль в адгезии нейтрофилов к эпителиальным клеткам отводится экспрессированным на их мембране молекулам ICAM-1. Показано, что эта активность эпителиальных клеток повышается после их инкубации в атмосфере сигаретного дыма или после инфицирования клеток респираторными вирусами, например, вирусом парагриппа типа 2. Модуляция взаимодействия нейтрофила с эпителиальной клеткой может иметь практическое значение при респираторной инфекции, когда адгезия нейтрофилов облегчает их микробицидную активность. Наоборот, при хроническом бронхите повышенная адгезия нейтрофилов к активированным эпителиальным клеткам может индуцировать бесконтрольное развитие цитотоксичности, опосредованной нейтрофилами, и приводящей к повреждению эпителиального слоя.
Среди медиаторов воспаления следующие факторы признаны основными хемоаттрактантами для нейтрофилов, по крайней мере in vitro: С5а, NAP-l/IL-8, PAF, метаболиты арахидоновой кислоты LTB4 и 5-гидроксиэйкозатетраеновая кислота (5-НЕТЕ). TNF-a и IL-1 тоже индуцируют выход нейтрофилов из кровотока, но только in vivo. Эта активность, вероятно, связана с повышением адгезии нейтрофилов к эндотелиальным клеткам, как было обсуждено выше, и со способностью стимулировать другие воспалительные клетки к продукции хемоаттрактантов. Альвеолярные макрофаги играют центральную роль в миграции нейтрофилов в альвеолы и в дистальные отделы дыхательных путей. Так, альвеолярные макрофаги очищают нижние отделы дыхательных путей от микроорганизмов и мелких инородных частичек. Этот процесс не требует значительной активации клеток и сопровождается лишь небольшой активацией вспомогательных клеток и иммунным ответом, постоянно наблюдаемым в легких. Однако, когда альвеолярные макрофаги поглощают микроорганизмы или какие-либо частички, они могут привлекать нейтрофилы при помощи выше перечисленных факторов: С5а, NAP-l/IL-8, PAF, LTB4, 5-НЕТЕ, TNF-a и IL-1. Наряду с этими хемоаттрактантами, альвеолярные макрофаги выделяют, по крайней мере, один низкомолекулярный ингибитор миграции нейтрофилов и их респираторного взрыва. Недавно было показано, что этот фактор представлен в секретах дыхательного тракта и его содержание находится в обратной зависимости от выраженности бронхоспазма, индуцированного ингаляцией аллергена, что подтверждает потенциальную защитную роль этого фактора при гиперреактивности бронхов. Также описаны и другие ингибиторы миграции нейтрофилов: 1) факторы сыворотки крови, угнетающие С5а-индуцированный хемотаксис нейтрофилов; 2) белок изначально выделенный из супернатантов культуры лимфоцитов, названный фактором ингибиции нейтрофилов, а в настоящее время идентифицированный как GM-CSF; 3) липоксин А4 (LXA4), метаболит арахидоновой кислоты лейкотриен А4 (LTA4). Ингибитор С5а и LXA4 обнаруживаются в бронхоальвеолярной жидкости (БАЖ), a GM-CSF может продуцироваться альвеолярными макрофагами. Когда процесс трансмиграции необходимо приостановить, ингибиторы нейтрофилов должны быстро блокировать активаторы, для того чтобы предупредить дальнейшую активацию клеток. В связи с этим достаточно демонстративным является пример NAP-1/IL-8 — цитокина, действующего, прежде всего, на неитрофилы. Когда неитрофилы внутри сосудистого русла испытывают воздействие IL-8, на их поверхности происходит экспрессия L-селектина с последующим его шеддингом еще до контакта с эндотелиальной клеткой. В результате этого такие неитрофилы теряют способность начать трансмиграцию. Кроме того, было показано, что эритроциты с помощью высокоаффинных специфических рецепторов связывают большую часть биологически активного IL-8, содержащегося в крови. Наконец, последними исследованиями показано наличие в периферической крови антител к NAP-1/IL-8. Вместе все эти факты иллюстрируют сложность механизмов регуляции адгезии и миграции нейтрофилов. — Также рекомендуем «Продукты секреции нейтрофилов и их биологические функции.» Оглавление темы «Роль нейтрофилов и эозинофилов в воспалении легких.»: |
Одним из важнейших отличительных свойств клеток иммунной системы является их способность к миграции, что позволяет им осуществлять основную функцию иммунного надзора. Эта способность к миграции реализуется при помощи специальных молекул клеточной адгезии, или адгезивных молекул.
Адгезивные молекулы получили свое название в связи с тем, что они способствуют прикреплению (адгезии) одной клетки к другой при выполнении ими своих функций. Молекулы клеточной адгезии либо постоянно присутствуют на мембране клетки, либо формируются на ней в ответ на специфический стимул.
В настоящее время адгезивные молекулы делят, на три большие группы.
- Суперсемейство иммуноглобулинов
- ICAM-1 — intercellular adhesion molecule — молекула межклеточной адгезии.
- LFA-3 — limphocyte function-associated antigen — антиген, ассоциируемый с функцией лимфоцитов.
- VCAM-1 — vascular cell adhesion molecule — адгезивная молекула сосудистых клеток.
- N-CAM — neural cell adhesion molecule — адгезивная молекула нейрональных клеток.
- Интетрины
- LFA-1 — limphocyte function-associated antigen — антиген, ассоциируемый с функцией лимфоцитов.
- VLA-1 — very late activation antigen— антиген поздней стадии
активации. —
- VNR — vitronectin receptor — витронектиновый рецептор.
- МАС-1 —monocyte adhesion complex — адгезивный комплекс моноцитов.
- LECAM-1 — lectin-like cell adhesion molecule — лектинподобная клеточная адгезивная молекула.
- GMP-140 — granule membrane protein — гранулярный мембранный протеин.
- ELAM-1 — endotelial-leukocyte adhesion molecule — эндотелиально-лейкоцитарная адгезивная молекула.
- PECAM — platelet-endotelial cell adhesion molecule — тромбоци- тарно-эндотелиальная адгезивная молекула.
Адгезивные молекулы обеспечивают следующие процессы:
Для лейкоцитов:
- Прикрепление к сосудистому эндотелию;
- Трансмиграцию через эндотелий; . .
- Прикрепление к экстрацеллюлярному матриксу (фибронектин,
ламинин, коллаген). ¦
Для лимфоцитов:
- Прикрепление друг к другу;
- Реализацию хомминг-эффекта (миграцию в Т- и В-зоны в периферических лимфоидных органах);
- Прикрепление к антигенпредставляющим клеткам.
Для тромбоцитов:
- Прикрепление к лейкоцитам;
- Прикрепление к эндотелиальным клеткам.
При осуществлении своих основных функций для реализации иммунного ответа лимфоидные клетки вступают друг с другом в кооперативные взаимодействия, используя рецепторы и специфические лиганды (контрецепторы), имеющиеся на их поверхности. В табл. 4 приведены адгезивные молекулы основных лимфоидных клеток, их функциональное назначение и распределение на клетках.
Таблица 4. Молекулы кооперации основных лимфоидных клеток, их функциональное назначение и распределение на клетках
| Молекулы | Функциональное назначение | Экспрессия |
| CD2 | Рецептор к эритроцитам барана; лиганд для LFA-3 — антигена, ассоциируемого с функцией лимфоцитов | Т-клетки |
| CD3 | Сигнальный комплекс Т-клеточного антигенраспознающего рецептора | Т-клетки альфа, бета, гамма, дельта |
| TCR альфа, бета | Т-клеточный антигенраспознающий рецептор (альфа, бета) | Т-клетки (большинство) |
| TCR гамма, дельта | Т-клеточный антигенраспознающий рецептор (гамма, дельта) | Т-клетки (внутриэпителиальные) |
| Молекулы | Функциональное назначение | Экспрессия |
| CD4 | Рецептор для молекул главного комплекса гистосовместимости класса II | Т-лимфоциты (хелперы/ индукторы), моноциты |
| CD8 | Рецептор для молекул главного комплекса гистосовместимости класса I | Т-лимфоциты (киллеры/ супрессоры) |
| CD45 | Общий антиген лейкоцитов | Все лейкоциты |
| CD45 RA | Маркер Т-клеток памяти (CD45 с высокой молекулярной массой) | «Наивные» и покоящиеся Т-клетки памяти |
| CD45 RO | Маркер Т-клеток памяти (CD45 с низкой молекулярной массой) | Активированные Т-клетки памяти |
| LFA-1 (CDlla, CD 18) | Антиген, ассоциируемый с функцией лимфоцитов; лиганд для ICAM-1- молекулы межклеточной адгезии | Все лейкоциты |
| ICAM-1 (CD54) | Молекула межклеточной адгезии; эндотелиальные клетки; лиганд для LFA-1-антигена, ассоциируемого с функцией лимфоцитов | Индуцируется под влиянием активации клеток |
| LFA-3 (CD58) | Антиген, ассоциируемый с функцией лимфоцитов; лиганд для CD2-peuen- тора к эритроцитам барана | все клетки (лейкоциты, эритроциты, эндотелиальные и эпителиальные клетки, фибробласты) |
| Молекула главного комплекса гистосовместимости класса I | Антигенпредставляющая молекула для цитозольных, эндогенных пептидов, а также для вирусных пептидов | Все ядерные клетки; экспрессия усиливается под влиянием интерферона |
| Молекула главного комплекса гистосовместимости класса II | Антигенпредставляющая молекула для эндосомальных, экзогенных пептидов | Антигенпредставляющие щие клетки (макрофаги, В-лимфоциты, дендритные клетки); экспрессия усиливается под влиянием интерферона |
| CD25 | Рецептор низкой аффинности для ИЛ-2 | Активированные Т- и В-лимфоциты |
| VCAM | Адгезивная молекула сосудистых клеток; лиганд для VLA-4 — антигена поздней стадии активации | Активированные эндотелиальные клетки, макрофаги, дендритные клетки |
| CD14 | Рецептор для ЛПС | Моноциты-макрофаги |
| CD19 | Маркер В-лимфоцитов | В-лимфоциты |
| CD71 | Рецептор для трансферрина | Активированные Т-, В- лимфоциты, ЕК-клетки, моноциты, макрофаги |
| CD16 | Маркер ЕК-клеток | ЕК-клетки |
В настоящее время роль адгезивных молекул в развитии воспаления представляется следующим образом (рис. 6).

Рис. 6. Роль адгезивных молекул в миграции клеток при развитии воспаления
(объяснение в тексте).
- Этап атаки. На этом этапе под влиянием цитокинов на поверхности эндотелия и лейкоцитов появляются молекулы семейства селек- тинов. Под их влиянием лейкоцит замедляет движение, приближается к эндотелию и начинает «катиться» по его поверхности.
- Этап адгезии {прикрепления). По мере приближения под влиянием хемокинов к месту воспаления лейкоциты прилипают к эндотелию (распластываются).
- Этап трансмиграции. На этом этапе лейкоциты с помощью ин- тегринов проникают между клетками эндотелия и попадают в ткань.


