Цитокины в очаге воспаления
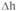
Цитокины, являясь медиаторами межклеточных взаимоотношений, играют Центральную роль в регуляции воспалительного ответа. Цитокиновая сеть представлена множеством протеинов или гликопротеинов, вырабатываемых преимущественно активированными лимфоцитами и моноцитарно-макрофа-гальной системой, а также в меньшей мере фибробластами, эндотелиальными, соматическими клетками, в том числе клетками эндометрия и трофобласта.
Первыми представителями этого класса явились ИФН, впервые описанные в 1957 г. A.Isaacs и J.Lindemann. В 1960-х годах были обнаружены новые белковые регуляторные молекулы, способные управлять процессами активации,
54Глава I
Таблица 1.10 Участие цитокинов в реакции воспаления
| Функция | Цитокин |
| Провоспалительные | ИЛ-ip, ИЛ-6, ИЛ-8, ИЛ-12, ИЛ-18, ФНО-а, ИФН-у |
| Противовоспалительные | ИЛ-4, ИЛ-10, ТФР-р |
| Регуляторные | ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИФН-у, ТФР-р |
пролиферации и дифференцировки лимфоцитов и гемопоэтических клеток. L.A.Aarden в 1979 г. предложил термин «интерлейкин», подчеркивая способность цитокинов служить коммуникационными сигналами для клеток различных популяций лейкоцитов.
Цитокины представляют собой обширное семейство биологически активных пептидов, оказывающих гормоноподобное действие и обеспечивающих взаимодействие клеток иммунной, кроветворной, нервной и эндокринной систем. Цитокины объединяют следующие общие свойства: 1) они служат медиаторами иммунной и воспалительной реакций; 2) проявляют свою активность при концентрациях порядка 10—11 моль/л; 3) действуют как факторы роста и факторы дифференцировки клеток; 4) образуют регуляторную сеть; 5) обладают плейо-тропной активностью и перекрывающимися функциями. Хотя цитокины и называют иногда гормонами иммунной системы, от гормонов их отличает способ передачи сигнала клетке. Так, если гормоны вступают во взаимодействие с цито-зольными рецепторами, которые встраиваются затем в ДНК, то цитокины специфически связываются с поверхностным рецептором, через который происходит передача сигнала внутрь клетки с помощью системы вторичных мессенджеров. Как правило, рецептор для цитокина состоит из нескольких полипептидных цепей. Последние могут отличаться по своей специфичности, аффинности и способности передавать сигнал. Существует два принципиально различных механизма торможения биологической активности цитокинов. Один — быстрый, за счет связывания цитокина растворимыми рецепторами или специфическими антагонистами. Другой механизм торможения (медленный) обеспечивается гормонами (например, глюкокортикоидами) или другими цитокинами, воздействие которых тормозит синтез цитокинов клеткой. В зависимости от выполняемой функции принято различать провоспалительные, противовоспалительные и регуляторные цитокины (табл. 1.10). С учетом такого важного свойства цитокинов, как плейо-тропность, это разделение носит в достаточной мере условный характер.
Одной из важнейших функций системы цитокинов является обеспечение согласованного действия иммунной, эндокринной и нервной систем в развитии реакции воспаления. Так, на месте внедрения инфекции обычно имеет место массивный выброс провоспалительных цитокинов (ИЛ-1в, ИЛ-6, ИЛ-12, ФНО-а). При превышении в крови пороговых концентраций эти цитокины способны преодолевать в преоптической области гематоэнцефалический барьер и стимулировать высвобождение кортикотропин-рилизинг-гормона, который, в свою очередь, стимулирует продукцию АКТГ гипофизом.
Следующим этапом является усиление синтеза кортизола надпочечниками. Одновременно происходит активация симпатической нервной системы, что сопровождается повышенным высвобождением катехоламинов (адреналина и норадреналина). Как глюкокортикоиды, так и катехоламины активно вмешиваются в течение воспалительного процесса. Основными мишенями кортизола и норадреналина являются моноциты/макрофаги и Тh1-лимфоциты. В резуль-
Генитальные инфекции и факторы противоинфекционной защиты в генезе
воспалительных заболеваний женских половых органов 55
тате происходит торможение продукции макрофагами провоспалительных цитокинов и стимулируется синтез противовоспалительного цитокина ИЛ-10. Последний вместе с кортизолом и норадреналином снижает продукцию ИЛ-2 и ИФН-у Тh1-лимфоцитами. Таким образом, активация гипоталамо-гипофи-зарно-надпочечниковой оси (ГГНО) и симпатической нервной системы снижает интенсивность воспалительного процесса, предотвращая тем самым повреждение внутренних органов медиаторами воспаления. Однако в ряде случаев, например при хронической инфекции, подавить реакцию воспаления не удается. В очаг воспаления продолжается рекрутирование лимфоцитов, и синтез цитокинов остается достаточно высоким. Это приводит к формированию порочного круга, при котором равновесие между про- и противовоспалительными цитокинами оказывается нарушенным. При этом противовоспалительные агенты (глюкокортикоиды, катехоламины), не будучи в состоянии ликвидировать очаг воспаления, существенно угнетают Тh1 -лимфоциты, практически не влияя при этом на Тh2-клетки. В результате образовавшегося сдвига в пользу Тh2 имеет место повышение продукции таких цитокинов, как ИЛ-4 и ИЛ-5, которые являются медиаторами синтеза низкоаффинных IgE-антител В-лимфоцитами (Пухальский А.Л., Шмарина Г.В., Капранов Н.И., 2004).
Воспалительный процесс может проявляться в виде как локальных, так и системных изменений, свидетелями которых могут быть различные маркеры воспаления, включая цитокины (Pukhalsky A.L., Shmarina G.V. et al., 2004). Для получения объективной картины патологического процесса при воспалительных заболеваниях женских половых органов необходимо исследовать маркеры воспаления в крови и цервикальной слизи.
Наиболее информативными маркерами воспаления при исследовании цервикальной слизи являются ФНО-а, ИЛ-4, ИФН-у, ИЛ-10 и ТФР-р. Эти показатели не только могут дать представление об интенсивности местного воспалительного процесса, но и укажут на сдвиги равновесия между Тh1- и Тh2-компо-нентами иммунного ответа, а также о преобладании про- или противовоспалительных механизмов его реализации. Однако многие цитокины (ФНО-а и ИЛ-10) могут присутствовать в биологических жидкостях не только в виде свободных биологически активных молекул, но и в связанном виде — в виде комплекса, состоящего из цитокина и его ингибитора. Исходя из этого целесообразно использовать соответствующие диагностические наборы, способные определять как свободный цитокин, так и общий (свободный + связанный). Так, например, обнаружение высокого содержания общего ФНО-а при низком или нулевом содержании свободного цитокина, с одной стороны, свидетельствует об активации клеток — продуцентов ФНО-а, что может быть связано с наличием хронического источника инфекции, а с другой стороны — указывает на активную роль противовоспалительных механизмов. Исследование соотношения между уровнем ИФН-у и ИЛ-4 позволяет судить о развитии иммунного ответа по ТЫ- или Тп2-типу.
Исследование сыворотки крови позволяет судить о наличии системных изменений у данного пациента в условиях наличия локального очага воспаления. При этом, помимо исследования содержания цитокинов, может быть использован метод оценки индивидуальной чувствительности лимфоцитов периферической крови к антипролиферативному действию глюкокортикоид-ных гормонов. Производят определение параметра Ah, который характеризует количество активированных лимфоцитов в кровотоке и может иметь как отрицательное, так и положительное значение (Pukhalsky A.L., Kapranov N.I. et al., 1999; Pukhalsky A.L., Kalashnikova E.A. et al., 1990). Если величина 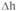 <0, это
<0, это
56 Глава I
свидетельствует о том, что большую часть лимфоцитов периферической крови составляют покоящиеся лимфоциты, чей пролиферативный ответ на стимуляцию фитогемагглютинином (ФГА) может быть заблокирован глюкокортикои-дами. Положительные значения 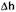 свидетельствуют о наличии в периферической крови большого количества активированных лимфоцитов, резистентных к антипролиферативному действию гормона. Такого рода резистентность связана с тем, что в активированных лимфоцитах уже произошло образование мРНК для ИЛ-2, и глюкокортикоиды не могут подавить синтез этого цитоки-на. Если средние значения величины Дп существенно превышают ноль, это можно рассматривать как свидетельство персистенции в крови большого количества клеток, активированных в очаге воспаления. В результате успешной антибактериальной терапии воспалительная реакция затухает и количество активированных лимфоцитов в крови уменьшается. Отражением этого процесса является повышение чувствительности лимфоцитов к антипролиферативному действию глюкокортикоидных гормонов. Важным элементом мониторинга реакции воспаления является определение высоты пролиферативного ответа лимфоцитов на Т-клеточные митогены (ФГА). Обычно при хронизации воспалительного процесса в результате сдвига иммунного ответа в направлении Th2 ответ лимфоцитов на ФГА оказывается сниженным. Напротив, при положительной динамике заболевания происходит переключение иммунного ответа на Thl-тип, что сопровождается существенным повышением высоты пролиферативного ответа лимфоцитов периферической крови на стимуляцию ФГА.
свидетельствуют о наличии в периферической крови большого количества активированных лимфоцитов, резистентных к антипролиферативному действию гормона. Такого рода резистентность связана с тем, что в активированных лимфоцитах уже произошло образование мРНК для ИЛ-2, и глюкокортикоиды не могут подавить синтез этого цитоки-на. Если средние значения величины Дп существенно превышают ноль, это можно рассматривать как свидетельство персистенции в крови большого количества клеток, активированных в очаге воспаления. В результате успешной антибактериальной терапии воспалительная реакция затухает и количество активированных лимфоцитов в крови уменьшается. Отражением этого процесса является повышение чувствительности лимфоцитов к антипролиферативному действию глюкокортикоидных гормонов. Важным элементом мониторинга реакции воспаления является определение высоты пролиферативного ответа лимфоцитов на Т-клеточные митогены (ФГА). Обычно при хронизации воспалительного процесса в результате сдвига иммунного ответа в направлении Th2 ответ лимфоцитов на ФГА оказывается сниженным. Напротив, при положительной динамике заболевания происходит переключение иммунного ответа на Thl-тип, что сопровождается существенным повышением высоты пролиферативного ответа лимфоцитов периферической крови на стимуляцию ФГА.
Таким образом, исследование маркеров воспаления при заболеваниях женских половых органов позволяют ответить на ряд важных вопросов, существенных для выбора тактики дальнейшей терапии. Прежде всего можно установить, в какой мере затронуты центральные механизмы иммунорегуля-ции. Существенный сдвиг иммунного ответа в сторону Th2 требует назначения адекватной иммунокорригирующей терапии. При обнаружении признаков центральной иммуносупрессии следует попытаться разорвать сложившийся порочный круг, воздействуя на различные его звенья.
Цель обзора. Рассмотреть некоторые приоритетные патогенетические механизмы формирования хронической обструктивной болезни легких.
Основные положения. Продемонстрировать приоритетное действие цитокинов в очаге воспаления и на территории реагирующих лимфоидных органов, а также связь реализации неспецифических и специфических иммунных реакций при хронической обструктивной болезни легких (ХОБЛ) с влиянием на различные гомеостатические системы организма целого ряда универсальных медиаторов, среди которых особое место занимает цитокиновая сеть, контролирующая процессы реализации иммунной и воспалительной реактивности.
Заключение. Изучение хронического альвеолярного/бронхиального воспаления является ключевым фактором в развитии теории патогенеза многих легочных патологий.
Хроническая обструктивная болезнь легких (ХОБЛ) – одна из важнейших проблем современного здравоохранения, причем это характерно практически для всех стран в связи с постоянно возрастающей распространенностью и смертностью от этого заболевания. ХОБЛ является единственной болезнью, от которой смертность продолжает увеличиваться. По данным исследования, проведенного Всемирной организацией здравоохранения и Мировым банком, к 2020 г. ХОБЛ будет занимать 5-е место по заболеваемости и 3-е место в структуре смертности среди всех болезней.
Известно, что острое или хроническое альвеолярное/бронхиальное воспаление является ключевым фактором в развитии патогенеза многих легочных патологий, таких как бронхиальная астма, ХОБЛ, респираторный дистресс-синдром взрослых, идиопатический фиброз легких. Локализация и специфические особенности воспалительного ответа могут быть различными для каждого из этих заболеваний, однако, для всех них характерно привлечение в легочную ткань и активация воспалительных клеток. Эти активированные клетки могут продуцировать цитокины, оксиданты и многие другие медиаторы, которые вовлечены в воспаление [1-4].
Основу патогенеза ХОБЛ составляет хроническое, диффузное, неаллергическое воспалительное поражение дыхательных путей, которое проходит с участием нейтрофилов, с повышенной активностью миелоперексидазы, нейтрофильной эластазы, металлопротеиназ. Воспалительная реакция связана с нейтрофильной инфильтрацией в очаге воспаления при повышенной активности интерлейкинов-6 и -8 и фактора некроза опухоли-альфа (TNF-альфа) [5-7]. Процесс воспаления имеет многофакторную природу и представляет собой сложную систему взаимодействия клеток воспаления, продуцируемых ими цитокинов и факторов роста, а также активации рецепторного ответа каждой группы клеток, вовлеченных в воспалительный процесс. Повышение симпатической активности у больных ХОБЛ способствует активации ренин-ангиотензин-альдостероновой системы (РААС) и других нейрогормонов и медиаторов (цитокинов, эндотелинов, вазопрессина и др.).
На сегодняшний день известно, что единицей воспаления при ХОБЛ являются мелкие бронхи, бронхиолы и ацинусы, где в результате воспаления слизистого и подслизистого слоев развивается утолщение стенок бронхиол, гипертрофия гладких мышц этих структур и вовлечение в процесс воспаления микроокружения бронхиол, что потенцирует развитие порочного круга воспаления, разрушение межальвеолярных мембран [8-13]. Персистированию воспаления способствует привлечение к месту первичного повреждения фагоцитарноактивных клеток – нейтрофилов, макрофагов, иммунокомпетентных клеток, являющихся основными источниками медиаторов воспаления [12]. Баланс системы провоспалительных и противовоспалительных цитокинов, факторов роста, регулирующих их выработку и взаимодействие, а также привлекающих к месту воспаления новые иммунокомпетентные клетки, определяет степень перехода обратимой обструкции дыхательных путей в необратимую и, следовательно, определяет тяжесть течения ХОБЛ [7,14].
Цитокины – это гормоноподобные белки, вырабатываемые различными клетками (лимфоцитами, моноцитами, гранулоцитами, мастоцитами, эндотелиоцитами, фибробластами, и др. клетками), обладающие широким спектром биологической активности, осуществляющие межклеточные взаимодействия при гемопоэзе, иммунном и воспалительном ответах, межсистемных взаимодействиях [15-18].
Цитокины традиционно делят на интерлейкины (Ил-1 – ИЛ-15), факторы некроза опухоли (TNF-альфа и -бетта), фактор, ингибирующий миграцию, интерфероны, хемотаксические факторы, ростовые факторы (фактор роста фибробластов, трансформирующий фактор роста – ТФР-бетта, эпителиалные и эндотелиальные факторы роста и т.д.) [7,8,19,20].
Основная часть провоспалительных цитокинов продуцируется нейтрофилами, активированными лимфоцитами, эндотелитальными и гладкомышечными клетками. В норме провоспалительные цитокины не должны находится в циркуляции, однако в ряде случаев они могут появляться, являсь проявлением вялотекущих скрытых воспалительных процессов, а также иммунопатологических состояний. ФНО-aльфа обладает широким спектром эффектов. Благодаря ФНО-опосредованной индукции генов факторов роста, цитокинов, факторов транскрипции, рецепторов, медиаторов и белков острой фазы воспаления, пирогенов, он вовлечен в индукцию кахексии. Существуют экспериментальные подтверждения того, что активация системы цитокинов, главным образом продукция ФНОальфа, связана с высокой активностью САС, РААС и состоянием хронической гипоксии [13]. Повышенная активность нейрогуморальной системы стимулирует выработку цитокинов, обладающих провоспалительным действием, что определяет развитие патологических изменений. Ведущая роль в патогенезе воспаления при ХОБЛ отведена нейтрофилам. Как показывают уже существующие данные, в регуляции апоптоза нейтрофилов крайне важно соблюдение баланса между провоспалительными и противовоспалительными цитокинами, который обеспечивает своевременное устранение “излишних” гранулоцитов после исполнения их функции в очаге воспаления. Если же происходит торможение апоптоза нейтрофилов, то появляется риск развития персистенции воспаления окружающих тканей, так как нейтрофилы крайне агрессивно вырабатывают цитокины воспаления, что наблюдается у больных с гнойно-септическими заболеваниями при исследованиях различных маркеров апоптоза в бронхо-альвеолярном лаваже, при биопсии в слизистой бронхов и в крови [5,9,15,21].
В развитии и функционировании нейтрофилов можно выделить три стадии, когда наблюдаются наиболее существенные различия по готовности клеток к реализации процесса апоптоза: 1) созревание в костном мозге; 2) пребывание в циркуляции; 3) нахождение в тканях, в том числе сюда необходимо отнести и экссудативные нейтрофилы (саливарные, перитонеальные, раневые, интраназальные, вагинальные, бронхоальвеолярные) [22,23].
Таким образом, активация системы цитокинов у больных ХОБЛ является маркером прогрессирования заболевания с вовлечением в патогенез все новых и новых составляющих, включая нейрогуморальную систему организма человека, приводящую к появлению и прогрессированию ЛГ, что требует особой фармакотерапевтической тактики в ведении этих больных [6].
При исследовании нейтрофилов у больных с тяжелыми гнойно-септическими заболеваниями обнаружен интересный факт – наличие высокого процента нейтрофилов (по сравнению со здоровыми людьми) с выраженной экспрессией CD95 (АРО-1, Fas) на мембранах клеток, что означало высокую готовность клеток к реализации апоптоза. Однако, при этом обнаружено торможение гибели нейтрофилов по времени (по сравнению с нейтрофилами, CD95-экспрессированными у здоровых людей), что означает наличие несостоятельности иммунитета у больных с тяжелыми гнойно-септическими заболеваниями в связи с дисбалансом между проапоптическими и антиапоптическими цитокинами.
Известно, что уровень некоторых циркулирующих в крови цитокинов и острофазных белков у пациентов ХОБЛ выше нормы. Пока не исследовалось, как базисная терапия ХОБЛ влияет на их динамику. Задачей исследования Malo O., Sauleda J. и др.[9,17,23] было описание изменений, происходящих в системе взаимодействия некоторых провоспалительных цитокинов, циркулирующих в крови во время обострения заболевания у больных ХОБЛ тяжелого течения и оценка потенциального эффекта проводимой кортикостероидной терапии. Исследователи определяли уровень TNF-альфа, ИЛ-6 и ИЛ-8 сыворотки крови и СРБ у 10 больных с ХОБЛ тяжелого течения в первые 24 ч. госпитализации по поводу внезапно нараставшей дыхательной недостаточности; повтороное лабораторное исследование проводили при выписке больного и спустя 2 месяца. Была набрана контрольная группа из 8 здоровых человек того же возраста [24]. По результатам исследования уровень сывороточного ИЛ-6 были значительно выше у пациентов с ХОБЛ по сравнению с группой контроля, а уровни ИЛ-8 в сыворотке крови в группе контроля и у больных ХОБЛ были похожими. Не было статистически значимого изменения исследованных показателей ни во время улучшения течения заболевания (несмотря на кортикостероидную терапию), ни спустя 2 месяца. Таким образом, полученные результаты продемонстрировали наличие системного воспаления во время обострения ХОБЛ, которое практически не изменилось даже под действием внутривенного введения кортикостероидов [23]. Определение TNF-альфа методом тест-системы ELISA является мало чувствительным, и не рекомендуется применять для подобного исследования.
Интересное исследование проведено группой испанских ученых — M.Miravitlles и соавт. [17], целью которого было определение роли повышенного уровня сывороточного ИЛ-6 или его растворимого рецептора (sRIl-6) в активации системы воспаления у больных с дефицитом альфа1-антитрипсин Обследованы 7 человек с дефицитом альфа1-антитрипсина и 23 человека с диагнозом ХОБЛ с такой же степенью обструкции по данным ФВД (ОФВ1 35.5-38.3%). Пациенты обеих групп были сопоставимы во возрасту (51-63 года). При сравнении показателей сывороточного ИЛ-6 и его растворимого рецептора в этих двух группах оказалось, что у больных с дефицитом альфа1-антитрипсина уровни ИЛ-6 сыворотки и растворимого рецептора ИЛ-6 в среднем составляли 4.7 pg/ml и 129.1 ng/ml соответственно, а у больных ХОБЛ с нормальным значением альфа-1-антитрипсина уровни ИЛ-6 и sRIl-6 — 4.1 pg/ml и sRIl-6 140.8 ng/ml соответственно. И только у одного больного с дефицитом альфа1-антитрипсина уровень ИЛ-6 был выше нормы. Таким образом, были обнаружены статистически не значимые различия значений уровня ИЛ-6 и рецептора ИЛ-6 сыворотки крови в обеих группах пациентов, что означает отсутствие разницы между этими показателями. Однако, динамическое исследование этих цитокинов на фоне терапии не проводилось [7-9,21,25].
В настоящее время альвеолярный макрофаг считается централь¬ной клеткой воспаления и регулятором сложных межклеточных взаимодействий. В результате активации альвеолярных макрофагов происходит скопление лимфоцитов, фибробластов, моноцитов, а также значи¬тельно активируются Т-лимфоциты. Активированные Т-лимфоциты выделяют интерлейкин-2, под влиянием которого Т-эффекторные лимфоциты активируются и продуцируют ряд лимфокинов. Наряду с этим Т-лимфоциты, как и альвеолярные макрофаги, вырабаты¬вают ряд веществ, стимулирующих пролиферацию фибробластов и, следовательно, развитие фиброза.
Альвеолярные макрофаги гиперпродуцируют ряд биологически активных веществ, в том числе интерлейкин-1, который стимулирует Т-лимфоциты и привлекает их в очаг воспаления, т.е. интерстициальную ткань легких и альвеолы [26].
Роль макрофагов в иммунитете исключительно важна — они обеспечивают фагоцитоз, переработку и представление антигена Т-клеткам, секретируют лизоцим, нейтральные протеазы, кислые гидролазы, аргиназу, многие компоненты комплемента, ингибиторы ферментов (антиактиватор плазминогена, альфа2-макроглобулин), транспортные белки (трансферрин, фибронектин, трансбаламин II), нуклеозиды и цитокины (ФНО альфа, ИЛ-1 ,ИЛ-8, ИЛ-12). ИЛ-1 выполняет много важных функций: воздействуя на гипоталамус, вызывает лихорадку; стимулирует выход нейтрофилов из костного мозга; активирует лимфоциты и нейтрофилы. Макрофаги являются одним из орудий врожденного иммунитета. Кроме того макрофаги, наряду с В- и Т-лимфоцитами, участвуют и в приобретенном иммунном ответе, являясь «дополнительным» типом клеток иммунного ответа: макрофаги являются фагоцитирующими клетками, чья функция – «проглатывание» иммуногенов и процессирование их для представления Т-лимфоцитами в форме, пригодной для иммунного ответа [27].
Т-лимфоциты распознают инфицированный макрофаг по экспонированию на его поверхности микробного антигена, находящегося в комплексе с гликопротеином МНС класса II, который в данном случае служит сигналом макрофага. В результате распознавания Т-клетки выделяют лимфокины, стимулирующие внутриклеточное уничтожение возбудителя макрофагом.
Таким образом, терапия, направленная на коррекцию моноцитарно-макрофагальной системы, является приоритетной у больных, имеющих воспалительную природу заболевания, на всех этапах воспалительного процесса и независимо от его локализации, как в бронхолегочной системе, так и в других.
Оценку прогрессирования хронической обструктивной болезнь легких необходимо проводить, сравнивая клинические показатели состояния пациента с показателями функции внешнего дыхания и с биомаркерами воспаления как специфическими, так и неспецифическими, так как прогрессирование заболевания у данной группы больных обусловлено особенностями процессов ремоделирования стенок бронхов [28]. Для оценки возможности влияния медикаментозной терапии на замедление прогрессирования заболевания важно изучить динамику уровня провоспалительных цитокинов [5,19].
Известно, что коварство ХОБЛ заключается в медленном, но неуклонном прогрессировании. Выраженная клиническая симптоматика появляется лишь в развернутой стадии болезни (2 стадия). На ранних стадиях ХОБЛ протекает скрыто, без постоянных клинических симптомов.
Совершенствование наших представлений о сущности заболевания – патогенеза ХОБЛ – является важнейшим инструментом, влияющим на основные подходы к классификации ХОБЛ, лечнению и профилактике заболевания.
С ХОБЛ нужно и можно бороться. Существуют лечебные мероприятия, способные уменьшить симптомы болезни, замедлить ее прогрессирование и улучшить качество жизни пациентов.
Список литературы
1. Симбирцев А.С. Цитокины – новая система регуляции защитных реакций организма. Цитокины и воспаление 2002; 1(1)9–17.
2. Kantola I, Rauhala E, Erkinjuntti M, et al. Sleep disturbances in hypertension: a double blind study between isradipine and metoprolol. J. Cardiovasc Pharmacol 1991; 18:41-5.
3. Konishi M., Maito Y., Terao A. T trend of coronary heart disease and its risk faktors based on epidemiological investigations. Jap Circulat J 1987; 51:319-24.
4. Lewczuk J., Sobkowicz-Wozniak В., Piszko P. et al. Atrial fibrillation with chronic obstructive pulmonary disease. Kardiol Pol 1993; 38(1)26-8.
5. Механизмы воспаления бронхов и легких и противовоспалительная терапия. Под ред. Г.Б. Федосеева. – СПб. — 1998. — С.512.
6. Chung K.F. Cytokines in chronic obstructive pulmonary disease. Eur Respir J 2001; 18:50S-59S
7. Steven M., Opal M.D., Vera A., De Palo M.D. Anti-Inflammatory Cytokines. CHEST 2000; 117:1162-72, 436 Varriale P., Ramaprasad S. Aminophylline induced atrial fibrillation. PACE-Pacing-Clin-Electrophysio. — 1993 Oct. — Р.1953-1955.
8. Нестерова И.В., Швыдченко И.Н. Регуляция апоптоза в системе нейтрофильных гранулоцитов. Аллергология и иммунология 2001; 2 (1):53-67.
9. Туев А.В., Мишланов В.Ю. Клиническая оценка функции лейкоцитов у больных с синдромом бронхиальной обструкции. Астма – 2001; 2 (1):128-9.
10. Фрейдлин И.С., Тотолян А.А. Иммунопатологические механизмы воспаления бронхов и легких. Механизмы воспаления бронхов и легких и противовоспалительная терапия. – СПб., 1998. – С 194–298.
11. Хаитов В.А., Гусев Е.Ю. Иммунология локального и системного воспаления Аллергология и иммунология 2001; 5: 6–7.
12. Adams D.H., Sham S.: Leukocyte-endothelial and regulation of leukocyte migration. Lancet. 1994; 343:831-6.
13. Sharar S.R., Winn R.K., Harlan J.M.. The adhesion cascade and anti-adhesion therapy: An overview. Springer Semin Immunopathol 1995; 16:359.
14. Демьянов А.В, Котов А.Ю., Симбирцев А.С. Диагностическая ценность исследования уровней цитокинов в клинической практике. Цитокины и воспаление 2003; 2 (3):20-35.
15. Долгушин И.И., Бухарин О.В. Нейтрофилы и гомеостаз. Екатеринбург. — 2001,
16. Ikeda A., Nishimura K. et al. Bronchodilating effects of combined therapy with clinicfl dosages of ipratropium bromide and salbutamol for stable COPD: comparison with ipratropium bromide alone. CHEST –1995; 107:401-40.
17. Malo O., Sauleda J., Busquets X., Miralles C., Noguera A. Systemic inflammation during exacerbations of chronic obstructive pulmonary disease. Thorax 2000; 55:114-20.
18. Mueller R., Chanez P., Campbell А.М., Heusser C. Different cytokint patterns in bronchial biopsies in asthma and chronic bronchitis. Respir Med – 1996; 90:79-85.
19. Кочеткова Е.А., Волкова М.В. Цитокиновый статус у больных хронической обструктивной болезнью легких. 13 Национальный конгресс по болезням органов дыхания 2003. — С.330.
20. Newton R. Molecular mechanisms of glucocorticoid action: what is important? Thorax – 2000; 55:603-13.
21. Ferrante A, Nandoskar M, Bates EJ et al. Tumor necrosis factor beta (lymphotoxin) inhibits locomotion and stimulates the respiratory burst and degranulation of neutrophils. Immunology 1988; 63:507-12.
22. Sharma R, Anker SD. Immune and neurohormonal pathways in chronic heart failure. Congest.Heart Fail – 2002; 8:23-8.
23. Warburton D., Schwarz M., Tefft D. et al. The molecular basis of lung morphogenesis. Mech.Dev. 2000; 92:55-81.
24. Stormer A Die Aufgaben des practishen Arztes in der Geriatrie. Schwerpuncte in der Geriatrie. – Munchen. — 1972. — S.14-24, 433 Upton A.C. Pathology — In: Handbook of the biology of aging. New York. — 1985. — Р.513-53.
25. Varriale P., Ramaprasad S. Aminophylline induced atrial fibrillation. PACE-Pacing-Clin-Electrophysio 1993 Oct; 1953-5.
26. Barczyk, A., et al.. Cytokine production by bronchoalveolar lavage T lymphocytes in chronic obstructive pulmonary disease. J Allergy Clin Immunol 2006; 117:1484-92.
27. Абидов М.Т., Караулов А.В., Беклемишев Н.Д. Бюллетень экспериментальной биологии и медицины. 2002, страницы
28. Barnes Peter J.The cytokine network in asthma and chronic obstructive pulmonary disease. J Clin Invest 2008;18(11):3546-56.
