Дегенеративные изменения уротелия на фоне хронического воспаления
Выделяют отдельную группу заболеваний мочевого пузыря, которые могут быть результатом острого или хронического воспаления. К ним относятся уротелиальная гиперплазия, реактивные и метапластические изменения уротелия. Гиперплазия уротелия и плоскоклеточная метаплазия характерны для мочепузырного треугольника. Эпителиальная гиперплазия – это доброкачественная пролиферация уротелия в ответ на воспаление или раздражение, характеризуется гистологически нормальным уротелием и увеличением числа слоев клеток уротелия. Реактивные изменения уротелия всегда связываются с острым или хроническим воспламенением в собственной пластинке слизистой и вызываются бактериями, травмой, химическими или токсическими агентами. Клетки уротелия при этом теряют полярность, их размеры и форма не меняются, испытывают недостаток в ядерном хроматине, повреждается ядерная мембрана. Пациенты с реактивными изменениями уротелия не находятся в группе риска перерождения в уротелиальную неоплазию.
Плоскоклеточная метаплазия – это доброкачественное пролиферативное и метапластическое образование, в котором нормальный уротелий замещен неороговевающим плоским эпителием. Она наиболее часто проявляется в виде белесых округлых участков в области треугольника мочевого пузыря у женщин. Является вариантом нормы. При цистоскопии участки плоскоклеточной метаплазии без ороговения выглядят как бледные серовато-белые островки с неровными контурами, чаще всего локализуются в области треугольника и иногда окружены зоной гиперемии. Другой вариант плоскоклеточной метаплазии уротелия характеризуется выраженными признаками ороговения и является лейкоплакией. Лейкоплакия мочевого пузыря обычно развивается как защитная реакция на хроническое воспаление или длительное воздействие повреждающих факторов (конкрементов, катетеров, дренажных трубок). По международной классификации лейкоплакию относят к неопухолевым изменениям эпителия. Тем не менее многие исследователи склонны считать плоскоклеточную метаплазию с ороговением «фоновым процессом для карциномы мочевого пузыря». При лейкоплакии риск развития рака возрастает при условии развития акантоза и дисплазии уротелия. Цистоскопическая картина сформировавшихся очагов лейкоплакии характеризуется наличием серовато-белых или желтого цвета бляшек, возвышающихся над уровнем слизистой оболочки. Применяемые методы оперативного лечения хронического цистита с лейкоплакией мочевого пузыря – трансуретральная резекция, электрокоагуляция, вапоризация.
Практически неотличимые от рака мочевого пузыря по цистоскопической картине изменения могут быть обусловлены так называемой нефрогенной метаплазией уротелия. Речь идет о процессе, морфологическим отражением которого является формирование в стенке мочевого пузыря очагов, напоминающих при микроскопическом исследовании дистальные извитые канальцы почки. Развитие нефрогенной метаплазии принято связывать с травмой мочевыводящих путей, хирургическими вмешательствами на органах таза, проведением внутрипузырной химиотерапии и иммунотерапии (тиофосфамид, вакцина BCG). Клинически нефрогенная метаплазия может протекать бессимптомно или проявляться гематурией и дизурией. Единственным методом исследования, позволяющим достоверно диагностировать нефрогенную метаплазию и отличить ее от опухоли, является биопсия пораженного участка стенки мочевого пузыря. При бессимптомном течении рекомендует ограничиться наблюдением с ежегодным цистоскопическим контролем и цитологическим исследованием мочи, при наличии клинических проявлений выполняют трансуретральную резекцию.
Несмотря на то, что изучению хронического цистита посвящено множество исследований, эпидемиология заболевания свидетельствует об актуальности проблемы. Существует настоятельная необходимость углубленного изучения симптомов, клинических проявлений воспалительных заболеваний мочевого пузыря для усовершенствования диагностики больных хроническим циститом. Выявление корреляции клинических и морфологических проявлений воспалительных заболеваний мочевого пузыря позволит оценить гистоморфологические изменения стенки мочевого пузыря в зависимости от вида воспалительного процесса. Необходимо определить прогностическую значимость биопсии мочевого пузыря у больных неспецифическим циститом и хронической тазовой болью. Понимание патогенеза и клинических проявлений воспалительных заболеваний мочевого пузыря невозможно без детального изучения морфологических изменений.
Перепечин Д.В., Чернышев И.В., Лощилов Ю.А., Никонова Л.М.
Введение. Уротелиальный рак, рак мочевого пузыря, лоханки и мочеточника является актуальной проблемой современной онкоурологии, что обусловлено высокой заболеваемостью, тяжестью течения, высокой степенью инвалидизации и тенденции к росту распространенности [1,2].
Эффективность лечения уротелиального рака зависит от ранней диагностики, адекватности хирургического лечения, своевременной диагностики рецидивов.
Идеальный метод лабораторной диагностики должен иметь высокую диагностическую точность, высокую воспроизводимость, прогностическую ценность, быть недорогим, простым в исполнении, подходить для раннего выявления опухоли [3,4].
Для диагностики уротелиального рака используется комплекс лабораторных исследований: исследование онкологических маркеров, цитологическое исследование мочи [5,6].
В ряде случаев у больных отмечается наличие сопутствующего хронического воспаления уротелия за счет наличия мочекаменной болезни. Для осуществления дифференциальной диагностики необходимо определить лабораторные изменения, которые могут быть характерными при наличии уротелиального рака [7,8].
Цель исследования. Определить особенности цитологического исследования мочи при коралловидном нефролитиазе.
Материалы и методы. В качестве модели хронического воспаления были взяты пациенты с мочекаменной болезнью при наличии коралловидных конкрементов (N-30). Медиана возраста составила 52 (18-65) года.
У всех пациентов были коралловидные конкременты: конкременты правой почку – у 12 больных, конкременты левой почки у 12, двухсторонний нефролитиаз был в 8 случаях. Ни у кого из пациентов не было онкологических заболеваний в анамнезе.
Всем пациентам было выполнено цитологическое исследование мочи, общий анализ мочи и посев мочи, компьютерная томография (КТ) брюшной полости с контрастированием, ультразвуковое исследование (УЗИ) брюшной полости и забрюшинного пространства перед операцией.
Всем пациентам проводилось перкутанная нефролитолапаксия, методика, которой включает цистоскопию и пиелокаликоскопию. Признаки наличия опухоли были критерием исключения.
Цитологический анализ осадка мочи проводили в препаратах, окрашенных по Романовскому-Гимзе в автоматическом режиме на аппарате эмкостейкер–авто (АФОМК8-Г-01). Затем окрашенные препараты анализировали на светооптическом микроскопе с регистрацией изображения цифровой фотокамерой Leica DFC 320, в соответствии с международными стандартами.
Посев мочи был положительный в 10 случаях; титр возбудителя варьировал 104-107. Высеянные возбудители – e.coli; e.faecium, proteus mirabilis, psevdomonas aureginosa, serratia marcescens, kl. рneumoniae.
Медиана среднего количества эритроцитов в мл мочи составляла 35 (8-3000), лейкоцитов 998,3 (12 — 17581), клеток уротелия 3 (1-30) соответственно.
Результаты и обсуждение. Анализ цитологических препаратов показал, что в осадке мочи исследуемой группы больных обращает внимание постоянное присутствие дисморфных, нередко увеличенных размеров, эритроциты.
В большинстве случаев эритроциты имеют характер так называемых «выщелоченных» клеток. Во всех препаратах присутствуют лейкоциты, с преобладанием лизированных нейтрофилов.
Значительно присутствие пикноморфных клеток, т.н. «сморщенных» нейтрофилов, которые необходимо дифференцировать от клеток лимфоидного ряда.
Переходный эпителий (уротелий) реагирует на патологические изменения в органе (нефролитиаз) дистрофическими нарушениями. Главным образом это отёк и вакуолизация цитоплазмы клеток.
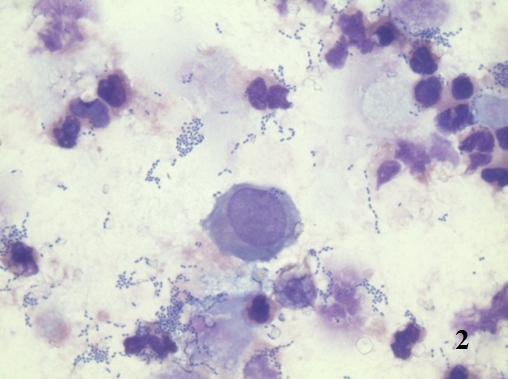
Изменяются и тинкториальные свойства эпителиоцитов. Появляется гиперхромия цитоплазмы, сочетающаяся с нарушением ядерно-цитоплазматических отношений. Происходит увеличение размеров ядер, однако кариолемма сохраняет ровные, округлые очертания. Достаточно часто встречаются 2-х и 3-х ядерные клетки, что косвенно свидетельствует о пролиферативных изменениях в уротелии (рис. 1).
Рис. 1. Цитологический препарат окрашен по Романовскому-Гимзе. Увеличение ок. 10х, об. 100х. Двухядерный эпителиоцит в осадке мочи
Проводя сопоставление результатов цитологического исследования с параллельными клинико-лабораторными методами, возникла необходимость определения присутствия в препаратах атипических эпителиоцитов с признаками дисплазии.
Морфологически процесс дисплазии аналогичен процессу гиперплазии с последующим нарушением дифференцировки и атипией клеток. Это, прежде всего, выражается в «аномальных» изменениях ядер, ядерно-цитоплазматических отношений и изменении тинкториальных свойств клеток. Всё это происходит без признаков дистрофических нарушений и воспаления.
Следует различать дисплазию, как первичную атипическую гиперплазию и дисплазию, как результат регенераторных процессов [9]. В смысле атипической первичной гиперплазии, дисплазия является «предстадией» рака. В нашем исследовании у ряда больных нефролитиазом определялись типичные признаки дисплазии (рис. 2,3).

Рис. 2. Цитологический препарат окрашен по Романовскому-Гиммзе. Увеличение ок. 10х, об. 100х. Эпителиоцит с явлениями вакуолярной дистрофии цитоплазмы и пикнозом ядра по типу апоптоза
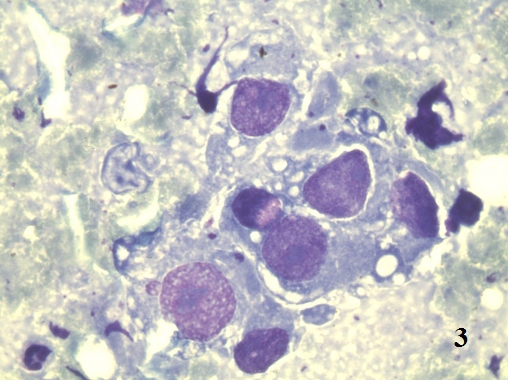
Рис. 3. Цитологический препарат окрашен по Романовскому-Гимзе. Увеличение ок. 10х, об. 100х. Изменение ядерно-цитоплазматического соотношения
В осадке мочи, исследуемой группы больных мы наблюдали небольшие комплексы из клеток переходного эпителия с признаками зрелой метаплазии. Это свидетельствует о компенсаторно-приспособительных изменениях эпителия, через так называемую гистологическую аккомодацию ткани органа.
В настоящее время большинством исследователей принято считать, что плоскоклеточная метаплазия не относится к предраковым состояниям. В цитологических препаратах мы также постоянно обнаруживали элементы солей, чаще всего оксалаты кальция.
Также постоянно и присутствие микрофлоры с преобладанием мелких, кокковых элементов. Часто обнаруживали элементы гриба. Обычно в виде псевдомицелия и бластоспор гриба рода Кандида.
Заключение. Проведённое цитологическое исследование позволяет сделать заключение, что при данном виде нефролитиаза формируется хроническое воспаление, которое сопровождается дистрофическими, десквамативными и метапластическими изменениями уротелия.
В ряде случаев формируются признаки дисплазии уротелия, которую следует рассматривать в комплексе с компенсаторно-приспособительными и воспалительными изменениями уротелия.
Урогенитальные расстройства (УГР) или урогенитальная атрофия в климактерии – комплекс вагинальных и мочевых симптомов, развитие которых является осложнением атрофических и дистрофических процессов в эстрогензависимых тканях и структурах нижней трети мочеполового тракта: влагалище, мочевом пузыре, связочном аппарате малого таза и мышцах тазового дна. Атрофические изменения в урогенитальном тракте являются таким же ярким маркером наступления климактерия, как и приливы жара.
Развитие атрофических изменений в урогенитальном тракте является фактором риска развития рецидивирующих инфекций мочевых путей, которые характеризуются «волнообразным» течением с периодами обострения, протекающими по типу острого или подострого цистита с различной периодичностью рецидивов, и периодами ремиссии, когда отсутствуют клинические, лабораторные и бактериологические данные, которые свидетельствовали бы об активном воспалительном процессе (1).
Приблизительно у 30% больных развитие рецидивирующих инфекций мочевых путей происходит на фоне симптомов гиперактивного мочевого пузыря (ГАМП). Согласно концепции восходящего инфицирования мочевого пузыря (2), резкий подъем детрузорного давления сопровождается поступлением порции мочи в уретру и ответным подъемом внутриуретрального давления (с целью удержания мочи), что сопровождается частичным забросом мочи из уретры в мочевой пузырь и попаданием в него микрофлоры дистального отдела уретры.
УГР встречаются у 30% женщин, достигших возраста 55 лет, и у 75% женщин, достигших возраста 70 лет. Около 11% женщин имеют особые симптомы, к которым относятся рецидивирующие инфекции мочевых путей (рецидивирующие циститы), не поддающиеся традиционной антибактериальной терапии.
К специфическим факторам риска развития УГР в климактерическом периоде относятся:
- дефицит эстрогенов;
- наследственная предрасположенность;
- курение.
В основе развития УГР в климактерическом периоде лежит дефицит половых гормонов, и прежде всего эстрогенов.
Уротелий, также как и вагинальный эпителий, подвергается изменениям, связанным с возрастом и эстрогенным дефицитом (3). Женская уретра является не только входными воротами для уропатогенов, но и благодаря уникальной цитологии и анатомии способна снижать их количество. Уротелий женщин, получающих заместительную гормонотерапию (ЗГТ), содержит слущивающиеся поверхностные и переходные эпителиальные клетки, вероятно, эти клетки с адгезированными на них уропатогенами выводятся в дальнейшем с мочой. У женщин, не получающих ЗГТ, в эпителии уретры преобладают имеющие широкое основание базальные и парабазальные клетки и единичные слущенные клетки. Эти клетки могут представлять резервуар для адгезированных уропатогенов. Различие в степени эксфолиации уретральных клеток с адгезированными уропатогенами объясняет большую распространенность рецидивирующих инфекций мочевых путей у женщин в постменопаузе с урогенитальной атрофией и эффективность локальных эстрогенов в снижении симптомов.
Адгезивные и бактерицидные свойства слизистой оболочки влагалища и дистальной части уретры обеспечиваются иммунологическими свойствами вагинального эпителия, низким уровнем pH, антагонистическим действием вагинальных лактобацилл и продукции ими перекиси водорода.
Одновременное развитие атрофических процессов, связанных с прогрессирующим дефицитом эстрогенов в этих тканях, обусловливает столь частое сочетание симптомов вагинальной и цистоуретральной атрофии (ВА и ЦА) у большинства пациенток.
Основными звеньями патогенеза УГР являются нарушение кровоснабжения стенки мочевого пузыря, мочеиспускательного канала и влагалища, развитие ишемии детрузора; нарушение пролиферации эпителия влагалища и мочеиспускательного канала, уменьшение синтеза гликогена, изменение характера влагалищного секрета (исчезновение Lactobacillus, повышение pH), возможное присоединение вторичной инфекции. В структурах связочного аппарата малого таза происходит нарушение синтеза и обмена коллагена с потерей их эластичности и ломкости, что приводит к опущению стенок влагалища, нарушению подвижности и положения мочеиспускательного канала, развитию стрессового недержания мочи (НМ).
В мочеиспускательном канале, шейке и дне мочевого пузыря выявляется уменьшение количества a- и b-адренорецепторов, изменение чувствительности мускариновых рецепторов к ацетилхолину.
Сочетание указанных изменений приводит к развитию симптомов ВА, ЦА и вносит свой вклад в развитие стрессового НМ и ГАМП (4).
Клинические признаки и симптомы
В клинической картине УГР в климактерическом периоде выделяют:
- симптомы, связанные с ВА (сухость, зуд, жжение во влагалище, диспареуния, контактные кровянистые выделения, опущение передней и задней стенок влагалища);
- расстройства мочеиспускания (поллакиурия, ноктурия, ургентные позывы к мочеиспусканию, ургентное НМ, стрессовое НМ, рецидивирующие инфекции мочевых путей).
В диагностике УГР, помимо характерных клинических симптомов, важное значение имеют определение рН влагалищного содержимого, кольпоцитологическое исследование, определение значения зрелости вагинального эпителия (ЗЗВЭ) (3). Интенсивность всех симптомов УГР определяется по 5-балльной шкале D. Barlow. При нарушениях мочеиспускания и симптомах ГАМП проводится комплексное уродинамическое исследование.
Лечение УГР, имеющих типичную клиническую картину, как правило, проводится локальными препаратами для ЗГТ, при развитии симптомокомплекса ГАМП – в сочетании с М-холинолитиками, поведенческой терапией.
У 8-11% женщин в поздней постменопаузе наряду с симптомами вагинальной атрофии развиваются циститы, чаще всего носящие рецидивирующий характер. Эти пациентки обычно обращаются к урологам, и терапия в большинстве случаев включает антибактериальные средства, инстилляции в мочевой пузырь различными антибактериальными препаратами, что усугубляет, как правило, клиническую картину заболевания.
Длительное существование УГР приводит к элиминации или резкому снижению титра лактобацилл (до 75,7%) (4) при отсутствии массивной колонизации влагалища условно патогенными микроорганизмами (УПМ) и воспалительной реакции в стенке влагалища (число лейкоцитов не превышает 15-20 в п/зр). По нашим данным, полученным в разные годы, частота рецидивирующих инфекций урогенитального тракта колеблется от 4,2% до 18% (4, 5, 6).
По видимому, предрасполагающим моментом к развитию рецидивирующих циститов служит именно вагинальная и цистоуретральная атрофия, следствием которой является снижение или утрата колонизационной резистентности и рост УПМ.
Материалы исследования
В отделении гинекологической эндокринологии НЦАГиП им. В.И. Кулакова проведено лечение 30 больных в возрасте 55-78 лет, находящихся в постменопаузе, с симптомами вагинальной и цистоуретральной атрофии, осложнившихся рецидивирующими циститами. Все пациентки методом случайной выборки были разделены на две группы: женщины I группы (n = 15) получали терапию препаратом Овестин, женщины II группы (n = 15) – комбинированное лечение Овестином в сочетании с Экофемином.
Овестин – вагинальные суппозитории/крем содержат эстриол, который способствует восстановлению нормального влагалищного эпителия при его атрофических изменениях в пре- и постменопаузе, способствует нормализации микрофлоры влагалища, тем самым повышая сопротивляемость эпителия влагалища к инфекционным и воспалительным процессам.
Экофемин – вагинальные капсулы содержат натуральные молочнокислые бактерии Lactobacillus acidophilus и питательную среду для бактерий – лактозу. Экофемин вагинальные капсулы представляют собой желатиновые капсулы, которые полностью растворяются, применение возможно с помощью аппликатора либо без него.
В составе препарата Экофемин:
Lactobacillus acidophilus:
- 108-109 молочнокислых бактерий Lactobacillus acidophilus;
- обладают способностью продуцировать перекись водорода;
- восстанавливают и поддерживают естественную микрофлору;
лактоза:
- среда для молочнокислых бактерий;
- не содержит консервантов и красителей.
Пациентки I группы получали локальную форму ЗГТ в виде крема Овестин, по 1 дозе ежедневно в течение 2 недель, затем по 1 дозе через день 10 недель.
Пациентки II группы получали комбинацию локальной формы ЗГТ в виде крема Овестин и вагинальных капсул Экофемин, содержащих натуральные молочнокислые бактерии Lactobacillus acidophilus с лактозой. Схема введения Овестина не отличалась от таковой у пациенток I группы, Экофемин вводился интравагинально по 1 капсуле 2 раза в день 6 дней, затем по 1 капсуле однократно через день.
Критерии исключения:
- заболевания верхних мочевых путей (мочекаменная болезнь, пиелонефрит, опухоли почек);
- наличие опухолей мочевого пузыря;
- ИППП;
- внутрипузырная обструкция, вызванная органическими причинами;
- заболевания, приводящие к нарушению иннервации мочевого пузыря (сахарный диабет, энцефалопатии различной этиологии, заболевания позвоночного столба и спинного мозга, болезнь Альцгеймера, болезнь Паркинсона, нарушения мозгового кровообращения).
Оценка методов исследования проводилась до лечения и к концу третьего месяца терапии. Нами проводился анализ результатов pH влагалищного содержимого, ЗЗВЭ, кольпоскопического исследования, клинического анализа мочи, комплексного микробиологического исследования, опроса по 5-балльной шкале D. Barlow, уродинамического исследования.
Результаты исследования
Cредний возраст пациенток составил 66,8 ± 6,7 лет, длительность постменопаузы колебалась от 4 до 30 лет (в среднем 17,03 ± 7,1 лет), длительность заболевания от 1 до 9 лет (в среднем 4,7 ± 1,8 лет). Число рецидивов циститов составило от 3 до 18 эпизодов в год (в среднем за последний год 5,3 ± 2,9 эпизодов), на момент обращения все пациентки находились в стадии ремиссии.
Курс лечения проводился 3 месяца, эффективность терапии оценивалась к концу третьего месяца ее проведения.
В анамнезе все пациентки получали лечение антибиотиками от 3 до 18 курсов в течение года, что приводило к развитию кандидозного кольпита и дисбактериоза кишечника. На момент обращения ни одна пациентка не получала гормональной терапии.
Оценка возрастного статуса показала, что среди больных с рецидивирующими циститами доминировали пациентки старшей возрастной группы (после 65 лет, n = 18). У подавляющего большинства женщин (n = 20) длительность постменопаузы составила более 15 лет. Наибольшее количество больных (n = 17) имели длительность заболевания от 3 до 6 лет.
Установлено, что число рецидивов возрастало с увеличением возраста и длительности менопаузы.
До начала терапии при осмотре на гинекологическом кресле и влагалищном исследовании у всех пациенток (n = 30) отмечались атрофические изменения малых половых губ и стенок влагалища (складчатость сглажена, слизистая бледная, истончена, местами с петехиальными кровоизлияниями). У 11 (36,7%) пациенток старше 65 лет определялся выворот слизистой уретры (эктропион), развитие которого связано с атрофией уротелия и подлежащих структур.
У всех пациенток при расширенном кольпоскопическом исследовании определялась выраженная атрофия эпителиального слоя влагалища, развитая капиллярная сеть, окраска Люголем равномерная, недостаточно интенсивная, с многочисленными участками беловато-желтого цвета и нечеткими границами. У 40% женщин (старше 65 лет) слизистая влагалища имела багрово-синюшную окраску, блестящую поверхность, незначительно окрашивалась Люголем, местами определялось скопление ороговевших клеток.
Значение рН колебалось от 5,5 до 7,0 (в среднем 6,3 ± 0,7), у пациенток старшей возрастной группы (> 65 лет) значение рН составило 6,0-7,0.
ЗЗВЭ варьировало от 30 до 50 (в среднем 34 ± 5,2), отмечалась обратная зависимость ЗЗВЭ от возраста и длительности менопаузы – у 18 женщин старше 65 лет ЗЗВЭ составило 30-35.
Оценка данных клинического анализа мочи до и после лечения показала, что во всех случаях значительных отклонений от нормальных значений не выявлено, бактериурии не отмечалось, что, вероятно, связано с тем, что все пациентки до обращения к нам получали антибактериальную терапию в различных урологических клиниках.
При оценке симптомов ВА (сухость, зуд, диспареуния) по 5-балльной шкале D. Barlow у большинства пациенток значения достигали 3-4 баллов, лишь у 6 (20%) пациенток с симптомами ГАМП и количеством рецидивов более 7 за год до 5 баллов.
Комплексное микробиологическое исследование вагинального отделяемого показало, что во всех случаях отмечалось резкое снижение (до 103 КОЕ/мл) или элиминация (в 23,3% случаев) титра лактобацилл. Выявлялось наличие УПМ у всех женщин: коагулазоотрицательного стрептококка (45,8%), энтерококка (25%), стрептококка группы В (29,2%), клебсиеллы (4,2%), кишечной палочки (33,3%), дифтероидов (45,8%). Однако степень обсемененности была низкой (103-105 КОЕ/мл).
У 9 (30%) пациенток проводилось комплексное уродинамическое исследование, согласно которому выявлялось снижение функционального и максимального объемов мочевого пузыря, колебание детрузорного давления при выполнении цистометрии наполнения.
Повторное клинико-лабораторное обследование проводилось к концу третьего месяца лечения. При влагалищном осмотре наблюдалось значительное улучшение состояния слизистой вульвы и влагалища, отмечалась их бледно-розовая окраска, появление складчатости, достаточная увлажненность.
При расширенном кольпоскопическом исследовании определялось значительное улучшение состояния вагинального эпителия, незначительное истончение слизистой влагалища, просвечивание немногочисленных капилляров в подслизистом субэпителиальном слое отмечалось в единичных случаях. При выполнении пробы Шиллера окраска слизистой оболочки влагалища раствором Люголя равномерная.
После окончания курса лечения у больных обеих групп отмечалось снижение уровня рН до 3,5-4,5 (в среднем 3,8 ± 0,3) и повышение ЗЗВЭ до 75-80 (в среднем 76 ± 2,3) (р
Оценка симптомов ВА и ЦА по 5-балльной шкале D. Barlow у пациенток I группы составила 1-2 балла, у пациенток II группы 0-1 балла.
При комплексном микробиологическом исследовании вагинального отделяемого отмечалось снижение титра (103-104 КОЕ/мл) и частоты выявления большинства условно патогенных микроорганизмов у всех женщин: коагулазоотрицательного стрептококка (72%), энтерококка (20%), стрептококка группы В (4,0%), a-гемолитического стрептококка (4,0%), кишечной палочки (36,0%), дифтероидов (44,0%).
В 100% случаях доминировали морфотипы лактобацилл, концентрация лактобактерий достигала нормативных значений (106-107 КОЕ/мл), доминировали штаммы L. аcidophilus. Видовой состав вагинальных лактобацилл после лечения практически не отличался от таковых у женщин репродуктивного возраста, что совпадает с литературными данными (6).
У 4 (13,3%) больных I группы в течение первого месяца терапии возникли рецидивы циститов, потребовавшие применение антибактериальной терапии (Монурал). У пациенток II группы за время наблюдения рецидивов не было.
Обсуждение результатов
Развитие рецидивирующих инфекций на фоне урогенитальной атрофии относят к тяжелой форме ее проявления. Необдуманное и нерациональное назначение курсов антибактериальной терапии приводит к еще большему нарушению микробиоценоза, развитию дисбиоза как во влагалище, так и в желудочно-кишечном тракте и, вероятно, могут быть одной из причин рецидивирования заболевания.
При наличии урогенитальной атрофии создаются условия для возможного инфицирования нижних мочевых путей, однако, по нашим данным, частота их не превышает 11,8%. Развитие рецидива цистита возможно только в тех случаях, когда создаются условия для восходящего инфицирования, основным из которых являются выраженные процессы атрофии, резкое снижение титра лактобацилл или их элиминация.
Традиционным лечением является использование ЗГТ (чаще локальной), однако, как показал ряд наших исследований, восстановление вагинального биотопа происходит лишь к 3-6 месяцу лечения. За этот период времени возможно возникновение еще нескольких рецидивов цистита. Особенно важным этот факт является у больных с ГАМП, так как существует дополнительный путь ретроградного инфицирования мочевого пузыря при рефлюксе мочи из уретры. В связи с этим крайний интерес представляет комбинация ЗГТ с препаратами, содержащими лактобактерии (эубиотики).
При сравнении эффективности терапии только Овестином и Овестином в сочетании с Экофемином (по разработанной нами схеме) через 3 месяца терапии мы не выявили существенной разницы в объективных показателях вагинальной микроэкологии. Однако на фоне лечения только Овестином у 4 (13,3%) больных в течение первого месяца терапии возникли рецидивы циститов. У пациенток, получавших комбинированное лечение Овестином с Экофемином, за время наблюдения рецидивов не было.
Таким образом, лечение пациенток с рецидивирующими циститами на фоне вагинальной и цистоуретральной атрофии является сложной задачей и связано с устранением атрофических изменений не только в вагинальном эпителии, но и в уротелии. По нашему мнению, комбинация Овестина с Экофемином при тяжелой форме урогенитальной атрофии с рецидивами инфекций мочевых путей является предпочтительной, так как способствует гораздо более быстрому восстановлению вагинальной микроэкологии и проявлению защитного действия лактобацилл, что, вероятно, препятствует развитию рецидивов заболевания.
Мы проанализировали результат 3 месяцев терапии, однако все пациентки лечение продолжают. Представляется важным проведение повторного клинико-лабораторного исследования через 1 год лечения с оценкой числа возможных рецидивов.
