Фактор хагемана при воспалении
Фактор Хагемана (XII фактор свертывания крови) представляет собой белок, который участвует в двух важнейших биологических процессах — гемокоагуляции и образовании кининов. Кинины можно рассматривать как относительно низкомолекулярные активные медиаторы воспаления, обладающие одновременно и другими биологическими свойствами (например, способностью вызывать бронхоспазм). Фактор Хагемана оказывается связующим звеном между процессами воспаления и свертывания крови; до его открытия связь этих процессов была гипотетической.
В крови фактор Хагемана циркулирует в неактивной форме. Он активируется при контакте с отрицательно заряженными поверхностями, к которым, в частности, относятся стекло, эластин, почечная основная мембрана и, что особенно важно для ревматологии, суставной хрящ, урат натрия, пирофосфат кальция.
Активированный фактор превращает циркулирующий в крови малоактивный прекалликреин в активный фермент калликреин, который взаимодействует с находящимися в плазме неактивными предшественниками кининов — низкомолекулярным и высокомолекулярным кининогенами. Из последних в результате такого химического взаимодействия образуются кинины, наиболее известным представителем которых является брадикинин.
Кроме того, активированный фактор Хагемана взаимодействует с добавочным количеством его неактивированных молекул, и за счет этого происходит активирование плазменного предшественника тромбопластина (ППТ), который переводит определенное количество протромбина в тромбин и в конечном итоге превращает фибриноген в фибрин, т. е. таким образом осуществляется процесс свертывания крови. Система фактора Хагемана эффективнее активирует калликреин, чем ППТ.
Существуют многообразные пути взаимодействия как между системами кининобразования и свертывания крови, так и внутри каждой из этих систем. Так, калликреин не только участвует в генерации кининов, но и способствует превращению плазминогена в протеолитический фермент плазмин (фибринолизин), расщепляющий, в частности, молекулы недавно образовавшегося фибрина. Считается, что в организме плазмин не образуется без активации фактора Хагемана.
Последний, таким образом, участвует не только в процессе свертывания крови, но и в продукции одного из активных противосвертывающих факторов. Плазмин в свою очередь способен активировать фактор Хагемана. Таким же свойством обладают калликреин (причем эта реакция ускоряется высокомолекулярным кининогеном) и комплекс прекалликреина с высокомолекулярным кининогеном. Примечательно, что активированный плазменный предшественник тромбопластина (ППТа), усиливая процессы свертывания, в то же время превращает плазминоген в плазмин, т. е. уменьшает коагуляционные свойства крови. Этим, по-видимому, объясняются большие возможности для саморегулирования процесса гемокоагуляции.
Система фактора Хагемана генерирует ряд продуктов, имеющих непосредственное отношение к развитию воспалительного процесса. Основным кинином считается брадикинин, который повышает проницаемость капилляров, расширяет артериолы, способствует освобождению гистамина из тучных клеток и повышает синтез простагландинов, рассматриваемых в настоящее время как важные медиаторы воспаления. Калликреин и фибринопептиды, возникающие в результате ферментативного расщепления фибриногена плазмином, усиливают хемотаксис лейкоцитов. Плазмин, кроме того, активирует первый компонент комплемента, расщепляет его третий компонент, превращает проколлагеназу синовиальных клеток в коллагеназу, обладающую деструктивным влиянием на ткани.
Известны физиологические антагонисты ряда биологически активных веществ, участвующих в рассматриваемой системе. Комплекс антитромбина III с гепарином угнетает фактор Хагемана и ППТа. Циркулирующий в крови a2-макроглобулин ингибирует плазмин и калликреин, а a1-антитрипсин—плазмин и ППТа. Активность брадикинина тормозится ферментом кининазой I (она угнетает также активность таких компонентов комплемента, как СЗа и С5а).
Изложенные факты демонстрируют предпосылки для возможных сочетаний воспалительного процесса с расстройствами гемокоагуляции. Последние в виде тромбирования микроциркуляторного русла часто наблюдаются в очагах воспаления. В норме деятельность систем кининообразования и гемокоагуляции протекает сбалансированно, но при качественных или даже чисто количественных изменениях их компонентов равновесие нарушается.
Опубликовал Константин Моканов
Здравствуйте! Сегодня мы поговорим о 12-ом факторе свертываемости крови, или о факторе Хагемана.
История
В 1950-е годы анализ крови перед операцией выявил удлинение внутреннего пути свертывания у железнодорожника Джона Хагемана. Знаменитый ученый Оскар Ратноф (Oscar Ratnoff) начал исследовать эту кровь и обнаружил у Хагемана дефицит неизвестного фактора свертываемости, который был назван фактором Хагемана, а потом — фактором XII.
У железнодорожника было резкое удлинение АЧТВ, и при этом не было никаких признаков кровоточивости. Интересно,что при этом умер Джон Хагеман не от кровотечения, а от тромбоза — в результате тромбоэмболии легочной артерии в молодом возрасте.
Фактор XII
Фактор XII — это профермент, синтезируемый печенью и циркулирующий в крови. Активация FXII происходит при контакте с различными поверхностями, даже со стеклом, в организме чаще с поврежденными поверхностями.

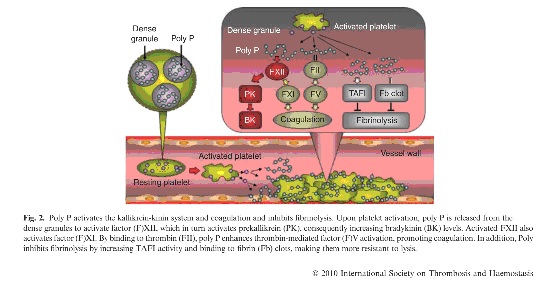
Это очень хорошая картинка, взятая из статьи, посвященной Оскару Ратнофу, обнаружившему неизвестный доселе фактор свертывания крови у сцепщика Джона Хагемана. Она иллюстрирует запуск «контактного» («внутреннего») пути.
-Активация тромбоцита приводит к выбросу из него гранул с полифосфатами.
-Полифосфаты запускают активацию фактора Хагемана на поверхности образующегося агрегата тромбоцитов, с последующим запуском всей цепочки.
-Потом полифосфаты вымываются и фактор Хагемана становится одним из основных факторов фибринолиза.
Дефицит уровня FXII
Дефицит уровня FXII — самая частая причина удлинения АЧТВ. И если причиной является такой дефицит, добавление в систему нормальной плазмы, содержащей нормальные количества фактора XII, укорачивает и приближает к норме АЧТВ.
Напомним, что в АЧТВ для активации свертывания используется «частичный тромбопластин», то есть это тромбопластин без тканевого фактора, фактически мы говорим о фосфолипидах.
Фосфолипиды в системе активации АЧТВ играют роль поверхности тромбоцитов. Если в системе есть антитела против фосфолипидов, то, соответственно, и в этом случае АЧТВ будет замедляться — это и есть то, что получило название Волчаночного Антикоагулянта (ВА).
Таким образом, ВА является второй причиной удлинения АЧТВ. В присутствии ВА АЧТВ плохо корригируется добавлением плазмы, богатой фактором XII, потому что его и так много в системе.
А если мы бездумно блокируем тромбин гепарином, то будут удлиняться показатели как внешнего, так и внутреннего пути. Поэтому на фоне активной терапии гепаринами АЧТВ тоже будет удлиняться, в данном случае, фармакологически.
Главное и ключевое то, что при дефиците FXII повышается риск не кровотечений, а тромбозов! Почему? Потому что фактор XII в гораздо большей степени активирует фибринолиз, чем тромбоз.
Один из главных рисков венозного тромбоза.- недостаточный фибринолиз. Поэтому, Джон Хаггеман умер не от кровотечения, а от тромбоза.
По своей химической структуре FXII очень похож и эволюционно связан с tPA (тканевым активатором плазминогена). При этом следует помнить, что концентрация FXII значительно превышает концентрацию tPA в крови.
Для коагуляции снижение концентрации FXII не критично, а вот для фибринолиза — может быть катастрофично.
Мы видим парадокс: удлинение АЧТВ очень часто указывает на дефицит фактора Хагемана, и в пробирке мы видим гипокоагуляцию. А в организме беременной женщины мы видим гипофибринолиз — резкое торможение фибринолиза. Фибриноид начинает накапливаться, плацента быстро стареет, тромбируются мелкие вены, резко ухудшается плацентарное кровообращение с материнской стороны, и плод страдает.
Диагностика дефицита фактора 12
Определяемый нами полиморфизм rs1801020 (C46T) ассоциирован с резким снижением продукции печенью FXII (сам фактор совершенно нормальный).
В мировой научной среде проводилось очень много исследований по поводу дефицита фактора XII на течение беременности. Немцы из Геттингентского университета установили жесткую связь между наличием этого полиморфизма у женщин с привычным невынашиванием беременности (3 остановки подряд и более). А японские коллеги из Токийского университета, выявили связь этого полиморфизма с многократными неудачными попытками ЭКО.
Сейчас абсолютно доказанными вещами является то, что дефицит фактора 12 — гипофибринолиз — связан с нарушением плацентарной функции, невынашиванием на ранних сроках, ранней преэклампсией, неоднократными неудачными попытками ЭКО
Самое резкое снижение фактора XII мы наблюдаем у гомозигот T/T. У гетерозигот (около 34 %) имеется промежуточное значение концентрации FXII.
«Хороший вариант» гомозигот встречается примерно в 60%.
Посмотрите, пожалуйста, вот очень важная схема:
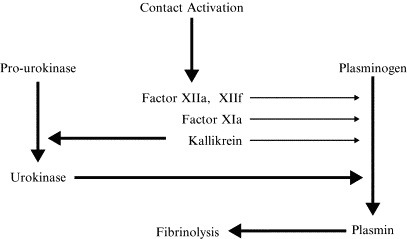
Что мы наблюдаем?
-Фактор XII активирует калликреин, который мощно активирует урокиназу.
-Урокиназа запускает образование плазмина из плазминогена. Это главный путь стимуляции фибринолиза фактором XII.
-Параллельно работают другие механизмы, не главные, но активно вносящие свой вклад в активацию плазмина.
-Сам активированный FXII катализирует переход плазминогена в плазмин.
-Активированный фактор XII активирует фактор XI (основной механизм запуска «внутреннего пути свертывания»). Но активированный таким образом FXI не только запускает генерацию тромбина, но и генерацию плазмина.
-И, наконец, активированный калликреин не только активирует урокиназу, но и сам, напрямую — плазмин.
Фактор 12 при АФС
При АФС (антифосфолипидный синдром) могут быть и АТ, направленные против FXII. Это важный анализ, но к сожалению, в нашей стране он не проводится (реактивы не серцифицированы).
При наличии антифосфолипидных АТ как правило наблюдается резкое снижение FXII , поэтому ,всегда внимательно оцениваем АЧТВ, которое часто начинает удлиняться именно при снижении концентрации FXII.
FXII может быть мишенью аутоиммунной атаки при АФС. Это частично объясняет механизм действия волчаночного антикоагулянта, удлиняющего АЧТВ.
Всё это указывает на то, что нарушение фибринолиза, одним из важных маркеров которого является снижение уровня FXII и связанное с этим удлинение АЧТВ, играет очень важную роль в нарушении плацентарной функции при АФС.
Дефицит 12 фактора у беременных
Дефицит фактора ХII может приводить к очень серьезным проблемам во время беременности, начиная от невынашиваемости на ранних сроках, и заканчивая задержкой развития плода и антенатальной гибелью.
Часто большое значение имеют не изолированные факторы, а связки полиморфизмов. В частности, при связке с таким полиморфизмом, как PAI-1, особенно если речь идет о гомозиготе 4G/4G, мы будем наблюдать достаточно серьезные проблемы с плацентацией. Потому что очистка от фибрина зоны инвазии экстравиллезного трофобласта с стенках спиральных артерий имеет очень большое значение, практически решающее для того, чтобы плацентация прошла хорошо.
Ассоциации с нарушениями фибринолиза
1) Если говорить об опасных связках, это такие полиморфизмы, как PAI-1, FXI, FXIII, FXII, PLAT и ген фибриногена. Если говорить о полиморфизмах сосудистого тонуса, это ангиотензинпревращающий фермент.
2) Группы крови (все плохие, кроме первой); Частота аллелей для европейской популяции:
3) Если говорить об антителах к фосфолипидам, то АТ против бета2GP1 и аннексина V, двух факторов, которые играют важную роль в нормальном фибринолизе.
4) Нерастворимые комплексы фибрин-мономеров (РКФМ). То есть это уже фибрин, только не успевший дальше полимеризироваться и пока еще растворимый. Этот показатель напрямую связан с активностью тромбина, и значительное повышение — плохо. Если первая цифра 4 (4,0-4,9) — нормально для беременности, они всегда более высокие с конца первых недель беременности, но если больше 5 — значит высокая активность тромбина, значит его лучше аккуратно притушить назначением гепаринов.
Для того, чтобы не пропустить серьёзные осложнения беременности, необходимо комплексное обследование комбинации гемостаза , диагностики аутоиммунных проблем иполного спектра полиморфизмов гемостаза.
В случае воспаления метаболизм тканей имеет как количественные, так и качественные особенности.
Количественные особенности обмена веществ при воспалении
Количественные особенности особенно заметны в начале воспаления – это усиление обмена веществ, которое Саде назвал «метаболическим огнем». В этот период сильно усиливаются процессы гидролиза (гликолиз, протеолиз, липолиз) и окислительные процессы (из-за артериальной гиперемии). В воспаленных тканях увеличивается утилизация кислорода.
По мере прогрессирования нарушений периферического кровообращения (венозная гиперемия, застой) интенсивность окислительных процессов снижается, и в воспалительных тканях начинают проявляться качественные изменения обмена веществ.особенности – процессы окисления не проходят полностью, не заканчиваются выделением СО2. Процессы гидролиза преобладают над процессами окисления.
Основные причины этих метаболических нарушений – повреждение митохондрий – цикл Кребса, биологическое окисление и связанные с ним нарушения окислительного фосфорилирования – и лизосомное повреждение (лизосомы выделяют около 40 гидролитических ферментов).
Схема цикла Кребса
Также вызывают метаболические нарушения остатки бактерий и ферменты. Например, многие бактерии продуцируют гиалуронидазу, которая деполимеризует гиалуроновую кислоту, разжижает соединительную ткань и увеличивает проницаемость сосудов. Коллагеназа приводит к разрушению волокон соединительной ткани. Стрептококковая дезоксирибонуклеаза и рибонуклеаза расщепляют нуклеиновые кислоты и активируют протеолитические ферменты.
Из-за венозной гиперемии, застоя и повреждения митохондрий в тканях остается мало кислорода. В отсутствие кислорода активность ферментов цикла Кребса снижается, и во время этого цикла (особенно в центре воспалительных очагов) образуется недостаточно CO2, но промежуточные продукты метаболизма (пировиноградная кислота, α-кетоглутаровая кислота, яблочная кислота, янтарная кислота) накапливаются из пировиноградной кислоты.
Если в присутствии монойодацетата ферменты гликолиза подавлены, воспаление слабое. Белковый обмен усиливают протеолитические процессы. Они активируются при повреждении лизосом и ядер нейтрофилов крови, макрофагов и воспаленных паренхиматозных клеток, а также дезоксирибонуклеазами и рибонуклеазами. Усиленный протеолиз приводит к пролиферации нуклеотидов, полипептидов и аминокислот.
В воспалительных условиях, когда в тканях не хватает кислорода, дезаминирование (нормальный путь окисления аминокислот) снижается, а декарбоксилирование усиливается. В этих условиях, а также в результате дегрануляции тучных клеток в тканях накапливается гистамин.
Для жирового обмена характерно усиление липолиза. В результате увеличивается количество жирных кислот и продуктов их переваривания. Поскольку интенсивность цикла Кребса уменьшается, молекулы ацетил-СоА начинают конденсироваться и взаимодействуют друг с другом с образованием ацетилуксусный-КоА, который, в свою очередь, дает кетон вещество уксусной кислоты (5-оксимасляной кислоты и ацетона).
Из – за высокого потребления O2 (особенно в артериальной гиперемии), но количество выделяемого СО2 намного меньше, тогда частота дыхания также уменьшается.
Описанные процессы диссимиляции (катаболизма) преобладают в остром периоде воспаления. В это время некоторые продукты патологически измененного обмена веществ (медиаторы воспаления) сами влияют на развитие процесса.
В более поздний период воспаления, когда тенденции к восстановлению тканей уже проявляются, на первый план выходят процессы синтеза, а именно анаболические – увеличивается синтез ДНК и РНК. Эти процессы особенно активны в гистиоцитах и фибробластах.
В этих клетках возрастает активность окислительно-восстановительных ферментов, активно происходит биологическое окисление и окислительное фосфорилирование. В результате увеличивается образование макроэргических соединений и обеспечивается повышенная функциональная активность гистиоцитов и фибробластов.
Биологически активные вещества
Биологически активные вещества играют очень важную роль в патогенезе воспаления, поэтому кратко опишем основные из них.
Гистамин образуется декарбоксилазой из гистидина. Много гистидина и гистамина находятся в коже, легких, симпатических нервных волокнах.
- Гистамин расщепляется метилтрансферазой. Этот фермент в изобилии присутствует в органах, на которые действует гистамин (легкие, кожа, желудочно-кишечный тракт).
- Второй путь расщепления гистамина – это окислительное дезаминирование гистамином (диаминоксидазой), которое обнаруживается в основном в кишечнике, печени и почках.
В клетках (лейкоцитах, тромбоцитах, тучных клетках и эндотелиальных клетках) гистамин присутствует в больших количествах в связанной форме. В тучных клетках всегда с гепарином.
Гистамин является биологически очень активным веществом. Понижает тонус прекапиллярных сфинктеров, расширяет сосуды в зоне микроциркуляции, сужает крупные сосуды. В то же время гистамин сокращает сократительные вещества эндотелиальных клеток и увеличивает поры между этими клетками. Таким образом, гистамин увеличивает проницаемость стенки кровеносных сосудов, и белковые жидкости могут выходить в интерстициальное пространство (IST). Больше всего увеличивается проницаемость стенки мелких вен. Гистамин также вызывает сокращение гладких мышц.
Серотонин (5-окситриптамин) образуется из триптофана специфической гидроксилазой. Серотонин расщепляется неспецифической моноаминоксидазой. Образуется индоксиуксусная кислота, которая способствует пролиферации клеток. Серотонин содержится в тучных клетках и тромбоцитах (из которых гистамин высвобождается в процессе свертывания крови).
Как и адреналин, серотонин повышает кровяное давление, но мало влияет на периферическое сопротивление. В отличие от адреналина серотонин вызывает бронхоспазм. В тканях серотонин выделяется алкалоидом резерпином. Серотонин также увеличивает проницаемость сосудов, но он делает отек в 200 раз более активным, чем гистамин.
Гранулы тучных клеток содержат гистамин, гепарин и серотонин. Гистамин и гепарин связаны с ферментом химазой. Кроме того, гепарин является ингибитором этого фермента и защищает гранулы от автолиза. Гистамин относительно слабо связан в этом комплексе и может высвобождаться так называемыми освободителями гистамина, веществами, которые более тесно связаны с гепарином, чем гистамином (натрий, кальций, водород и другие ионы). Следовательно, в условиях гипоксии и ацидоза количество гистамина увеличивается и его действие становится более выраженным.
Дегрануляция тучных клеток может быть вызвана воздействием тепла, ультрафиолетового и ионизирующего излучения, солевых растворов, кислот, катионных белков, синтетических полимеров и мономеров, поверхностно-активных веществ.
Дегрануляция тучных клеток
Дегрануляция всегда происходит за счет взаимодействия антигена и антител. Выброшенные гранулы фагоцитируются макрофагами или растворяются в межслитковой жидкости, а вазоактивные вещества переносятся лимфой или кровотоком в организм. Гистамин и серотонин расширяют кровеносные сосуды и увеличивают проницаемость их стенок, в то время как гепарин увеличивает проницаемость капилляров, препятствуя образованию фибрина.
Гипотензивные полипептиды – хинины
Хининовая система или так называемые гипотензивные полипептиды также называют местными (тканевыми) гормонами, потому что они не вырабатываются эндокринными железами и действуют в основном локально. Хинины обнаружены в крови, лимфе, моче, поджелудочной железе, слюнных железах, головном мозге, тонком кишечнике и т. д. Два хинина: калидин и брадикинин были изучены на людях.
Хинины в плазме крови и тканях образуются из неактивных α2-глобулинов (кининогенов) ферментом каликреином. Каликреины тканей (калидиногеназы) и каликреины плазмы (брадикининогеназы) происходят из прекалликреинов. Их переход в каликреины облегчается реакциями антиген-антитело, температурами выше 45 ° C, кислыми изменениями pH, лизосомальными ферментами, катепсинами, трипсином, фактором свертывания XII (фактор Хагемана), фибринолизином (плазмин).
Хининогены сначала образуют калидин. После расщепления аминопептидазы образуется брадикинин. Брадикинин – сильнейшее сосудорасширяющее средство, увеличивающее проницаемость капилляров в 10-15 раз сильнее, чем гистамин. Брадикинин стимулирует сокращение миокарда и, таким образом, увеличивает частоту сердечных сокращений, сердечный выброс и коронарное кровообращение, а также усиливает почечную клубочковую фильтрацию и выведение ионов натрия и калия.
Хинины расслабляют гладкие мышцы артериол и венозных стенок, тем самым расширяя эти кровеносные сосуды и снижая скорость их кровотока. В то же время они значительно увеличивают проницаемость стенки сосуда и способствуют эмиграции лейкоцитов из кровеносных сосудов.
Как и другие медиаторы, хинины вызывают воспаление, различные типы шока, аллергические реакции, артрит, инфаркт миокарда, инсульт, острый панкреатит и другие заболевания. Действуя на местном уровне,
Хинины вместе с системами тромбина и плазмина (фибринолизина) образуют так называемую систему факторов Хагемана, которая активируется при повреждении тканей. Свертывание крови и фибринолиз являются результатом системы факторов Хагемана.
Тромбоксан А2 и тромбоксан В2
Тромбоксан А2 и тромбоксан В2 – высоко биологически активные вещества. Тромбоксан А2 был выделен из тромбоцитов с очень короткой продолжительностью действия (период полураспада 32 с). Это вещество активно участвует в удалении медиаторов из тромбоцитов и других клеток, а также в агрегации тромбоцитов.
Система комплемента
Система комплемента состоит из 9 различных белков, обозначенных Ci, C2 и т. д. Она активируется комплексом антиген-антитело, а также эндотоксинами, и образуются продукты, которые активно участвуют в патогенезе воспаления. Наиболее активные компоненты системы комплемента – C3a (анафилатоксин I), C5a (анафилатоксин II) и C5,6, C3a – гемотаксический фактор, который увеличивает проницаемость сосудистой стенки и способствует дегрануляции тучных клеток. У Csa такое же и даже более сильное действие.
Также присутствуют в тканях ингибиторы C3a и Csa. Если дефицит этих ингибиторов передается по наследству или приобретается, активность системы комплемента может значительно возрасти, и воспалительный процесс может стать тяжелым. Было показано, что ингибиторы комплемента подавляют эмиграцию лейкоцитов.
Система комплемента также участвует в фагоцитозе и высвобождении лизосомальных ферментов и в конечном итоге вызывает иммунологический лизис клеток – смерть. Система комплемента вместе с ионами магния является частью системы пропердина, вызывающей микробный лизис в крови.
Таким образом, в случае воспаления активируются тесно связанные системы хинина, комплемента, свертывания крови, фибринолиза и другие.
Простагландины
Простагландины (PG) были обнаружены примерно в 1930 году в семенниках и сперме различных животных. Первоначально считалось, что эти биологически активные вещества происходят из простаты, поэтому их назвали простагландинами.
Теперь известно, что они являются высокоактивными фосфолипидами, образованными в клеточных мембранах из арахидоновой кислоты под действием простагландинсинтетазы. Ферменты циклооксигеназа и липоксигеназа зависят от образования PG или лейкотриенов из арахидоновой кислоты. PG присутствует во всех органах.
Простагландины
Различают несколько типов простагландинов (Ei, E2, F, I, D, A, G). У людей было обнаружено 13 простагландинов, наиболее активными из которых являются простагландины E, F и G. Действие PGE и PGF часто противоположно.
Простагландины контролируют диффузию веществ через клеточную мембрану (часть простагландина активирует аденилатциклазу и увеличивает количество цАМФ), а также регулируют активность гладких мышц и процессы секреции.
Простагландины действуют в основном локально, потому что ферментные системы мешают их общей функции. Общая эффективность наблюдается, если деградация PG ингибируется или накоплено слишком много PG. Простагландины обладают моделирующим действием – они стимулируют слабые и подавляют избыточные функции.
При воспалении особенно повышены уровни PGE2, PGE и PGI2. Эти простагландины сильно способствуют расширению сосудов, а также увеличивают проницаемость сосудистой стенки и лизосомальной мембраны, тем самым способствуя воспалению. Эти простагландины также стимулируют синтез ДНК и пролиферацию тканевых лимфоцитов. Лимфоток стимулируется в меньшей степени. С другой стороны, также наблюдалась защитная противоязвенная активность клеток простагландинов (PGE2).
Медиаторы воспаления
Помимо простагландинов, липоксигеназа арахидоновой кислоты также продуцирует лейкотриены, такие как медленно действующее вещество анафилаксии (медиатор аллергического воспаления). В случае аллергического воспаления из тканей выделяется вещество Р (проницаемость), которое увеличивает проницаемость стенки сосуда.
Медиаторы воспаления
Система адениловой кислоты содержит производные аденина (аденозин, AMF, ADF), и их количество в воспаленных тканях значительно увеличено. Эти вещества способствуют лейкоцитозу, эмиграции лейкоцитов и фагоцитозу, а также, среди прочего, увеличивают проницаемость сосудистой стенки.
Фермент клеточной мембраны аденилилциклаза катализирует переход АТФ в аденозин-3′-5 ‘- (циклический) монофосфат (цАМФ) и пирофосфат. Обычно клетки и биологические жидкости содержат очень мало cAMF. Он участвует в гуморальной регуляции – это промежуточный член между гуморальным рецептором клетки и внутриклеточными процессами.
В случае повреждения клетки увеличивается активность аденилциклазы и снижается ресинтез АТФ, поэтому количество цАМФ в поврежденной клетке увеличивается и стимулируются процессы регенерации. Печень играет ключевую роль в эвакуации и гидролизе цАМФ из плазмы крови. При заболевании печени эти функции снижены.
АМФ подавляет дегрануляцию лизосом и высвобождение лизосомальных медиаторов, тем самым подавляя дальнейшее развитие воспаления. Адреналин и норадреналин оказывают ингибирующее действие на воспаление через цАМФ.
К эндогенным медиаторам воспаления также относятся лизосомальные компоненты (катионные белки, кислотные и нейтральные протеазы) и продукты активности лимфоцитов – фактор, препятствующий миграции лейкоцитов, гемотаксический фактор, митогенный фактор и т. д. Большинство лизосомальных медиаторов высвобождаются из нейтрофилов и макрофагов.
В зависимости от места их образования, воспалительные посредники делятся на две группы:
- медиаторы, образующиеся в клетках;
- «плавающие» медиаторы, образованные в жидкостях организма, главным образом, в крови.
В первую группу входят вазоактивные амины (гистамин, серотонин), лизосомальные ферменты, катионные белки и др. Гистамин и серотонин присутствуют в клеточных гранулах, поэтому в случае повреждения клеток (тучных клеток, базофилов, тромбоцитов) они появляются первыми (в течение нескольких минут) в месте воспаления.
Однако запас вазоактивных аминов быстро истощается, поскольку эти вещества расщепляются, и вазоактивные амины исчезают из очага воспаления. Поэтому вазоактивные амины называют медиаторами короткого действия. Позже, когда активируется система калихреин-хинин, образуются калидин и брадикинин, а еще позже – простагландины. Они являются медиаторами пролонгированного действия и требуют образования ферментных систем.
Ко второй группе («плавающих») медиаторов относятся фактор Хагемана, система комплемента и тромбоксана, фибринопептиды и др.
Помимо медиаторов воспаления, вызывающих воспалительные реакции, различают и модуляторы воспаления (повреждения). Они не вызывают напрямую воспалительных реакций, но способны усиливать или уменьшать их. Такие эффекты проявляются, например, в системах простагландинов, тромбоксана и адениловой кислоты.
Продолжение статьи
- Часть 1. Этиология и патогенез воспаления. Классификация.
- Часть 2. Особенности обмена веществ при воспалении.
- Часть 3. Физико – химические изменения. Роль нервной и эндокринной систем в развитии воспаления.
- Часть 4. Изменения в периферическом кровообращении при воспалении.
- Часть 5. Экссудация. Экссудат и транссудат.
- Часть 6. Эмиграция лейкоцитов. Хемотаксис.
- Часть 7. Фагоцитоз. Асептическое и острое воспаление.
- Часть 8. Распространение. Последствия. Принципы лечения воспаления.
