Фаза воспаления по иммуноглобулину
Белки острой фазы принимают участие в воспалительных реакциях:Антитрипсин,Антихимотрипсин,
Кислый гликопротеид, a2-Макроглобулин, Гаптоглобин, Церулоплазмин,С-реактивный белок,Фибриноген
Синтезируются в разных тканях макрофагами (моноцитами), которые занимают стратегическую позицию на границе внешней и внутренней среды
При любом воспалительном процессе в организме возрастает их уровень в крови и они называются белками острой фазы (маркеры воспаления)
Биологическая роль белков острой фазы
В ответ на любое повреждение (физическая травма, ожог, хирургическая операция, инфекция и т.д.) в организме развивается комплекс физиологических реакций, направленных на локализацию очага повреждения и восстановления нарушенных функций.
Воспаление сопровождается распадом клеток, (продукты распада- АФК, лизосомальные ферменты, микробные токсины, ионы металлов) выходят в межклеточное пространство и системный кровоток и могут повредить здоровые ткани
Защиту в этом случае осуществляют некоторые представители a1-, a2-, b- глобулинов, ограничивая очаг повреждения
Клиническое значение определения белков острой фазы — диагностика и мониторинг острого воспаления.
Белками иммунной системы являются g- глобулины (иммуноглобулины — антитела)
Синтезируются В-лимфоцитами
Антитела специфически связывают антигены, что является решающим звеном в системе защиты организма от внеклеточных вирусов и бактерий
В результате такого связывания последние распознаются как патогены и уничтожаются
Понятие о гипо-, гипер-, диспротеинемии. Электрофорез белков сыворотки крови: принцип метода, электрофоретические фракции белков сыворотки, входящие в состав фракций белки. Изменения протеинограммы при остром и хроническом воспалении.
Увеличение общего содержания белков плазмы (выше 85 г/л) называют гиперпротеинемией.Возникает при потере организмом воды ( рвота, диарея, обширные ожоги) и вследствие диспротеинемии за счет резкого увеличения продукции парапротеинов — патологических белков из класса g-глобулинов.
Уменьшение содержания белков (ниже 65 г/л) — гипопротеинемией, чаще всего обусловлена уменьшением количества альбуминов. Различают наследственную (врожденную), или первичную, и приобретенные, или вторичные, гипопротеинемии. Врожденная гипопротеинемия наблюдается в основном в варианте анальбуминемии, характеризующейся резким снижением или отсутствием альбуминов в крови. Вторичные гипопротеинемии возникают вследствие повышенных потерь белка при высокой протеинурии ожогах, массивном асците; в результате дефицита белка в рационе питания (например, при алиментарной дистрофии), а также в связи с повышенным распадом белков, нарушением их синтеза или усвоения (при интоксикации, лихорадке, гепатите, циррозе печени, панкреатите, поражении желудочно-кишечного тракта с синдромом нарушенного всасывания).
Изменения альбумин-глобулинового коэффициента и соотношения между отдельными белковыми фракциями — диспротеинемией.Диспротеинемии подразделяют на наследственные и приобретенные
Электрофорез белков.Общий белок сыворотки крови состоит из смеси белков с разной структурой и функциями. Разделение на фракции основано на разной подвижности белков в разделяющей среде под действием электрического поля. При определённом значении рН и ионной силы раствора белки двигаются в электрическом поле со скоростью, пропорциональной их суммарному заряду. Белки, имеющие суммарный отрицательный заряд, двигаются к аноду (+), а положительно заряженные белки — к катоду (-). Обычно методом электрофореза выделяют 5-6 стандартных фракций: 1 — альбумины и 4-5 фракций глобулинов (альфа1-, альфа2-, бета- и гамма-глобулины, иногда отдельно выделяют фракции бета-1 и бета-2 глобулинов).
Острое воспаление — повышение содержания альфа-1 и альфа-2-глобулинов, наблюдающееся при острой пневмонии, остром бронхите, острой вирусной инфекции, остром пиелонефрите, инфаркте миокарда, травмах (включая хирургические), новообразованиях.
Хроническое воспаление — увеличение содержания гамма-глобулинов (ревматоидный артрит, хронический гепатит).
11. Небелковые органические вещества плазмы крови – метаболиты обмена белков (мочевина, креатинин), липидов (липопротеины), углеводов (глюкоза, лактат). Процессы образования, их органная локализация, пути выведения из организма (крови), возможные причины изменения концентрации в плазме крови, клинико-диагностическое значение определения концентрации.
Мочевина образование:образование карбамоилфосфата(орнитиновый цикл) идет путем конденсации NH3, CO2 и АТФ, катализируемое карбомоилфосфатсинтетазой (фермент действует в митохондриях), реакция происходит в печени и является начальной стадией синтеза мочевины — конечного продукта метаболизма азота.химическая сущность орнитинового циклазаключается в следующим: из аммиака, углекислого газа, воды и аминогруппы аспартата в несколько химических реакций на матрице орнитина строится молекула мочевины.Мочевина выводится с мочой. Повышение концентрации мочевины в крови –уремия, может быть связана: у здоровых людей с физической нагрузкой.При высокой температуре – гиперметаболический синдром.Чаще всего уремия является маркером нарушения функции почек.При недостаточной активности ферментов орнитинового цикла возникают гипераммониемии — патологические состояния сопровождающиеся повышением концентрации аммиака в крови.
Креатинин образуется из креатинфосфата — источника энергиисокращения мышц, и затем выделяется в кровь. Из организма креатинин выводится почками с мочой, поэтому креатинин (его количество в крови) — важный показатель деятельности почек. Высокий креатинин — показатель обильной мясной диеты (если повышен в крови и в моче), почечной недостаточности (если повышен только в крови). Уровень креатинина возрастает при обезвоживании организма, поражении мышц. Низкий уровень наблюдается при сниженном потреблении мяса, вегетарианской диете и голодании.
Липиды в водной среде нерастворимы, поэтому для их транспорта в организме образуются комплексы липидов с белками – липопротеины (ЛП). Различают экзо- и эндогенный транспорт липидов. К экзогенному относят транспорт липидов, поступивших с пищей, а к эндогенному – перемещение липидов, синтезированных в организме.Хиломикроны обеспечивают транспорт пищевых липидов от кишечника к тканям. Хиломикроны образуются в слизистой кишечника и транспортируются в кровь лимфатической системой. В мышцах и жировой ткани они разрушаются липазой липопротеинов, активирующейся апопротеином С-II. Под действием этого фермента хиломикроны быстро теряют бóльшую часть своих триацилглицеринов. Остатки хиломикронов утилизируются печенью.
ЛПОНП, ЛПППи ЛПНПтесно связаны между собой. Они транспортируют триацилглицерины, холестерин и фосфолипиды от печени к тканям. ЛПОНП образуются в печени и могут превращаться, как и хиломикроны, в ЛППП и ЛПНП путем отщепления жирных кислот. Образующиеся ЛПНП снабжают холестерином различные ткани организма.ЛПВП возвращают избыточный холестерин, образующийся в тканях, обратно в печень. Во время транспорта холестерин ацилируется жирными кислотами из лецитина. В этом процессе участвует лецитинхолестеринацилтрансфераза . Между ЛПВП и ЛПОНП также происходит обмен липидами и белками.
Нарушение соотношения между количеством ЛПНП, ЛПОНП и ЛПВП может вызывать задержку холестерина в тканях. Это приводит к атеросклерозуЛПНП называют атерогенными липопротеидами, а ЛПВП — антиатерогенными липопротеидами. При наследств енном дефиците ЛПВП наблюдаются ранние формы атеросклероза.
Глюкоза образуется путем глюконеогенеза — процесса образования в печени и отчасти в корковом веществе почек (около 10 %) молекулглюкозы из молекул других органических соединений — источников энергии, например свободных аминокислот, молочной кислоты, глицерина.
Несмотря на хорошую растворимость в воде, у здоровых людей глюкоза не выводится вместе с мочой, потому что при нормальной концентрации глюкозы в крови почки успевают впитывать глюкозу из мочи обратно в кровь. При увеличении уровня глюкозы в крови выше определенного значения почки теряют способность впитывать глюкозу из мочи, что приводит к появлению глюкозурии
Изменение концентрации: Повышение уровня глюкозы (гипергликемия):
Сахарный диабет I и II типа; Заболевания поджелудочной железы (острый и хронический панкреатит, панкреатит при эпидемическом паротите, муковисцидозе, опухоли поджелудочной железы); Хронические заболевания печени (цирроз печени, гемохроматоз); Физиологическая гипергликемия (умеренная физическая нагрузка, сильные эмоции, стресс, курение ).
Понижение уровня глюкозы (гипогликемия):
Заболевания поджелудочной железы (гиперплазия, аденома или карцинома бета-клеток поджелудочной железы (например, инсулинома) или недостаточность альфа-клеток островков — дефицит глюкагона); Передозировка гипогликемических препаратов и инсулина; Тяжелые болезни печени (цирроз, гепатит, карцинома, гемохроматоз); Нарушения питания (длительное голодание); Интенсивная физическая нагрузка, лихорадочные состояния.
Лактат является конечным продуктом анаэробного гликолиза. В условиях покоя основной источник лактата в плазме — эритроциты. При физической нагрузке лактат выходит из мышц, превращается в пируват в печени или метаболизируется мозговой тканью и сердцем.Повышается лактат в крови при тканевой гипоксии из-за снижения перфузии ткани или уменьшения напряжения кислорода в крови. Накопление лактата может уменьшить рН крови и снизить концентрацию бикарбоната, приводя к метаболическому ацидозу.
Оглавление темы «Селезенка. Лимфатические узлы. Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Механизмы, контролирующие иммунную систему.»: Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Ранний защитный воспалительный ответ.Ранний защитный воспалительный ответ призван препятствовать внедрению и распространению возбудителя, по возможности быстро удалять его из организма. Ранний защитный воспалительный ответ разыгрывается в течение первых 4 сут после внедрения возбудителя. Ранний защитный ответ против внедрившихся в организм патогенных микроорганизмов обеспечивается факторами врожденного иммунитета, к которым относятся фагоцитирующие клетки крови и тканей, естественные киллеры, циркулирующие в крови белковые молекулы, обладающие защитными свойствами (компоненты системы комплемента и др.), а также межклеточные медиаторы — цитокины. Ранний воспалительный ответ стимулирует последующий специфический иммунный ответ, влияет на его форму, способствуя развитию наиболее эффективного против конкретного микроорганизма специфического иммунного ответа.
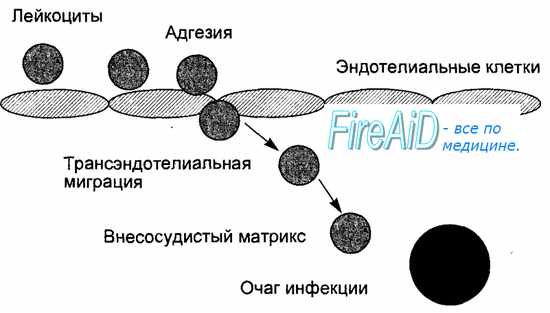
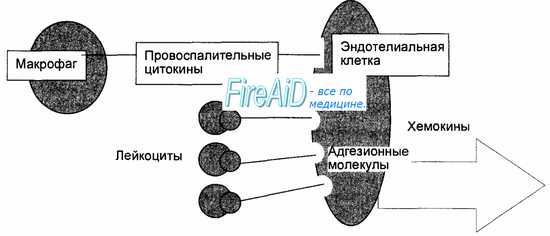
Ранний воспалительный ответ начинается с привлечения лейкоцитов из кровяного русла в очаг инфекции с последующей их активацией для удаления возбудителя (рис. 8.6). Мобилизация лейкоцитов в очаг инфекции стимулируется провоспалительными цитокинами, а опосредуется адгезионными молекулами на поверхности лейкоцитов и эндотелиальных клеток, а также молекулами хемокинов и их рецепторами. Провоспалительные цитокины (туморнекротизирующий фактор—ТНФ, интерлейкин-1 — ИЛ-1) продуцируются и секретируются макрофагами при фагоцитозе возбудителя. Под действием этих цитокинов на поверхности эндотелиальных клеток, появляются адгезионные молекулы вначале для нейтрофилов, а затем для моноцитов и лимфоцитов, ответственные за прилипание лейкоцитов к эндотелию сосудов. Кроме того, активированные цитокинами эндотелиальные клетки продуцируют хемокины, достигающие высокой концентрации на уровне очага инфекции (рис. 8.7). Этим обеспечивается прочная адгезия лейкоцитов к эндотелиальным клеткам с последующей их трансэндотелиальной миграцией и выходом в ткани в направлении очага инфекции (см. рис. 8.6). Таким образом, ранний воспалительный ответ проявляется инфильтрацией очага инфекции фагоцитирующими клетками, где эти клетки получают дополнительные сигналы активации от микробных продуктов и компонентов (липополисахарид клеточной стенки бактерий), от компонентов активированной системы комплемента и от провоспалительных цитокинов, в том числе, от гамма-интерферона, продуцируемого и секретируемого активированными естественными киллерами. Активированные фагоцитирующие клетки приобретают повышенную способность убивать захваченных микробов, что способствует удалению возбудителя. Активированные под влиянием провоспалительных цитокинов эндотелиальные клетки продуцируют молекулы вазодилататоров, под действием которых усиливается местный кровоток, повышается проницаемость сосудов для макромолекул фибриногена, который, покидая сосуды, превращается в фибрин, что способствует ограничению очага инфекции. В случае попадания в организм небольшого количества низковирулентных возбудителей ранний воспалительный ответ подавляет очаг инфекции.
Удаление из кровяного русла попавших в кровь единичных бактериальных клеток является функцией системы комплемента. Большая часть компонентов комплемента синтезируются гепатоцитами и мононуклеарными фагоцитами. Компоненты комплемента (С1, С2, СЗ, С4, С5, С6, С7, С8, С9, факторы В и D) содержатся в крови в неактивной форме. При попадании в кровяное русло бактерий на их поверхности каскад ферментативных реакций ведет к последовательной активации компонентов системы комплемента («альтернативный путь активации») с формированием мембран-атакующего комплекса (С5—С9), вызывающего лизис бактерий. В процессе активации системы комплемента накапливаются фрагменты, которые опосредуют разные биологические эффекты: привлечение лейкоцитов в очаг инфекции или воспаления (хемотаксис) — фрагмент С5а, усиление фагоцитоза (опсонизацию) — СЗb, индукцию синтеза и секреции медиаторов воспаления — С3а, С5а. (При развитии специфического иммунного ответа и появлении в кровяном русле комплексов антиген—антитело другой каскад ферментативных реакций ведет к активации системы комплемента — «классический путь активации») — Также рекомендуем «Представление антигена. Распознавание антигена. Взаимодействие Т-хелперов ( Тh1 ) с антигенпредставляющими клетками.» |
Первые данные о структуре иммуноглобулина были получены Портером в 1953 году на основании результатов обработки иммуноглобулина кролика папаином.
Иммуноглобулины могут быть мономерами, состоящими из одной субъединицы, или полимерами, включающими в свою молекулу от двух до пяти субъединиц.
Каждая субъединица, являясь структурным элементом иммуноглобулинов, представляет собой квазисимметричный димер, состоящий из двух одинаковых легких и двух одинаковых тяжелых цепей.
Цельная молекула иммуноглобулина состоит из трех фрагментов: двух Fab-фрагментов (вариабельные участки, сильно различающиеся у разных антител) и одного Fc-фрагмента, состоящего из двух константных участков тяжелых цепей (постоянный у разных антител одного класса иммуноглобулинов).
Такая структура обусловливает особенности функционирования иммуноглобулинов: активные участки Fab-фрагментов специфически связывают антигены (каждая субъединица иммуноглобулина двухвалентна, так как каждый из двух Fab-фрагментов может связывать по одному антигену), а Fc-фрагмент обеспечивает связывание иммуноглобулинов с Fc-рецепторами на поверхности клеток (в частности лейкоцитов) и с комплементом.
На основании различий в молекулярной массе, физико-химических свойств и биологической функции все иммуноглобулины разделяют на классы (изотипы) и подклассы. Исходя из особенностей структуры, выделяют 5 типов тяжелых цепей, обозначаемые буквами греческого алфавита, в соответствии с которыми все иммуноглобулины разделены на классы: IgG, IgM, IgA, IgD и IgE. Каждый из классов содержит один из двух типов легких цепей: каппа (к) или лямбда (X). Одна субъединица иммуноглобулина содержит две каппа или две лямбда цепи, но никогда не содержит по одной легкой цепи каждого типа.
Иммуноглобулины классов IgD, IgG и IgE представляют собой мономеры, состоящие из одной субъединицы. IgM сыворотки построен из пяти таких мономеров, но мембранная форма IgM состоит из одного мономера. IgA может быть мономерным, димерным или полимерным. Молекулы иммуноглобулинов с полимерной структурой содержат дополнительную полипептидную J (joining)- цепи, удерживающую мономеры вместе.
Иммуноглобулин G
Составляет около 75% всех иммуноглобулинов или 12-13% белка сыворотки крови человека. Из числа всех классов иммуноглобулинов имеет наименьшую молекулярную массу (150000 дальтон), что обеспечивает ему возможность проникновения через плаценту от матери к плоду. Молекула IgG наиболее долгоживущая из всех, период полураспада IgG в организме составляет 23 суток.
От других классов иммуноглобулинов IgG отличается незначительным содержанием углеводов (около 3%). У человека имеется 4 подкласса IgG, нумерация которых отражает их содержание в сыворотке: так, из всех подклассов IgG содержание IgG1 наибольшее, a IgG4 — наименьшее.
Иммуноглобулин М
Эволюционно самый старый класс иммуноглобулинов. Содержание его в сыворотке крови составляет 5-10% от общего количества иммуноглобулинов. В ходе иммунного ответа вначале появляются антитела класса IgM и лишь через 5 суток начинается синтез антител класса IgG. У новорожденного первые собственные антитела также относятся к этому классу иммуноглобулинов.
IgM играют важную роль в патогенезе некоторых аутоиммунных заболеваний и служат основным рецептором для антигена на поверхности зрелых В-лимфоцитов, где находятся в виде мономеров. В сыворотке молекулы IgM существуют в виде пентамеров, в результате чего молекулярная масса составляет 900000-950000 дальтон, a IgM имеет 10 потенциальных участков для связывания антигена. Период полураспада составляет 5 суток.
Иммуноглобулин A
IgA составляет лишь 10-15% всех иммуноглобулинов сыворотки. IgA не проходит через плаценту, не связывает систему комплемента, в отношении большинства микробов не проявляет опсонизирующего действия, преципитирует и агглютинирует, образует ИК (что может иметь значение в патогенезе иммунокомплексных заболеваний). Исключительно важна роль IgA в защите от вирусных инфекций благодаря способности обволакивать вирус и предотвращать его адсорбцию и проникновение в клетку-мишень.
Однако IgA преобладает в экстраваскулярных секретах, в том числе и в секретах дыхательного тракта (слизистой носа, трахеи и в бронхоальвеолярной жидкости), где он находится в виде секреторного IgA (slgA) — димера, состоящего из двух молекул IgA, соединяющей их J-цепи и гликопротеина, называемого секреторным компонентом (SC). Особый интерес представляют синтез и функция slgA. SC образуется в эпителиальных клетках и присутствует на их поверхности в качестве полииммуноглобулинового рецептора (plgR) с мол.весом 95 kDa.
IgA, выходя из кровотока и проникая через эпителиальный слой, соединяется с plgR, проникает вглубь эпителиальной клетки, где под воздействием протеолитических ферментов происходит отщепление SC от plgR. Образовавшийся slgA выталкивается на поверхность эпителиальной клетки, откуда попадает в слизь, где реализует свои эффекторные функции (рис.6.1.).

Рис. 6.1. Схема синтеза секреторного IgA
Наличие SC резко повышает резистентность slgA к протеолитическим ферментам секретов, в связи с чем он может функционировать на разнообразных слизистых поверхностях, богатых этими ферментами. В то же время в слюне и толстом кишечнике обнаружены особые протеолитические ферменты, способные активно разрушать slgA.
Прямое взаимодействие slgA с микроорганизмами приводит к агрегации микробов и сорбции этих агрегатов на поверхности эпителиальных клеток с одновременным угнетением размножения микробов. В процессе слущивания эпителия агрегаты микроорганизмов сбрасываются в просвет, откуда удаляются. Новорожденным в первые дни жизни slgA поступает с молозивом матери, защищая их бронхолегочный и желудочно-кишечный тракты до тех пор, пока не сформируются собственный механизм образования slgA и собственная микрофлора. SC активно образуется в эпителии новорожденных.
У всех здоровых людей имеются два подкласса IgA: IgA1 и IgA2. В сыворотке основным подклассом является IgA1, а в экстраваскулярных секретах IgA2 содержится в несколько большем количестве, чем IgA1.
Иммуноглобулин D
Впервые был обнаружен в виде необычного миеломного белка, а затем в небольших количествах в сыворотке здоровых людей. Длительное время его биологическая роль была неизвестна. В настоящее время установлено, что IgD экспрессируется вместе с IgM на мембране В-лимфоцитов и выполняет роль антигенсвязывающих рецепторов на первых этапах экспозиции с антигеном.
IgD часто экпрессируется на лимфоцитах при различных лимфопролиферативных и аутоиммунных заболеваниях, некоторых хронических инфекциях. Скорость его синтеза при лимфопролиферативных заболеваниях может повышаться в сотни раз.
Иммуноглобулин Е
Является минорным классом иммуноглобулинов, его содержание составляет всего около 0,2% от всех сывороточных иммуноглобулинов. IgE накапливается преимущественно в тканях слизистых оболочек и коже, где за счет Fc-рецепторов связывается с поверхностью тучных клеток, базофилов и эозинофилов. В результате присоединения специфического антигена происходит дегрануляция этих клеток и выброс биологически активных веществ.
Защитная роль IgE не вполне ясна, но установлено, что его уровень в сыворотке существенно возрастает при некоторых инфекциях, особенно при глистных инвазиях.
Основными эффекторными свойствами иммуноглобулинов являются: активация системы комплемента; опсонизирующее действие; связывание с Fc-рецепторами лимфоцитов, тучных клеток, базофилов, эозинофилов, моноцитов, макрофагов, нейтрофилов, естественных киллеров с последующей индукцией соответствующих эффекторных механизмов указанных клеток (выделение биогенных аминов, антителозависимая цитотоксичность и др.); переход через плаценту и стенки желудочно-кишечного тракта (ЖКТ); связывание со стафилококковым А протеином, стрептококковым G протеином, ревматоидным фактором и другими веществами; участие в регуляции иммунологических процессов, катаболизма иммуноглобулина и пр.
Именно различия в константной области тяжелых цепей определяют особые биологические функции каждого класса иммуноглобулинов. Так, например: IgM может активировать систему комплемента; IgA обеспечивает секреторный иммунитет; IgE, прикрепляясь к специфическим рецепторам на тучных клетках и базофилах, определяет развитие аллергических реакций; IgD функционирует почти исключительно в качестве мембранных рецепторов для антигена; IgG проявляет разнообразные виды активности, в том числе способность проникать через плацентарный барьер.
Продукция иммуноглобулинов является одной из наиболее важных функций В-лимфоцитов (рис.6.2). Уже на уровне пре-В-лимфоцита происходит синтез легких цепей (к и X) и тяжелой цепи ц-типа. Легкая и тяжелая цепи вместе формируют мембранно-связанный IgM, наличие которого характеризует незрелый В-лимфоцит. В процессе созревания на мембране В-лимфоцита появляется также IgD.

Рис. 6.2. Регуляция синтеза антител
Начальной фазой антигениндуцированного этапа является активация В-лимфоцитов, которая требует двух сигналов активации:
1. От непосредственного распознавания антиген Ig-рецептором В-лимфоцитов;
2. От Т-хелперов:
• непосредственно;
• через действие цитокинов, продуцируемых активированными Т-хелперами.
Наиболее важным звеном в регуляции синтеза иммуноглобулинов являются цитокины, запускающие также этапы пролиферации и дифференцировки активированных В-лимфоцитов в плазматические (антителопродуцирующие) клетки. Некоторые из перечисленных цитокинов способны избирательно регулировать продукцию отдельных классов иммуноглобулинов (табл.6.27.).
Таблица 6.27. Цитокины, регулирующие синтез иммуноглобулинов

На ранней стадии гуморального ответа уже активированные В-лимфоциты обладают способностью к секреции иммуноглобулинов, однако основным продуцентом антител являются плазматические клетки, в которые дифференцируются В-лимфоциты в периферических органах иммунной системы и лимфоидной ткани. Плазматические клетки не несут на своей поверхности мембранной формы иммуноглобулинов, являются короткоживущими клетками, в кровоток попадают только при гиперпродукции.
В секрете, полученном из трахеи, отношение концентрации IgA к концентрации альбумина в 9 раз выше, чем в сыворотке крови, а отношение концентрации IgG и альбумина такое же, как в сыворотке. В секрете дистального отдела дыхательной системы количество IgG несколько возрастает. Это обстоятельство может быть объяснено более высокой проницаемостью стенок альвеол и концевых бронхиол для сывороточных белков.
При исследовании секретов, полученных из трахеи и бронхов через трубку для интратрахеального наркоза, выявлена корреляция между уровнем IgA и IgG в верхних и средних отделах дыхательной системы, что указывает на сопряженность синтеза секреторных белков в этих отделах респираторного тракта. Не обнаружено различий и в соотношении уровней IgA и альбумина в секретах полости носа и трахеи.
В верхних дыхательных путях, в собственной ткани слизистой оболочки и вдоль протоков желез, увлажняющих эту слизистую, сосредоточены преимущественно клетки, содержащие в своей цитоплазме IgA. Вблизи слизистых желез и вдоль их протоков количество таких клеток, содержащих этот белок, относилось к числу клеток, содержащих IgG, как 3:1-8:1. Вблизи поверхности слизистой оболочки и в пространстве между железами это отношение снижалось до 1:1. В этих же участках удалось выявить и плазмоциты, синтезирующие IgM.
У лиц, страдающих агаммаглобулинемией, была нарушена и выработка иммуноглобулинов в стенках дыхательной системы. Установлено, что наличие большого количества клеток, содержащих IgA, обусловлено локальной продукцией этого белка, а не сорбцией его из сыворотки крови. Относительная концентрация IgA в секретах верхних дыхательных путей составляет 10-70% от общего белка. Иммуноглобулин М в секрете полости носа отсутствует или встречается в следовых количествах. Помимо slgA, в верхних дыхательных путях содержится небольшое количество сывороточного белка, имеющего ту же а-цепь, а также IgG и IgE.
Наиболее изученным материалом для иммунологического обследования больных с патологией бронхов и легких является бронхоальвеолярная жидкость (БАЖ). Изменения значений иммунологических показателей БАЖ изучены при различных патологических состояниях: ринитах, хроническом бронхите, бронхиальной астме, саркоидозе, туберкулезе, раке легкого, бронхоэктатической болезни и т.д. В то же время получение БАЖ технически не всегда представляется возможным и небезразлично для самого больного.
С другой стороны, слизистые оболочки носа (за исключением обонятельной области), носовой части глотки, гортани (кроме голосовых складок), трахеи и бронхов построены по одному и тому же плану. В связи с большей доступностью материала из носа (слизь или смыв) представляется крайне важной возможность его использования в качестве биологического материала для иммунологического обследования больных с патологией органов дыхания.
В экстраваскулярных секретах иммуноглобулины могут иметь двоякое происхождение:
1. Проникновение иммуноглобулинов из кровотока в результате активного или пассивного их переноса через барьеры слизистых, тканей и органов:
• в результате повышенного содержания иммуноглобулинов в кровотоке;
• в результате нарушения проницаемости барьера.
2. Локальный синтез и продукция иммуноглобулинов клетками иммунной системы, находящимися местно в слизистых, тканях и органах.
Классической моделью барьера, представленного на слизистых и в некоторых органах (например в бронхах и легких), является трехслойная система, состоящая из эпителиальной мембраны, базальной мембраны и эндотелиальной мембраны сосуда.
Существуют три механизма проникновения белков через эпителиальную мембрану:
1. Через межклеточные пространства (для белков с молекулярным весом до 50 kD).
2. Через пиноцитоз — процесс, при котором белки проникают через клетку, где они попадают в эндоплазматические везикулы.
3. Активный перенос белков, реализованный через рецепторное взаимодействие.
При воспалительном процессе эпителиальный барьер повреждается изолированно или в сочетании с повреждением базальной мембраны и эндотелиальной мембраны сосудов, что приводит к дополнительному повышению проницаемости барьера. При патологии часто страдают оба механизма: как избирательная проницаемость барьеров, так и уровень местной продукции иммуноглобулинов.
Федосеев Г.Б.
Опубликовал Константин Моканов