Фазы воспаления в коже
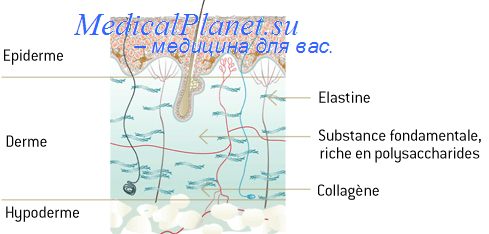
Воспалительный процесс характеризуется отчетливо выраженной фазностью. А. И. Струков (1990) выделяет следующие фазы воспаления:
1. фаза повреждения или альтерации;
2. фаза экссудации или реакции микроциркуляторного русла с выходом из крови и лимфы в ткани жидкости;
3. фаза восстановления или пролиферации.
Фаза альтерации характеризуется нарушением нормального строения клеток и межклеточного вещества, ведущим к их гибели. При этом освобождается огромное количество медиаторов воспаления. Это клеточные медиаторы. Кроме того, большое количество биологически активных веществ устремляется к месту повреждения из плазмы крови (плазменные медиаторы воспаления).
Медиаторы воспаления выполняют целый ряд функций:
• изменение (повышение) проницаемости сосудистой стенки;
• обеспечение межклеточных взаимодействий воспалительной реакции; роль хемотоксических факторов;
• деление и дифференцировка из стволовых клеток тех клеточных форм, которые играют основную роль на каждом этапе воспалительного процесса;
• активация фагоцитоза и иммунных реакций. К медиаторам воспаления относятся биологически активные вещества, выделяемые гранулоцитами, тканевыми базофилами (дегрануля-ция), эндотелиоцитами, тромбоцитами и другими клетками. Сюда относятся гистамин, серотонин, интерлейкины, лизосомальные гидролазы, простагландины, лейкотриены, система кининов плазмы, фактор Хагемана, медленно реагирующие субстанции и целый ряд других, в том числе и неизученных факторов.
В результате действия этих веществ на сосудистую стенку и основное вещество соединительной ткани проницаемость микрососудов резко увеличивается с одновременным резким расширением их просвета. Сосудистая стенка подготавливается к следующей фазе воспаления — экссудации.

Экссудация на коже
Экссудация включает в себя такие процессы, как выход из крови в основное вещество окружающей соединительной ткани жидкой части плазмы, а также миграцию через сосудистую стенку в ткани клеток крови, принимающих участие в воспалении. В результате паретического расширения сосудов и выхода плазмы крови возникает отек тканей.
Отек играет важную роль в системе защитных сил организма по двум причинам. Во-первых, отечная жидкость сдавливает кровеносные и лимфатические сосуды и локализует флогогенный фактор, препятствует его широкому распространению в организме. Во-вторых, отечная жидкость уменьшает концентрацию флогогенного фактора и, следовательно, его патогенное действие.
Кроме того, уменьшая плотность межклеточного вещества, она способствует миграции клеток к очагу воспаления.
Под действием хемотоксических веществ (медиаторов воспаления) лейкоциты крови, в первую очередь нейтрофильные лейкоциты, начинают диапедез через сосудистую стенку. Диапедезу предшествует краевое стояние лейкоцитов, когда они отделяются от общего потока клеток в сосуде и тяготеют к эндотелиоцитам, в последующем приклеиваясь к ним. Диапедез нейтро-фильных лейкоцитов осуществляется интерэндотелиоцитарно, т. е. в местах стыка двух эндотелиоцитов.
Этому способствует образование так называемых «гистаминовых люков» — расширенных промежутков между эндотелиоцитами из-за сокращения их под действием гистамина, а также деполяризация базальной мембраны под влиянием гиалуронидазы и других веществ.
Роль нейтрофильных лейкоцитов в воспалении огромна. Под влиянием флогогенных факторов и медиаторов воспаления в них происходит так называемый респираторный взрыв: в клетках вырабатывается большое количество активных форм кислорода (синглетный кислород, супероксидный анион, перекись водорода, а также другие метаболиты), которые оказывают резко выраженное бактерицидное действие.
С другой стороны, эти вещества губительны для здоровых тканей и самих нейтрофилов, и при сильно выраженном воспалительном процессе происходит их повреждение с развитием гнойного воспаления. Таким образом, положительный эффект нейтрофилов может легко переходить в отрицательный. Кроме активных форм кислорода, нейтрофилы продуцируют и секре-тируют целый ряд других веществ, обладающих бактерицидным действием. Таковыми являются содержащиеся в специфических и азуро-фильных гранулах катионные белки, щелочная фосфатаза, лактоферрин, нейтральные протеа-зы, миелопероксидаза.
Лизоцим (мурамидаза) расщепляет бактериальную стенку, что вызывает осмотическую гибель бактерий. Лактоферрин конкурирует с бактериями за ионы железа, связывает их, лишая бактерии этого важного минерала и действуя бактериостатически.
— Читать далее «Механизмы эксудации на коже. Медиаторы эксудации кожи.»
Оглавление темы «Патология кожи. Виды патологии в эпидермисе и дерме.»:
1. Патологические процессы в коже. Классификация патологии в коже.
2. Патология эпидермиса. Нарушения в клетках эпидермиса.
3. Кератоз. Нарушение пролиферации эпидермиса.
4. Акантолиз. Патология межклеточных связей эпидермиса.
5. Пузыри на коже. Нарушение дермо-эпидермального соединения.
6. Патология дермы. Поражения волокнистого каркаса кожи.
7. Соединительнотканные дистрофии. Набухание соединительной ткани.
8. Гиалиноз и амилоидоз. Воспаление кожи.
9. Фазы воспалительного процесса кожи. Альтерация и эксудация на коже.
10. Механизмы эксудации на коже. Медиаторы эксудации кожи.
Говоря о местных реакция, различные авторы сходятся во мнении, что следует выделять 3 основные стадии раневого процесса. Так Чернух A.M. (1979) выделял стадию повреждения, стадию воспаления и стадию восстановления. Серов В.В. и Шехтер А.Б. (1981) раневой процесс делили на стадии: травматического воспаления, пролиферации и регенерации, образования рубца.
С нашей точки зрения, выделение этих стадий носит условный характер, так как в недрах предыдущей стадии, создаются условия для формирования последующей. Кроме того, процесс заживления кожной раны зависит и достаточно радикально, от многих факторов. В частности от характера повреждающего агента; места, глубины и площади повреждения: обсемененности гноеродной флорой; адаптационных способностей и иммунитета; возраста и сопутствующих заболеваний. Поэтому, течение раневого процесса при одинаковой травме у разных людей, может пойти по разному и, в конечном результате, привести к совершенно разному исходу — рубцам группы № 1 или келоидным и гипертрофическим.
Самые тяжелые по последствиям травмы связаны:
- с воздействием на кожу физических (термических, холодовых, радиационных) и химических (кислоты, щелочи) факторов;
- с разможжением мягких тканей;
- с инфицированием ран;
- с загрязнением ран землей;
- с травмами на фоне стресса;
- с нарушенной нейрогуморапьной и эндокринной регуляцией у пациентов.
Как правило, такие травмы дают затяжной процесс репарации тканей и как следствие — келоидные или гипертрофические рубцы, рубцовые деформации и контрактуры.
Воспаление
Воспаление — это возникшая в ходе эволюции стереотипная защитно-приспособительная местная сосудисто-тканевая реакция живых систем на действие патогенных раздражителей, вызвавших повреждение.
В качестве основных компонентов оно включает в себя изменения кровообращения, преимущественно микроциркуляторного русла, повышение сосудистой проницаемости, миграцию лейкоцитов, эозинофилов, макрофагов, фибробластов в зону повреждения и их активную деятельность в ней, направленную на устранение повреждающего фактора и восстановление (или замещение) поврежденных тканей. Таким образом, воспаление по своей биологической сущности является защитной реакцией организма. Воспаление кожи условно делят на иммунное и неимунное. Травмы кожи, вызывают развитие неиммунного воспаления. Поскольку любой травме коже сопутствует воспалительная реакция, стадии течения раневого процесса можно приравнять к стадиям воспаления. По форме воспалительной реакции такое воспаление относят к альтеративному так как оно характеризуется остро возникшим повреждением кожи.
Стадии воспаления
По признанию многих исследователей, наиболее точно течение раневого процесса и воспалительной реакции, отражает классификация Струкова А.И. (1990), который выделил 3 фазы воспаления:
- Фаза повреждения или альтерации.
- Фаза эксудации (сосудистая реакция).
- Фаза восстановления или пролиферации
Первая фаза повреждения или альтерации характеризуется деструктивным процессом, сопровождаемым гибелью клеток, сосудов и выделением в рану большого числа медиаторов воспаления и крови. Медиаторы воспаления, представляют собой широко распространенную группу биологически активных веществ, к которым относятся такие вещества, как серотонин, гистамин, интерлейкины, лизосомальные ферменты, простагландины, фактор Хагемана и др. Наиболее важными их представителями являются эйкозаноиды, предшественником которых является арахидоновая кислота — незаменимая жирная кислота, входящая в состав фосфолипидов клеточных стенок. При травме происходит разрушение клеточных мембран с появлением большого количества «сырья» для образования медиаторов воспаления. Эйкозаноиды обладают чрезвычайно высокой биологической активностью. В развитии воспаления принимают участие такие типы эйкозаноидов, как простагландины типа Е, простациклин (простагландин I), тромбоксаны, лейкотриены. Они способствуют дилятации сосудов, тромбообразованию; увеличивают проницаемость сосудистой стенки, усиливают миграцию лейкоцитов и др.
Повреждение эндотелия капилляров вызывает появление веществ, стимулирующих полиморфноядерные лейкоциты, которые в свою очередь усиливают повреждение сосудистой стенки. Все это приводит к замедлению кровотока, а затем к его полной остановке.
Вторая фаза или фаза эксудации характеризуется в основном реакцией со стороны сосудистого русла и клеток, выходом форменных элементов и жидкой части крови и лимфы во внесосудистую область. Лейкоциты, эритроциты, лимфоциты оказываются в ране наряду с клеточным детритом и соединительнотканными клеточными и структурными элементами. Клеточные скопления представляют собой воспалительный инфильтрат, состоящий в основном из полиморфно-ядерных лейкоцитов, лимфоцитов, макрофагов, тучных клеток. В ране происходит активное размножение клеток, принимающих участие в воспалительном процессе — мезенхимных, адвентициальных, эндотелиальных, лимфоцитов, фибробластов и др. Продолжается очищение раны от тканевого детрита и бактериальной флоры. Происходит новообразование сосудов, которые являются основой грануляционной ткани.
Более детально эту фазу можно разделить на несколько стадий:
Сосудистая стадия. Характеризуется кратковременным спазмом (до 5 мин.) и последующим расширением капилляров кожи, что сопровождается повышением проницаемости капилляров и посткапиллярных венул заинтересованной области. Стаз в сосудах, наступающий после замедления скорости кровообращения приводит к краевому стоянию лейкоцитов, образованию агрегатов, прилипанию их к эндотелию и выделению в зону контакта с эндотелием лейкокининов, повышающих проницаемость микрососудов и создающих условия для фильтрации плазменных хемотаксинов и выхода форменных элементов крови в очаг воспаления. Сами нейтрофилы выпускают псевдоподии (цитоплазматические отростки) и выбираются из сосуда наружу, помогая себе ферментами (катепсин, эластаза и др.). Клинически эта стадия проявляется отеком.
Клеточная стадия. Характеризуется диапедезом, сквозь расширенные межклеточные щели капилляров, в рану нейтрофильных лейкоцитов, процесс накопления которых в кожном дефекте начинается уже через 2-3 часа после травмы. Полиморфноядерные лейкоциты обладают чрезвычайно высоким флогогенным потенциалом, проявляющимся гиперпродукцией и гиперсекрецией лизосомальных гидролаз (простагландинов), лейкотриенов, активных форм кислорода, обуславливающих дополнительное повреждение эндотелия и расстройство микроциркуляции. Наряду с этим, нейтрофилы являются источником факторов, с помощью которых другие клетки, в том числе тромбоциты, тучные клетки, эозинофилы, мононуклеары подключаются к процессу воспаления. У них есть также специальные рецепторы к IgG и С, благодаря чему на этой стадии эксудативно-деструктивного воспаления формируются кооперативные связи между полиморфноядерными лейкоцитами-эффекторами и гуморальными медиаторами и прежде всего, системой комплемента. Происходит это за счет аутоактивации фактора XII или фактора Хагемана (HF), индуцирующего процессы свертывания крови, фибринолиз, активацию калликреин-кининовой системы. Из всех медиаторных систем плазмы, включающихся при повреждении эндотелия, основное значение имеет система комплемента. Ее активация происходит при связывании С, с IgG после чего С, становится активной сериновой протеиназой. Однако активация комплемента может быть и плазмином, C-реактивным белком, кристаллами мононатриевой соли мочевой кислоты, некоторыми бактериальными гликолипидами. Связывание и активация С, приводит к образованию С1 эстеразы (CIs), которая расщепляет второй белок каскада — С на С4а и С4b. Третий белок, принимающий участие в активации комплемента — С2. Он также расщепляется активированным С1, прикрепляясь к фрагменту С4b. Образовавшийся фрагмент С2а, соединяясь с С4b приобретает ферментативную активность (С3-конвертаза) и расщепляет С3 на 2 фрагмента — С3а и С3b.
СЗb соединяется с компонентом комплемента С5, который распадается на С5а и С5b С5а также как и СЗb переходит в жидкую фазу. Таким образом, образуются фрагменты С5а и СЗb, обладающие хемотаксисными свойствами, которые становятся плазменными медиаторами воспаления. Через С5а и СЗа к воспалению подключаются тучные клетки, выделяющие гистамин, серотонин, хемотаксин для эозинофилов. С5а вызывает повышение сосудистой проницаемости, инициирует хемотаксис нейтрофилов и моноцитов, агрегацию нейтрофилов и прикрепление к стенкам капилляров. Выделяемые полиморфноядерными лейкоцитами флогогены, включая тромбогенные факторы способствуют тромбозу микрососудов, что ведет к быстрому некрозу периваскулярных тканей и формированию реактивных полинуклеарных инфильтратов. Продукты распада тканей, ауто и ксеноантигены в свою очередь активируют полиморфноядерные лейкоциты, моноциты, макрофаги и тучные клетки, что является причиной дегрануляции нейтрофилов, секреции биологически активных веществ моноцитами, макрофагами и полиморфноядерными лейкоцитами. В ране накапливаются протеинкиназы, вызывающие дальнейшую дегрануляцию тучных клеток, активацию комплемента, фактора активации тромбоцитов, интерлейкинов интерферонов альфа и бета, простагландинов, лейкотриенов. Весь каскад биологически активных молекул активируют фибробласты, Т и В лимфоциты, нейтрофилы, макрофаги, что приводит к стимуляции ферментативной и антибактериальной активности в ране. Способствуя в какой-то степени некрозу тканей, в тоже время нейтрофилы очищают зону повреждения от инфекции и продуктов распада аутолитических клеток/ При затягивании процесса воспаления, возможно на уровне генетически детерминированного дефекта, очаг воспаления принимает торпидное течение, происходит его «хронизация», удлиняется нейтрофильный период клеточной стадии и тормозится фибропластический процесс.
Преобладание в ране нейтрофилов сменяется преобладанием макрофагов, миграция которых в рану провоцирется нейтрофилами.
Мононуклеарные фагоциты, или макрофаги обеспечивают в значительной степени неспецифическую защиту организма за счет своей фагоцитарной функции. Они регулируют деятельность лимфоцитов, фибробластов. выделяют окись азота (NО), без которой клетки эпителия не могут начать миграцию, несмотря на наличие факторов роста в среде/. В ране содержится большое количество факторов роста. Тромбоцитарный фактор роста стимулирует пролиферацию клеток мезенхимального происхождения, таких как фибробласты. Трансформирующий фактор роста-бета стимулирует хемотаксис фибробластов и продукцию ими коллагена. Эидермальный фактор роста усиливает пролиферацию и миграцию кератиноцитов, трансформирующий фактор роста-альфа влияет на ангиогенез, фактор роста кератиноцитов стимулирует заживление раны. Основной фактор роста фибробластов — положительно влияет на рост всех типов клеток, стимулирует продукцию протеаз, хемотаксис фибробластов и кератиноцитов, продукцию компонентов внеклеточного матрикса. Секретируемые клетками, находящимися в ране, цитокины, активированные протеазами и другими биологически-активными молекулами, выполняют эффекторные и регуляторные функции. В частности, интерлейкин-1 способствует активации Т-лимфоцитов, влияет на продукцию фибробластами протеогликанов и коллагена. Активированный Т-лимфоцит продуцирует и секретирует интерлейкин-2, стимулирующий Т-лимфоцит. В свою очередь Т-лимфоцит продуцирует интерферон-альфа, активирующий функцию макрофагов и выработку интерлейкина-1.
Фаза восстановления или пролиферации
Эту фазу называют еще и репаративной, так как в месте травмы продолжается размножение клеток и секреция коллагена, направленная на восстановление гомеостаза и закрытие раневого дефекта. Акцент клеточного спектра в этой фазе смещается в сторону пролиферации, дифференцировки и трансформации фибробластов и пролиферации кератиноцитов. Известно, что чем быстрее купируется воспаление, как ответная реакция организма на повреждение целостности кожного покрова и происходит закрытие раневого дефекта волокнистыми и клеточными структурами соединительной ткани с последующей эпителизацией, тем более благоприятный вид будет иметь рубец. Грануляционная ткань, которая образовалась на месте бывшего кожного дефекта, заживающего вторичным натяжением, представляет собой петли новообразованных сосудов, окруженных гликозаминогликанами и клеточными элементами. В процессе завершения воспаления и в результате фиброзных преобразований она организуется в рубцовую.
Чем менее глубокой была травма, чем быстрее купируется воспаление, как ответная реакция организма на повреждение, чем быстрее происходит эпителизация раневого дефекта, тем более благоприятный вид имеет рубец. При инфицированных, длительно незаживающих ранах, а также при наличии предрасполагающих факторов происходит хронизация воспалительной реакции и переход адекватного воспаления в неадекватное. Местные иммунные сдвиги в организме таких больных проявляются в уменьшении числа тучных, плазматических и лимфоидных клеток в гранулирующей ране. Неадекватное воспаление не отграничивает себя, имеет затяжное течение, характеризуется избыточным образованием медиаторов воспаления, гипоксией, снижением фагоцитарной активности клеток, пролиферацией определенных популяций фибробластов, которые отличаются высоким обменом веществ и синтезом коллагена. В результате такое воспаление заканчивается образованием келоидных или гипертрофических рубцов.
 [1], [2], [3], [4], [5], [6]
[1], [2], [3], [4], [5], [6]
