Функции нейтрофилов в очаге воспаления
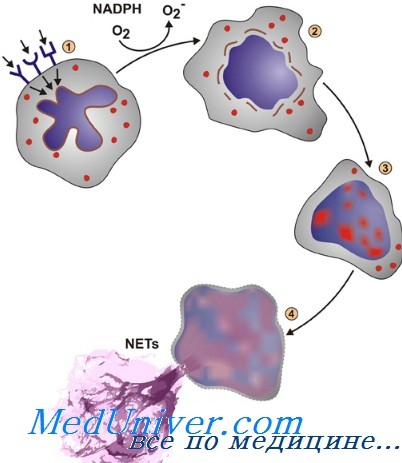
Нейтрофилия. Защитные механизмы воспаления
а) Резкое увеличение количества нейтрофилов в крови — нейтрофилия. В течение нескольких часов после начала острого, тяжелого воспаления количество нейтрофилов в крови возрастает иногда в 4-5 раз, т.е. от нормального количества 4000-5000 до 15000-25000 нейтрофилов в 1 мкл. Это состояние называют нейтрофилией, что означает увеличение количества нейтрофилов в крови.
Нейтрофилия вызывается продуктами воспаления, которые входят в кровоток, транспортируются к костному мозгу и там действуют на резервные нейтрофилы костного мозга, заставляя их выходить в циркулирующую кровь. Это обеспечивает возможность доставки еще большего числа нейтрофилов в воспаленную тканевую область.
б) Вторичная инвазия макрофагов в воспаленную ткань является третьей «линией обороны». Вместе с инвазией нейтрофилов моноциты поступают из крови в воспаленную ткань и увеличиваются, становясь макрофагами. Однако количество моноцитов в циркулирующей крови низкое; запас моноцитов в костном мозге также гораздо меньший, чем запас нейтрофилов. Следовательно, увеличение количества макрофагов в воспаленной ткани происходит значительно медленнее, чем нейтрофилов, и требует нескольких дней, чтобы стать эффективным.
Более того, даже после внедрения в воспаленную ткань моноциты являются еще незрелыми клетками, и нужно 8 ч или более для разбухания их до значительных размеров и развития громадного количества лизосом; только тогда они приобретают характерную для тканевых макрофагов высокую способность к фагоцитозу. Однако на протяжении периода от нескольких дней до нескольких недель макрофаги становятся преобладающими фагоцитарными клетками воспаленной области из-за значительного увеличения продукции новых моноцитов костным мозгом, что будет объяснено далее.
Как уже подчеркивалось, в сравнении с нейтрофилами макрофаги могут фагоцитировать гораздо больше бактерий (примерно в 5 раз) и значительно более крупные частицы, включая даже сами нейтрофилы и большое количество некротизированной ткани. Кроме того, макрофаги играют важную роль в инициации развития антител.
в) Увеличение продукции гранулоцитов и моноцитов костным мозгом является четвертой «линией обороны». Это происходит в связи со стимуляцией гранулоцитарных и моноцитарных клеток-предшественников костного мозга. Однако требуются 3-4 сут, прежде чем вновь сформированные гранулоциты и моноциты достигнут стадии, когда они покидают костный мозг. Если стимул из воспаленной ткани продолжает действовать, костный мозг может непрерывно производить эти клетки в огромных количествах в течение нескольких месяцев и даже лет, иногда со скоростью, в 20—50 раз превышающей норму.
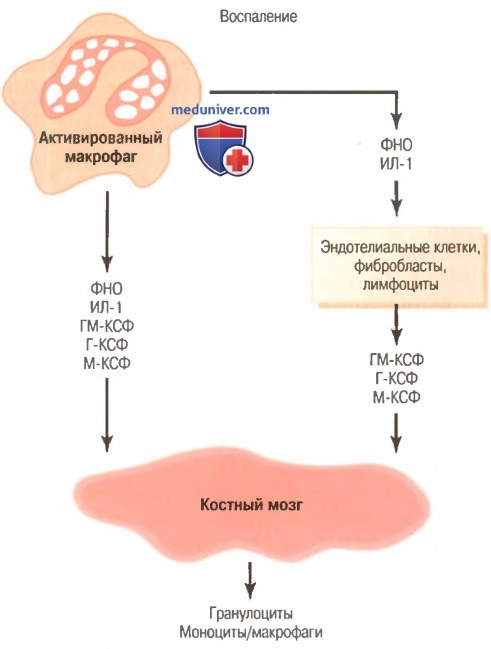
Регуляция формирования гранулоцитов и моноцитов-макрофагов костным мозгом с помощью множества факторов роста, выделяемых из активированных макрофагов в воспаленной ткани.
Г-КСФ — гранулоцитарный колониестимулирующий фактор, ГМ-КСФ — гранулоцитарно-моноцитарный колониестимулирующий фактор,
ИЛ-1 — интерлейкин-1, М-КСФ — моноритарный колониестимулирующий фактор,
ФНО — фактор некроза опухоли
г) Регуляция реакций макрофагов и нейтрофилов по принципу обратной связи. В настоящее время известно более двух дюжин факторов, участвующих в регуляции реакции макрофагов на воспаление, пять из них, как полагают, играют доминирующую роль. Они представлены на рисунке выше и включают:
(1) фактор некроза опухоли (ФНО);
(2) интерлейкин-1 (ИЛ-1);
(3) гранулоцитарно-моноцитарный колониестимулирующий фактор (ГМ-КСФ);
(4) гранулоцитарный колониестимулирующий фактор (Г-КСФ);
(5) моноцитарный колониестимулирующий фактор (М-КСФ).
Эти факторы формируются активированными макрофагальными клетками и в меньших количествах — другими клетками воспаленной ткани.
Основными стимуляторами увеличения продукции гранулоцитов и моноцитов костным мозгом являются три колониестимулирующих фактора, один из которых (ГМ-КСФ) повышает продукцию и гранулоцитов, и моноцитов; два других (Г-КСФ и М-КСФ) усиливают продукцию гранулоцитов и моноцитов, соответственно. Эта совокупность ФНО, ИЛ-1 и колониестимулирующих факторов обеспечивает мощный механизм обратной связи, который начинается с воспаления ткани и развивается до формирования большого количества защитных белых клеток крови, которые помогают удалять причину воспаления.
— Также рекомендуем «Образование гноя. Эозинофилы и базофилы»
Оглавление темы «Клетки иммунитета. Виды иммунитета»:
1. Ретикулоэндотелиальная система. Макрофаги в лимфатических узлах
2. Альвеолярные макрофаги в легких. Клетки Купфера печени
3. Эффекты воспаления. Макрофаги и нейтрофилы при воспалении
4. Нейтрофилия. Защитные механизмы воспаления
5. Образование гноя. Эозинофилы и базофилы
6. Лейкопения. Лейкемии и его типы
7. Врожденный иммунитет. Приобретенный или адаптивный иммунитет
8. Типы приобретенного иммунитета. Лимфоциты в приобретенном иммунитете
9. Длительность жизни белых клеток крови. Нейтрофилы и макрофаги
10. Роль лимфоцитарных клонов. Происхождение клонов лимфоцитов
Значение нейтрофилов. Механизмы фагоцитоза
Воспалительная реакция нейтрофилов возникает, когда в крови посткапиллярных венул эти клетки «обнаруживают» небольшое количество хемокинов и других хемотаксических веществ, выделяющихся из очага инфекции. Эти растворимые эффекторы воспаления вызывают изменения состава и активности поверхностных молекул эндотелиальных клеток и нейтрофилов. Начальные взаимодействия между этими клетками (главным образом, между селектинами нейтрофилов и углеводными компонентами поверхности эндотелия) отличаются низким сродством и обратимостью.
В результате происходит так называемое перекатывание лейкоцитов по эндотелию; слабые связи образуются и распадаются, приводя к колебательному движению нейтрофилов по поверхности эндотелия. Перекатывание обеспечивает более тесный контакт нейтрофилов с такими активирующими факторами, как ФНО) или ИЛ-1, вследствие чего возникают качественные и количественные изменения Р2-интегриновых рецепторов нейтрофилов (поверхностные молекулы группы CD11/CD18).
Активированные интегриновые рецепторы прочно связывают нейтрофилы друг с другом и с эндотелиальными клетками. Окончательный результат всех этих межклеточных взаимодействий сводится к тому, что нейтрофилы распластываются на эндотелиальных клетках и образуют агрегаты друг с другом и с тромбоцитами, приводя к сужению просвета венул и снижению кровотока.
На следующем этапе интегриновые рецепторы нейтрофилов концентрируются на поверхности псевдоподий. Нейтрофилы способны перемещать свои интегриновые рецепторы по поверхности и изменять свою конфигурацию, что позволяет им проходить через контакты между эндотелиальными клетками и проникать в ткани. Затем они мигрируют в очаг инфекции по градиенту концентраций хемокинов или других хемоаттрактантов. Миграция нейтрофилов — сложный процесс, включающий циклы перемещения рецепторов, проведение сигналов в клетки и перестройку актиновых нитей цитоскелета.

Проникновению нейтрофилов сквозь базальную мембрану сосудов и соединительную ткань способствует секреция этими клетками специфических гранул или везикулярных элементов, содержащих желатиназу, гепариназу и другие ферменты. Достигнув очага инфекции, нейтрофил с помощью Fc-участка иммуноглобулина и рецепторов комплемента, фи-бронектина и других молекул адгезии распознает патогенный агент.
Поглощаемые нейтрофилами микробы предварительно подвергаются опсонизации (подготовке к поглощению) сывороточными термостабильными и термолабильными факторами, соответственно IgG и СЗ. Опсонины облегчают фагоцитоз, при котором микроб втягивается в закрытую вакуолю, называемую фагосомой.
Образование фагосомы сопровождается двумя реакциями, необходимыми для проявления бактерицидной активности нейтрофилов, — дегрануляцией и активацией НАДФ-зависимой оксидазы. Слияние мембран гранул с мембраной фагосомы приводит к появлению в фагосоме белков, обладающих мощной антимикробной активностью. Содержимое специфических, а затем и азурофильных гранул попадает в фагосому. Одновременно в ее мембране происходит сборка и активация НАДФ-зависимой оксидазы.
Под действием этого фермента из молекулярного кислорода образуется большое количество супероксид-аниона (O2), который, в свою очередь, превращается в перекись водорода (Н2O2) и синглетный кислород. Н2O2 реагирует с O2, образуя гидроксильные радикалы. В присутствии миелопероксидазы (основного компонента азурофильных гранул) и хлоридного иона в фагосоме образуется хлорноватистая кислота (НОС1). Н2O2 и НОС1 не только обладают бактерицидной активностью, но и модулируют иммунные реакции. Эти оксиданты денатурируют белки, повышая их чувствительность к протеолизу, и, кроме того, активируют некоторые протеазы нейтрофилов.
Все это способствует разрушению патогенного агента и удалению его из очага инфекции. Оксиданты также инактивируют хемотаксические факторы, прекращая приток нейтрофилов в очаг инфекции и тем самым ослабляя процесс воспаления.
— Также рекомендуем «Мононуклеары: моноциты и макрофаги»
Оглавление темы «Клетки иммунной системы»:
- Механизмы созревания нейтрофилов. Дифференцировка нейтрофилов
- Значение нейтрофилов. Механизмы фагоцитоза
- Мононуклеары: моноциты и макрофаги
- Активация макрофагов. Механизмы
- Функции и значение макрофагов
- Нарушения функции моноцитов и макрофагов иммунитета
- Функции и значение эозинофилов
- Причины эозинофилии. Гиперэозинофильный синдром
- Нарушения функции фагоцитов. Генетические причины недостаточности адгезии лейкоцитов
- Клиника и лечение недостаточности адгезии лейкоцитов — НАЛ
Фагоцитоз – это способность определенных клеток (фагоцитов) удерживать и переваривать плотные частицы. Это явление было открыто И. Мечниковым.
Фагоцитоз осуществляется микрофагами (нейтрофилами) и системой мононуклеарных макрофагов.
Мононуклеарные макрофаги
Система (MMS) включает следующие элементы:
- промоноциты (костный мозг);
- моноциты (кровь);
- тканевые макрофаги;
- гистиоциты соединительной ткани;
- печеночные клетки Куппера;
- легочные альвеолярные макрофаги;
- свободные и фиксированные макрофаги лимфатической ткани;
- плевру и перитонеальные макрофаги.
Клетки мононуклеарной системы объединяет общее происхождение гемопоэтических клеток и саморегуляция.
Моноцитопоэз
Моноцитопоэз – это стимулирующий фактор колонии фибробластов и фактор роста макрофагов, но он же подавляет (отрицательная саморегуляция) интерферон фибробластов и лейкоцитов и т. д.
Процесс фагоцитоза делится на четыре стадии:
- Приближение.
- Адгезия.
- Оседание;
- Стадия пищеварения.
Фаза приближения
Фагоцит приближается к объекту – бактериям, мервому клеточному элементу, инородному объекту. При движении под действием хемотаксиса цитоплазма фагоцита образует удлинения (псевдоподии).
Адгезия
Способствует образованию аминополисахаридов на поверхности фагоцитов и перекрытию фагоцитарного объекта белками сыворотки, особенно иммуноглобулинами. Последний механизм по сути является опсонизацией – бактерии и поврежденные клетки перекрываются с IgM, IgG и компонентами комплемента (C3, C5 и др.), что облегчает адгезию к фагоциту.
Адгезия
Поверхность фагоцита заряжена отрицательно, поэтому адгезия лучше, если объект, подлежащий фагоцитозу, заряжен положительно. Менее фагоцитарны отрицательно заряженные объекты, такие как опухолевые клетки.
Оседание
Этап фагоцитации объекта – путь инвагинации. Сначала фагоцит образует углубление, а затем фагосому – вакуоль, содержащую объект, подлежащий фагоцитозу. НАДН-зависимая оксидаза в мембране фагоцитов активируется до образования фагосом; в результате O2 превращается в O 2 ~ (супероксид-анион) и образуется H 2 O 2.
Эти продукты обладают бактерицидным действием, а также вызывают образование свободных радикалов. Под действием пероксидаз и каталаз H 2 O 2 расщепляется и высвобождается молекулярный O 2. Свободные радикалы и активный молекулярный O 2 действуют на мембрану фагоцита и объект, подлежащий фагоцитозу, активируя перекисное окисление липидов.
Липопероксиды и свободные радикалы неустойчивы к лизосомным мембранам и способствуют высвобождению лизосомальных ферментов.
Стадия пищеварения
Лизосомы присоединяются к фагосоме, содержащей фагоцитарный объект. Эти органеллы содержат все ферменты, необходимые для расщепления углеводов, белков, жиров и нуклеиновых кислот. В еще неактивной форме они попадают в вакуоль фагоцитов.
Пищеварительная вакуоль образуется при pH около 5,0, близком к оптимальному для лизосомальных ферментов. Активируются лизосомальные ферменты, и фагоцитарный объект постепенно переваривается. Во время стадии пищеварения проницаемость мембраны фагосомы увеличивается, содержимое фагосомы ускользает в цитоплазму, и микрофаг умирает (этому процессу способствует ацидоз). В этом случае фагоцитарный микроорганизм также может сохранять жизнеспособность.
Роль макрофагов в воспалительном процессе
Макрофаги начинают участвовать в фагоцитозе позже микрофагов. Макрофаги также более устойчивы к гипоксии и ацидозу, например, моноциты жизнеспособны даже при pH 5,5.
В очаге воспаления макрофаги выполняют несколько функций:
- Фагоцитируют бактериальные остатки, оставшиеся после эвакуации гноя и продуктов распада тканей – очищающая функция;
- Высвобождают лизосомальные ферменты – гиалуронидазу, аминопептидазу и др;
- Синтезируют компоненты системы комплемента и простагландины.
Взаимодействие макрофагов и лимфоцитов при хроническом воспалении
В то же время воспаленная тканевая среда также стимулирует образование фибробластов и фиброцитов. Постепенно появляется новая, богатая сосудами грануляционная ткань.
Фагоцитоз стимулируется продуктами повреждения тканей – внутриклеточные белки, ферменты, полипептиды, аминокислоты, электролиты и т. д., биологически активными веществами, половыми гормонами, тироксином, адреналином, лихорадкой. Но подавляется недостатком стимулирующих факторов, глюкокортикоидов, гликолортикоидов, ацетилхолина, ацетилхолина.
Фагоцитоз
Считается, что клетки плаценты и злокачественные опухоли способны секретировать вещество, которое подавляет функцию макрофагов, иммунологические реакции лимфоцитов и эмиграцию лейкоцитов, что приводит к значительному ослаблению или даже прекращению воспаления.
Объекты, которые фагоциты не могут переваривать, остаются в этих клетках в течение длительного времени и покрываются тонкой пленкой аминополисахаридов. После гибели фагоцитов они повторно фагоцитируются или выводятся из организма. Процесс, при котором фагоцит после переваривания высвобождает часть продуктов своего фагоцитоза в окружающую среду, называется экструзией.
Фагоцитоз – не единственный в организме механизм борьбы с воспалением. Большинство микроорганизмов погибают в условиях ацидоза, а также от ферментов, высвобождаемых во время гибели клеток и функционирования иммунокомпетентной системы.
Нейтрофилы во внеклеточном пространстве секретируют катионные белки, которые могут убивать ферменты без ферментов и фагоцитоза. Таким образом, воспалительные очаги постепенно избавляются от микроорганизмов и мертвых клеток.
Асептическое и острое воспаление
Дальнейшее течение воспаления зависит от того, является ли воспаление асептическим или бактериальным.
В асептических воспалительных условиях, например, вокруг хирургического шва, инородного тела, стенка микрофагов (нейтрофилов) начинает формироваться в течение нескольких часов, достигая максимума в течение дня.
Позже появляется следующий вал макрофагов, который достигает максимума через 2-3 раза. в день. Эмигрировавшие лейкоциты постепенно становятся неподвижными, больше не могут делиться и погибают в течение 3-5 дней. 2-3. на 5 сутки начинает формироваться стенка фибробластов, а на 5 сутки – соединительнотканная капсула.
Таким образом, в случае острого воспаления патогенный агент в организме преобразует белки, которые участвуют в реакции антиген-антитело, медиаторы и модуляторы воспаления, систему фагоцитов и миграцию клеток. В результате заканчивается острое воспаление. Однако, если инфекционные агенты попадают в участок асептического воспаления, например, в результате травмы, это воспаление становится септическим (бактериальным) воспалением.
Бактериальные воспалительные состояния бактерий и токсинов, не вызывающие гиперемии, экссудации и эмиграции лейкоцитов. Между клетками воспаленных тканей и особенно вокруг кровеносных сосудов накапливается все больше и больше микрофагов. Лизосомы микрофагов содержат множество активных ферментов, и эти клетки также начинают процесс фагоцитоза. При пальпации воспаленная ткань в это время кажется плотной, поэтому это называется стадией воспалительной инфильтрации.
По мере прогрессирования воспаления лейкоциты и те тканевые клетки, которые претерпели необратимые изменения во время воспаления, погибают. В этих клетках высвобождаются лизосомальные ферменты, которые расщепляют тканевые белки, белковые и липидные комплексы и другие структуры. Это стадия гнойного размягчения воспаления.
Эти стадии наблюдаются, например, у пациентов с гнойным воспалением перикарда (фурункул), гнойным воспалением апокринных потовых желез (гидраденит) и гнойным воспалением соединительной ткани (флегмона). При вдыхании воспаленная ткань выглядит мягкой, с характерным раскачиванием – флюктуацией. Образуется замкнутое скопление гноя – абсцесс.
Гнойное воспаление перикарда
Гной разрывается в направлении наименьшего сопротивления (либо наружу, либо внутри тела). Если гной попадает в кровоток (пемия), в организме может развиться множество очагов гноя, но под действием микроорганизмов и токсических веществ – угрожающее общее заболевание (сепсис, септикопиемия). Поэтому важно диагностировать накопление гноя и обеспечить хирургический дренаж гноя наружу.
Продолжение статьи
- Часть 1. Этиология и патогенез воспаления. Классификация.
- Часть 2. Особенности обмена веществ при воспалении.
- Часть 3. Физико – химические изменения. Роль нервной и эндокринной систем в развитии воспаления.
- Часть 4. Изменения в периферическом кровообращении при воспалении.
- Часть 5. Экссудация. Экссудат и транссудат.
- Часть 6. Эмиграция лейкоцитов. Хемотаксис.
- Часть 7. Фагоцитоз. Асептическое и острое воспаление.
- Часть 8. Распространение. Последствия. Принципы лечения воспаления.
