Изменение реологических свойств крови при воспалении
Изменения реологических свойств крови. Эмболия
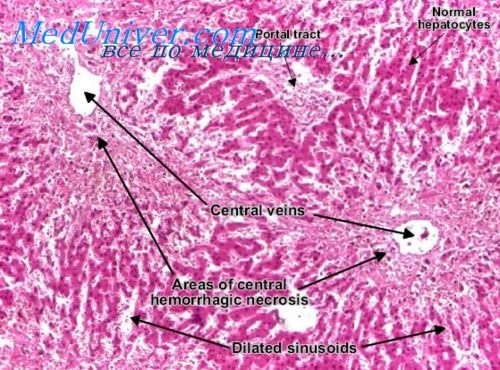
Изменения реологических свойств крови заключаются в нарушении текучести клеточных и плазматических компонентов крови и деформации клеточных элементов. Микроскопически это выражается стазами, мпкротромбамп, агрегацией эритроцитов, отмешпванием форменных элементов от плазмы, а также эритроцитов от лейкоцитов и обычно сопутствует полнокровию — артериальному и венозному.
Стазы крови характеризуются заполнением просвета мелких сосудов, чаще капилляров, чрезвычайно плотно прилежащими друг к другу эритроцитами, очертания которых выявляются нечетко. При этом просвет сосуда резко расширен и сгенка (соответственно) истончена.
При агрегации эритроцитов в просвете сосудов среднею калибра (чаще в венах) видны конгломераты склеенных эритроцитов, контуры которых почти не определяются. Такие конгломераты обычно расположены эксцентрично в массе плазмы.
В просветах венул, реже артериол возможно образорапне обтурирующих коагуляцнонных гиалиновых тромбов. Микроскопически они имеют вид гомогенной массы, которая окрашивается эозином в интенсивно-розовый цвет.
Эмболия. Это острый патологический процесс, который возникает в результате закупорки сосудов разного калибра попадающими в ток крови каплями жира, частицами поврежденной или измененной болезнью ткани, пузырьками воздуха или газа, оторвавшимся тромбом. В зависимости от источника различают жировую, паренхпмно-клеточную (тканевую), воздушно-газовую эмболии, а также тромбоэмболию.
Первичные изменения кровообращения при различных повреждающих воздействиях имеют последовательность (фазность) развития, в местных, регионарных и общих их проявлениях. Схематически это можно представить так: вначале возникает рефлекторная реакция в виде спазма сосудов и соответственно малокровие, затем наступает расширение л полнокровие, являющееся универсальной компенсаторно-приспособительной реакцией.

Вторая фаза реакции — расширение сосудов — сменяется или нормализацией сосудистого русла, пли изменениями, обусловленными дистопией. Последняя относится уже к так называемым ранним изменениям кровообращения. К ним причисляют также кровоизлияния, плазморрагий и тромбоз.
Смена реакций в различных органах и тканях, подчиняясь общим закономерностям по существу и по времени, имеет свои отличия, зависящие от особенностей их васкуляризации и мобилизации приспособительных структур, а также от механизма умирания.
Общим закономерностям по существу и по времени, имеет свои отличия, зависящие от особенностей их васкуляризации и мобилизации приспособительных структур, а также от механизма умирания.
На месте повреждения кожного покрова после кратковременного спазма терминальных сосудов происходит их расширение и кровенаполнение как компенсаторно-приспособительная реакция. Морфологически спазм улавливается в случаях быстро наступившей смерти. Далее, в зависимости от тяжести и характера повреждения наступает нормотопическое состояние сосудов или сохраняется гиперемия, но уже как проявление воспаления.
Иногда при этом наблюдаются элементы дистопии в виде паретического полнокровия отдельных сосудов. Собственно диетопическое состояние сосудов наряду с полнокровием может иметь место в подкожной клетчатке п в подлежащих мышцах на некотором отдалении от очага повреждения, как проявление регионарной реакции.
При особых условиях, например при обильной кровопотере, возникновение регионарной реакции обусловлено тяжестью повреждения. Еще в большей степени это относится к общей реакции.
Если возникает общая реакция, то ее первой фазой также является спазм большинства сосудов терминального русла и прежде всего сосудов артериального типа. Продолжительность и выраженность спазма (резкий, умеренный, слабый) неодинаковы. Сроки смены спазма в сосудах различных органов и тканей могут не совпадать. Так, в коре головного мозга сужение просвета сосудов и обеднение кровью может продолжаться несколько часов и суток после травмы.
С увеличением давности травмы спазм обычно сменяется расширением сосудов по дистоническому типу. В мелких артериях и артерполах это характеризуется наличием участков сужений и расширений просвета, а в венозном отделе микроциркуляторного русла — преобладанием явлении пареза сосудов и застоя крови, что можно расценить как сосудистую декомпенсацию. По мере развития адаптационно-приспособительных реакции состояние сосудов выравнивается до нормогонии.
— Также рекомендуем «Реакции при кровопотере. Кровоизлияния и плазморрагии»
Оглавление темы «Изменения кровообращения в организме при патологии»:
1. Первичные изменения кровообращения. Гиперемия и ее диагностика
2. Венозная гиперемия. Ишемия — малокровие тканей и органов
3. Изменения реологических свойств крови. Эмболия
4. Реакции при кровопотере. Кровоизлияния и плазморрагии
5. Тромбоз. Изменение лимфообращения
6. Признаки отека легких. Валики в сосудах и их значение
7. Подушечки и почки в сосудах и их значение. Механизмы образования сосудистых подушечек
8. Замыкающие сосуды. Сосудистые анастомозы
9. Значение сосудистых образований. Адаптация сосудистой системы
10. Распределительный тканевой лейкоцитоз. Лейкоциты в тканях организма
Повышение
обмена веществ при воспалении происходит
за счет углеводов. Усиливается их
окисление, и гликолиз. В основе этого
явления лежит активация соответствующих
тканевых ферментов. Увеличивается
потребление кислорода воспаленной
тканью. По мере накопления в очаге
лейкоцитов,ослабевают: расщепления
углеводов анаэробным путем лизосомальными
ферментами, повреждения и снижения
количества митохондрий в ходе альтерации,
реакции окисления заметно, а гликолиз
— нарастает. Расщепление углеводов не
всегда доходит до конечных продуктов
— углекислого газа и воды. Дыхательный
коэффициент снижается. В ткани
накапливаются недоокисленные продукты
углеводного обмена — молочная и
трикарбоновые кислоты.
Вследствие
нарушения обмена жиров, белков и распада
нуклеиновых кислот в очаге нарастает
содержание жирных кислот, кетоновых
тел, полипептидов, аминокислот, нуклеотидов
(АТФ, адениловая кислота), нуклеозидов
(аденозин). Развивается ацидоз. Сначала
он компенсируется тканевыми буферными
системами и ускоренным крово- и лимфотоком.
По мере истощения буферных систем и
замедления крово- и лимфотока ацидоз
нарастает и становится некомпенсированным.
В норме концентрация водородных ионов
в ткани составляет 0,5*10-7,
т.е. рН равен 7,34, при воспалении 25*10-7 и
5,6 и ниже. Чем острее протекает
воспалительный процесс, выраженнее
ацидоз. При остром гнойном воспалении
рН= 6,5-5,39, а при хроническом — 7,1-6,6. Ацидоз
повышает проницаемость сосудов. Он
создает условия для реализации
разрушительных эффектов лизосомальных
ферментов, гликозидаз, расщепляющих
углеводные компоненты матрикса
соединительной ткани.
Наряду
с Н+-гиперионией в очаге нарастает
содержание ионов калия, натрия, кальция.
Это обусловлено разрушением клеток и
усиленной диссоциацией в кислой среде
солей. Вследствие повышения уровня
внеклеточного калия нарушается
соотношение ионов калия и
кальция (дизиония).Изменения в
гомеостазе ионов Са2+
лежит в основе гибели клеток в очаге
воспаления. Са2+
— вторичный мессенджер между мембраной
и клеточными ферментными системами,
генным аппаратом.
Повышение
уровня внутриклеточного Са2+
приводит:
1.
К абсорбции его митохондриальными
мембранами и последующим блокированием
дыхательной цепи электронов.
2.
Активируются нелизосомальные протеазы,
приводя к лизису цитоскелета, деградации
энзимов, мембрано-ассоциированных
белков (ионных каналов, переносчиков,
рецепторов, молекул адгезии).
Снижение
внеклеточного Са2+
важно для выживания клеток, это может
быть препятствием к их новому росту. В
очаге воспаления нарастает молекулярная
концентрация, поскольку в процессе
тканевого распада и усиленного обмена
веществ происходит расщепление крупных
молекул до мелких. Вследствие повышения
ионной и молекулярной концентрации
развивается гиперосмия.
В
результате расщепления белков до
полипептидов и аминокислот с увеличением
концентрации последних происходит
увеличение дисперсности коллоидов, их
способности притягивать и задерживать
воду. Развивается гиперонкия. Изменения
осмотического и онкотического давления
являются важным фактором экссудации и
воспалительного отека.
По
химической структуре выделяют три
группы медиаторов:
1.Биогенные
амины (гистамин, серотонин);
2.Белковой
природы (комплемент, кинины);
3.Прочие
(простагландины).
Фактор,
обеспечивающий их появление- повреждение
лизосом.
Роль
медиаторов и модуляторов в патогенезе
воспаления.
Медиаторы
и модуляторы — это обширная группа
биологически активных веществ различной
природы и происхождения, которым
отводится роль в развитии компонентов
воспаления, что определяется их
свойствами.
Клеточные
медиаторы воспаления.
Повреждение тучных клеток соединительной
ткани вызывает их дезинтеграцию и
дегрануляцию, что сопровождается
высвобождением из гранул биогенных
аминов, гистамина. Он вызывает расширение
мелких артериол, увеличивается их
проницаемость, вызывает чувство боли,
повышает адгезивные свойства эндотелия
сосудов; в больших концентрациях гистамин
вызывает сокращение мелких вен. Когда
повреждаются тромбоциты, из них
высвобождается биогенный амин — серотонин,
повышает проницаемость, тонуса вен ,
вызвает чувство боли.
К
эффектам гистамина далее подключаются
биологически активные вещества
нейтрофилов, эозинофилов и лимфоцитов,
которые мигрируют в зону воспаления из
кровотока. В гранулах нейтрофилов
содержатся гидролазы, лизоцим, катионные
белки, щелочная фосфатаза, миелопероксидаза,
лактоферрин- обладающие антимикробным
эффектом.Мембраны этих клеток -источник
группы медиаторов фосфолипидной природы,
представленые: простагландинами и
лейкотриенами. Предшественником этих
соединений является арахидоновая
кислота, освобождающаяся из фосфолипидов
клеточных мембран под действием
лизосомальных ферментов поврежденных
клеток. Под влиянием фермента
циклооксигеназы запускается каскад
превращений арахидоновой кислоты, в
результате в очаге воспаления накапливаются
простагландины. Под влиянием простагландинов
группы Е проницаемость сосудов возрастает,
и микрососуды расширяются.Простагландины
группы F
вызывают спазм микрососудов и уменьшение
их проницаемости.
При
втором пути из арахидоновой кислоты
образуются лейкотриены. ЛТВ4
(хемотаксический эффект, вызывает
адгезию нейтрофилов к эндотелиоцитам)
ЛТС4,
ЛТД4,
ЛТЕ4
(вазоконстрикция, повышение проницаемости,
отек, бронхоспазм). Некоторые из них
усиливают агрегацию тромбоцитов в них
образуются новые медиаторы воспаления
— серотонин, тромбоксан А2,
простагландины Е.
Тромоксан
А2
вызывает сужение сосудов, усиливает
агрегацию тромбоцитов, тромбообразование,
боль, отек. В неповрежденной сосудистой
стенке при биосинтезе простагландинов
образуется простациклин (или простагландин
I2
расширяет сосуды и тормозит агрегацию
тромбоцитов). Если эндотелий сосудов
поврежден и простагландина оказывается
недостаточно, то в нем образуется
тромбоксан А2,
в результате чего стимулируется агрегация
тромбоцитов и происходит спазм сосудов.
Простациклины
и лейкотриены разных классов оказывают
противоположные эффекты их стали
называть модуляторами воспаления, т.е.
субстанциями, которые способны изменять
действие истинных медиаторов.
1.Лейкотриены
и простагландины реализуют свои эффекты
через системы внутриклеточных
мессенджеров, к которым относятся цАМФ
и цГМФ. Простагландин D2
повышает в клетках уровень цАМФ и,
тормозит выброс медиаторов, ослабляет
воспаление. Простагландин F2a,
повышает уровень цГМФ, усиливает выброс
медиаторов и стимулирует воспаление.
2.Вещества
фосфолипидной природы (эйкозаноиды)
осуществляют регуляцию воспаления.
Оказывают мощный противовоспалительный
эффект при применении ингибиторов их
синтеза.
3.Медиаторы
клеточного: фактор активации тромбоцитов
(ФАТ), ферменты (эластаза, коллагеназа),
нейропептиды, освобождающиеся нервными
волокнами при их повреждении. ФАТ
способствует: усилению агрегации
тромбоцитов, выделению гистамина и
серотонина, активирует процессы
перекисного окисления липидов, увеличивает
проницаемость сосудов. Эластаза и
коллагеназа — разрушают базальную
мембрану сосудистой стенки, увеливает
ее проницаемость.
4.Веществ
белкового происхождения — цитокины(монокины
и лимфокины). Их источником являются
активированные моноциты и лимфоциты
(иногда нейтрофилами и эндотелиоцитами).
Интерлейкин-1 (ИЛ-1) и фактор некроза
опухолей (ФНОа). Цитокины оказывают
влияние на процессы, протекающие в очаге
воспаления, и за его пределами. Они
повышают проницаемость сосудов, усиливают
адгезию, стимулируют эмиграцию и
фагоцитоз лейкоцитов, стимулируют
очищение, пролиферацию и дифференцировку
клеток. Попадая в общую циркуляцию, они
влияют на клетки вне зоны воспалительного
очага (лимфоциты, синовиоциты, гепатоциты,
клетки костного мозга, лимфоциты и
нейроциты).
Эндотелиоцитам
отводят важную роль в процессах краевого
стояния лейкоцитов, что связывают с
секрецией ими молекул клеточной адгезии
(селектины, интегрины, агрессины и
некоторые другие).
Плазменные
медиаторы воспаления.
Эти медиаторы высвобождаются в процессе
активации трех систем: кининовой,
комплементарной и системы свертывания.
Компоненты данных систем находятся в
крови в неактивном состоянии и приобретают
свойства медиаторов при воспалении.
Первым
активируется XII фактор свертывающей
системы крови (фактор Хагемана). При
контакте с чужеродной поверхностью.
XII
фактор запускает процесс внутренней
системы гемокоагуляции. Образующийся
тромбин , переводит фибриноген в фибрин,
способствует адгезии нейтрофилов к
эндотелию, стимулирует образование
тромбоцитами ФАТ, продукцию эндотелием
цитокинов.
Фактор
Хагемана стимулирует превращение
прокалликреинов в калликреины. Среди
кининов известен брадикинин. Он усиливает
местный кровоток, расширяет капилляры,
повышает их проницаемость, вызывает
боль. Кинины влияют на эмиграцию
нейтрофилов, усиливают пролиферацию
фибробластов, синтез коллагена , участвуют
в репаративных процессах при воспалении.
Кинины усиливают высвобождение гистамина
из тучных клеток. При их системном
действии происходит генерализованное
расширение сосудов, снижение артериального
давления, бронхоспазм, брадикардия,
асистолия.
Фактор
Хагемана активирует систему сывороточных
белков системы комплемента. Включаясь
в состав иммунных комплексов, факторы
этой системы осуществляют лизис
бактериальных клеток, обеспечивают
реакции иммунного прилипания (опсонизация
бактерий, вирусов), что делает их
«узнаваемыми» для фагоцитов и стимулирует
фагоцитоз. Среди белков, образующихся
при активации системы комплемента,
отношение к воспалению имеют С5а,
С3а,
С3Ь
и комплекс С5Ь-С9(
отвечает за лизис микроорганизмов и
патологически измененных клеток).
Некоторые компоненты этой системы
обладают хемотаксическим эффектом. Они
способны высвобождать гистамин, медиаторы
из нейтрофилов, стимулируют выделение
простагландинов, лейкотриенов, ФАТ.
К
медиаторам воспаления относятся также
ацетилхолин, катехоламины, гепарин. Они
способны изменять тонус сосудов, их
проницаемость и микротромбообразование,
изменять
реологические
свойства крови.
Сосудистые
расстройства. Экссудация и эмиграция.
Нарушение местного крово- и лимфообращения,
микроциркуляции. Микроциркуляция-
движение крови в терминальном сосудистом
русле (в артериолах, метартериолах,
капиллярных сосудах и венулах), транспорт
различных веществ через стенку этих
сосудов.
Микроциркуляцию
изучают с помощью опыта Конгейма.Сразу
после действия раздражителя (травма
при извлечении кишки) возникает спазм
артериол, который носит рефлекторный
характер и скоро проходит. Далее
развивается артериальная
гиперемия.
Она является результатом образования
в воспаленном очаге вазоактивных веществ
— медиаторов воспаления, которые
расслабляют мышечные элементы стенки
артериол и прекапилляров. Это приводит
к увеличению притока артериальной
крови, ускоряет ее движение, открывает
ранее не функционировавшие капилляры,
повышает в них давление. Приводящие
сосуды расширяются в результате паралича
вазоконстрикторов, сдвига рН среды в
сторону ацидоза, накопления ионов калия,
снижения эластичности окружающей сосуды
соединительной ткани.
Через
30 — 60 мин после начала эксперимента
воспаление меняется: артериальная
гиперемия сменяется венозной. Скорость
движения крови уменьшается, меняется
характер кровотока. При артериальной
гиперемии клетки крови располагались
в центре сосуда (осевой ток), а у стенок
находились плазма и небольшое число
лейкоцитов (плазматический ток), теперь
такое разделение нарушается. Изменяются
реологические свойства крови. Она
становится густой и вязкой, эритроциты
набухают, образуя агрегаты, т.е.
беспорядочные скопления, которые
медленно движутся или совсем останавливаются
в сосудах малого диаметра.
Развитие
венозной
гиперемии
объясняется действием факторов:
1.факторы
крови,
2.факторы
сосудистой стенки,
3.факторы
окружающих тканей.
Краевое
расположение лейкоцитов, набухание
эритроцитов, выход жидкой части крови
в воспаленную ткань и сгущение крови,
образование тромбов вследствие активации
фактора Хагемана, уменьшения содержания
гепарина. Влияние факторов сосудистой
стенки на венозную гиперемию проявляется
набуханием эндотелия, в результате
просвет мелких сосудов еще больше
сужается. Измененные венулы теряют
эластичность и становятся более
податливыми сдавливающему действию
инфильтрата. Проявление тканевого
фактора — отечная ткань, сдавливая вены
и лимфатические сосуды, способствует
развитию венозной гиперемии.
С
развитием престатического состояния
наблюдается маятникообразное
движение крови
— во время систолы она движется от
артерий к венам, во время диастолы — в
противоположном направлении. Движение
крови может полностью прекратиться и
развивается стаз, и как следствие-
необратимые изменения клеток крови и
тканей.
Соседние файлы в предмете Патологическая физиология
- #
- #
При воспалении реакция сосудов стереотипна и развивается в 4 стадии:
1.Кратковременный преходящий спазм артериол и прекапилляров, сопровождающиеся развитием ишемии.
2.Расширение артериол, сопровождающееся ускорением кровотока и развитием артериальной гиперемии.
3.Дальнейшее расширение сосудов и замедление кровотока с развитием венозной гиперемии.
4.Развитие стаза и остановка кровотока.
Начальный спазм сосудов отчетливо выражен при быстро развивающемся повреждении (ожог, травма) и менее заметен при постепенном развитии повреждения (инфекционный процесс). Причиной вазоконстрикции является выделение под влиянием повреждающего фактора сосудосуживающих БАВ: катехоламинов из симпатических нервных окончаний, тромбоксана А2 из тромбоцитов, эндотелина-1 из поврежденных эндотелиоцитов. Кратковременность ишемии обусловлена быстрой инактивацией этих эффекторов и накоплением вазодилататоров.
Расширение артериол, метартериол и прекапиллярных сфинктеров возникает в результате воздействия вазодилататоров: гистамина, кининов, оксида азота и PgI2 (простациклина). В результате скорость кровотока в микро-циркуляторном русле повышается, возрастает количество функционирующих капилляров, увеличивается кровенаполнение тканей, улучшается их оксиге-нация — развивается артериальная гиперемия (см. главу «Нарушение периферического кровотока»). Артериальная гиперемия сохраняется недолго (обычно 10-30 мин) и сменяется венозной гиперемией.
Развитие венозной гиперемии начинается с максимального расширения артериол и прекапиллярных сфинктеров, которые становятся резистентны к сосудосуживающим стимулам, а также с затруднения венозного оттока. Скорость кровотока в микроциркуляторных сосудах падает. Причинами этого состояния являются сдавление венул накапливающимся экссудатом, повышение тонуса их стенок под влиянием гистамина, действующего на Н1-рецепторы. Немаловажную роль в развитии венозной гиперемии имеет изменение реологических свойств крови — повышение ее вязкости в результате выхода жидкой части крови из сосудистого русла при экссудации и «сладжирования» форменных элементов.
Сладж эритроцитов — это прилипание их друг к другу вследствие адсорбции на их поверхности высокомолекулярных глобулинов (белков острой фазы воспаления), что снижает их поверхностный потенциал. Агрегаты эритроцитов формируют структуры напоминающие монетные столбики, которые значительно затрудняют кровоток. Накопление лейкоцитов у стенок посткапилляров и венул в процессе маргинации также способствует замедлению тока крови.
Закономерное развитие причин венозной гиперемии, приводит к стазу и прекращению кровотока в очаге воспаления.
Экстравазация жидкости ( экссудация )
Отличительной особенностью сосудистых изменений при воспалении является значительное повышение сосудистой проницаемости и выход богатой белками жидкости (экссудата) в ткани. Потеря белков плазмой крови приводит к снижению внутрисосудистого онкотического давления и повышению онкотического давления интерстициальной жидкости. Совместно с повышением гидростатического давления в расширенных сосудах, это приводит к значительному оттоку жидкости в ткани и формированию отека.
Повышение проницаемости сосудистой стенки при остром воспалении развивается в 3 фазы, каждая из которых обусловлена различными механизмами.
1. Ранняя преходящая фаза возникает вскоре после повреждения и продолжается 15-30 минут. Механизм повышения сосудистой проницаемости заключается в сокращении эндотелиоцитов и формировании промежутков между ними. Развивается эта реакция под действием гистамина, лейкотриенов, простагландинов и кининов в венулах и не затрагивает капилляры и артериолы.
2. Поздняя продленная фаза начинается через 2 часа после повреждения и продолжается 24 часа и более. Повышается проницаемость капилляров и венул. Изменения в микрососудах являются следствием активации эндоте-лиоцитов и обеспечивается цитокинами (ИЛ-1, ФНО, ИФН-γ). Происходит перестройка цитоскелета эндотелиоцитов, что приводит к разрушению межклеточных контактов и втягиванию цитоплазматических отростков с образованием щелей между соседними эндотелиоцитами. Важное значение имеет усиление транспорта через эндотелиоциты — трансцитоза за счет увеличения количества специфических транспортных органелл.
3.Раннее стойкое повышение проницаемости возникает вследствие прямого повреждения эндотелия, некроза эндотелиоцитов и их отделения от базальной мембраны. Подобная ситуация часто встречается при значительной альтерации в результате ожогов или инфекции экзотоксинпродуцирующими возбудителями (например, Corynebacterium diphteriae, Str pyogenes). Повышение сосудистой проницаемости развивается сразу после повреждения, продолжается несколько часов и наблюдается в артериолах, капиллярах и венулах.
Жидкость, выходящая из микрососудов при повышении их проницаемости, содержащая большое количество белка и форменные элементы крови формирует экссудат, который накапливается в тканях и/или полостях тела при воспалении. Экссудат следует отличать от транссудата, формирующегося, в основном, в результате повышения гидростатического давления в сосудах без повышения их проницаемости (например, при сердечной недостаточности). Для транссудата характерны удельная плотность < 1.012, отсутствие клеток и содержание белка < 2%; для экссудата — удельная плотность > 1.015, наличие клеток-участников воспаления и содержание белка > 2%.
Клеточный и химический состав экссудата имеет диагностическое значение и зависит от причины воспаления, ткани, в которой развивается воспаление, реактивности организма и ряда других факторов.
Различают следующие типы экссудатов:
Серозный — содержит преимущественно альбумины в умеренной концентрации (3-5%) небольшое количество клеток, образуется на ранних стадиях воспаления.
Катаральный (слизистый) — образуется при воспалении слизистых оболочек воздухоносных путей, ЖКТ. Отличается высоким содержанием муко-полисахаридов и секреторных антител (IgA), содержит лизоцим.
Фибринозный экссудат отличается высоким содержанием фибриногена, что является результатом значительного повышения проницаемости сосудов. При контакте с поврежденными тканями фибриноген превращается в фибрин и выпадает в виде ворсинчатых масс (на серозных оболочках) или пленки (на слизистых), вследствие чего экссудат уплотняется. Если фибринозная пленка расположена рыхло, поверхностно, легко отделяется без нарушения целостности слизистой, такое воспаление называется крупозным. Оно наблюдается в желудке, кишечнике, трахее, бронхах. В том случае, когда пленка плотно спаяна с подлежащей тканью и ее удаление обнажает язвенную поверхность, речь идет о дифтеритическом воспалении. Оно характерно для миндалин, полости рта, пищевода. Такое различие обусловлено характером эпителия слизистой оболочки и глубиной повреждения. Фибринозные пленки могут самопроизвольно отторгаться благодаря аутолизу, развертывающемуся вокруг очага, и демаркационному воспалению и выходить наружу; подвергаться ферментативному расплавлению или организации, т. е. прорастанию соединительной тканью с образованием соединительно-тканных сращений, или спаек. Фибринозный экссудат может наблюдаться при дифтерии, дизентерии, туберкулезе.
Гнойный — содержит большое количество лейкоцитов, фрагменты нек-ротизированных тканей. Образуется чаще всего при инфекциях, вызываемыхпиогенными бактериями (стафилококками, стрептококками, пневмококками
и др.).
Геморрагический — содержит большое количество белка и эритроцитов. Образуется при повреждениях сосудов с разрушением базальной мембраны, характерен для сибирской язвы, гриппозной пневмонии и др.
Смешанные формы экссудата могут быть самыми разнообразными (се-розно-фибринозный, гнойно-фибринозный и др.)
Биологическое значение экссудации состоит в том, что, являясь одним из основных компонентов воспаления как, патологического процесса, она выполняет вместе с тем важную защитную роль, которая заключается прежде всего в локализации воспалительного процесса.
Положительные последствия:
1. Экссудат разбавляет, снижает концентрацию повреждающих агентов и тем самым ослабляет их вредное воздействие.
У новорожденных и эмбрионов, у которых экссудация практически не развивается, воспаление принимает характер альтеративного, проявляется тканевыми дистрофиями и некрозом.
2. С экссудатом в очаг воспаления поступают защитные факторы — иммуноглобулины, факторы свертывания крови и др.
3. Экссудат обладает бактерицидными свойствами.
4. Если в экссудате содержится фибрин, он блокирует лимфатические сосуды и препятствует резорбции и генерализации повреждающих факторов.
Отрицательные последствия:
1. Экссудат может механически смещать органы и ткани, тем самым нарушая их работу (экссудат в плевральной полости, перикарде).
2. Экссудат может сдавливать ткани, обусловливая боль и повреждения (особенно в замкнутых полостях — при артритах, гайморитах, пульпитах и др.).
3. Если происходит потеря экссудата или его удаление при медицинских манипуляциях — это может привести к обезвоживанию и белковому дефициту (при диарее, потере «плазмы» с обожженной кожи, нерациональном пункгировании при плевритах).
4. Резорбция экссудата может сопровождаться интоксикацией.
Скопление в ткани экссудата обусловливает такой внешний местный признак воспаления, как припухлость. Кроме того, наряду с действием брадикинина, гистамина, простагландинов, нейропептидов давление экссудата на окончания чувствительных нервов имеет некоторое значение в возникновении воспалительной боли.
Эмиграция лейкоцитов
Наряду с микроциркуляторными изменениями в очаге воспаления происходят характерные изменения функций ряда клеточных элементов, обусловленные их активацией. Активируются эндотелиоциты, различные популяции лейкоцитов, тромбоциты, клетки соединительной ткани и др. Эти клеточные процессы определяют защитную функцию воспаления.
Для обобщающей характеристики этих процессов приняты термины: эмиграция клеточных элементов, то есть их выход за пределы микрососудов в ткани и пролиферация.
В ходе воспалительной реакции в результате внедрения патогенных возбудителей или повреждения какой-либо другой природы имеет место активация макрофагов.
Это проявляется фагоцитозом и выделением большого количества регуляторных молекул главным образом пептидной природы — цитокинов. Цитокины в свою очередь активируют множество других клеток-мишеней. Цитокины — интерлейкины (ИЛ-1, ИЛ-3, ИЛ-8) и фактор некроза опухолей (ФНО) и др. в очаге воспаления активируют эндотелиоциты и нейтрофилы.
Активация эндотелиоцитов и нейтрофилов под влиянием ИЛ-1 и ФНО проявляется во-первых в появлении на их мембранах особых адгезивных молекул (адгезинов), относящихся к классам селектинов и интегринов. В результате нейтрофилы выходят из кровотока к сосудистой стенке и «прокатывается» по эндотелию, а затем «прилипают» — фиксируются к эндотелиоцитам в местах межэндотелиальных контактов. Потом нейтрофилы формируют псевдоподии, проникающие между эндотелиальными клетками и как бы «переливаясь» в псевдоподии в конце концов выходят за пределы сосудов. «Прокатывание» осуществляется с помощью адгезинов типа селектинов, «прилипание» и прохождение в межэндотелиальные пространства с помощью интегринов.
Неактивированные нейтрофилы и эндотелиоциты взаимодействовать не могут и эмиграция нейтрофилов не происходит.
Наследственный дефект по одному из адгезинов эндотелиоцитов (болезнь неадгезивных лейкоцитов) снижает сопротивляемость организма к инфекционным заболеваниям.
Активация эндотелиоцитов проявляется выделением в кровь нескольких прокоагулянтных факторов и их пролиферацией и при формировании грануляционной ткани.
Состояние активации эндотелиоцитов достигает пика за 4-6 часов после воздействия ИЛ-1 и других активаторов. Исходный уровень активности, в том числе освобождение мембраны от адгезинов, восстанавливается за 24-36 часов, если нет повторных активирующих воздействий.
Мембрана нейтрофила быстро теряет адгезивные молекулы после прохождения нейтрофила через стенку капилляра.
Наряду с адгезивностью, активация нейтрофилов в очаге воспаления проявляется хемотаксисом, фагоцитозом, бактерицидностью и апоптозом — запрограмированной гибелью нейтрофила после его выхода в ткани.
Хемотаксис обусловлен рядом факторов. Это моноцитарный цитокин йнтерлейкин-8 (ИЛ-8), метаболиты арахидоновой кислоты — лейкотриены, активированные компоненты системы комплемента, факторы, продуцируемые базофилами, нейтрофилами, Т-лимфоцитами-эффекторами ГЗТ и мн. др.
Фагоцитоз — важнейший механизм защитного действия воспалительной реакции впервые описанный И.И. Мечниковым.
Бактерицидные механизмы нейтрофила разнообразны. Одним из важнейших является так называемый «респираторный взрыв» — резкое увеличение потребления О2 (в 10-15 раз) и внемитохондриального окисления. Образующиеся при этом свободные радикалы перекиси водорода, супероксидного аниона, гидроксильного радикала, синглетного кислорода повреждают микробы. Особо мощным повреждающим действием обладает система: миелопероксидаза + перекись водорода + галогены.
По современным представлениям, возможно, наиболее важным бактерицидным фактором является радикал NO -.
Хорошо известно бактерицидное действие таких факторов, как лизоцим, катионные белки, лактоферрин. Недавно были изучены пептиды с «антибиотическим» действием, так называемые дефензины.
Экзоцитоз нейтрофилов способствует проявлению их внеклеточной бактерицидности. В результате экзоцитоза, апоптоза выходят также гидролитические лизосомальные ферменты. Это приводит к активации систем ограниченного протеслиза, а также простагландин-тромбоксановой системы и накоплению БАВ . Если ферментов очень много, может происходить расплавление тканевых структур и формирование таких форм гнойного воспаления, как абсцессы и флегмоны.
Преимущественная эмиграция нейтрофилов характерна для начального периода воспаления, они выполняют исключительно важную работу по очистке тканей от патогенных возбудителей и необратимо поврежденных фрагментов самих тканевых структур.
Постепенно начинает преобладать эмиграция моноцитов.Моноцит, покидая сосуд, превращается в экссудативный моноцит-макрофаг, затем в незрелый и зрелый макрофаг. Зрелые макрофаги по структурно-функциональным характеристикам разделяются на фагоцитарные и секреторные макрофаги.
В отличие от нейтрофилов, которые располагаются преимущественно в центре очага воспаления, макрофаги размещаются по периферии, образуя своеобразный вал (предшественник грануляционного вала), отграничивающий очаг воспаления от неповрежденной ткани. Сначала формируется нейтрофильно-макрофагальный вал, затем макрофагальный и наконец, макрофагально-фибробластный вал, который непосредственно трансформируется в грануляционную ткань.
Фагоцитарная активность макрофагов значительно ниже активности нейтрофилов, хотя они, так же как нейтрофилы, осуществляют «респираторный взрыв» и неокислительную бактерицидную активность.
Главной их функцией является отграничение очага воспаления, предотвращение дальнейшей агрессии и создание условий для антигенной стимуляции для Т- иВ-лимфоцитов, тем самым макрофаги участвуют в формировании специфического иммунного ответа на системном уровне.
Выделяя цитокины (ИЛ-1, ФНО, ИЛ-6, ИЛ-8), колониестимулирующие факторы — КСФ и многие другие, макрофаги осуществляют аутокринную (в отношении других макрофагов), паракринную (в отношении других клеток, находящихся в непосредственной близости: эндотелиоцитов, нейтрофилов, лимфоцитов, тромбоцитов и др.) и эндокринную (системную на уровне всего организма) регуляторные функции. Например, ИЛ-1 и ФНО (в несколько меньшей степени) стимулируют тепловой центр — вызывая лихорадку, ИЛ-1 — костный мозг, мобилизуя из костного мозга уже созревшие нейтрофилы в периферическую кровь — эффект в течение 24 часов, ИЛ-1, ИЛ-3, колониестимулирущие факторы усиливают миелопоэз и появление незрелых форм нейтрофилов в крови, ИЛ-1 стимулируют поступление в кровь стрессовых гормонов: кортикотропина и глюкокортикоидов
ПРОЛИФЕРАЦИЯ
Пролиферация — завершающая стадия воспаления — характеризуется увеличением числа стромальных и, как правило, паренхиматозных клеток ,
также образованием межклеточного вещества в очаге воспаления. Эти процессы направлены на регенерацию альтерированных и замещение разрушенных тканевых элементов. Существенное значение на этом этапе воспаления имеют различные БАВ, стимулирующие пролиферацию клеток (митогены).
Пролиферативные
