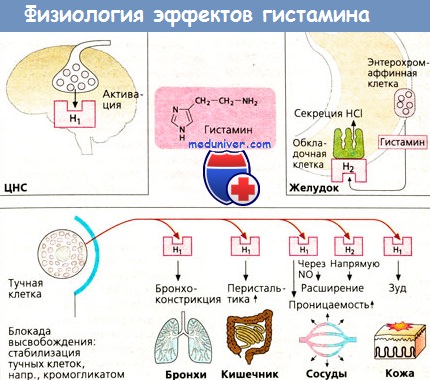
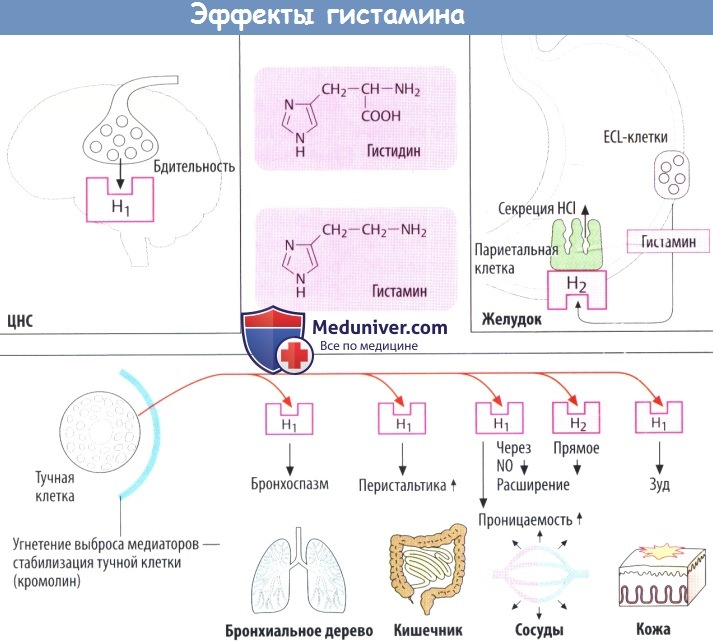
Эффекты гистамина в очаге воспаления
Механизм действия гистамина и его эффекты
а) Функции гистамина. Гистамин служит в качестве нейромедиатора/модулятора в ЦНС, вызывающего среди прочих эффектов состояние бодрствования. В слизистой оболочке желудка он действует как медиатор, который выделяется энтерохромаффиноподобными (ECL) клетками для стимуляции секреции кислоты желудочного сока соседними париетальными клетками.
Гистамин, содержащийся в базофилах крови и тканевых тучных клетках, играет роль медиатора в IgE-опосредованных аллергических реакциях. Гистамин, повышая тонус гладкой мускулатуры бронхов, может спровоцировать приступ бронхиальной астмы. Он стимулирует перистальтику кишечника, о чем свидетельствует появление диареи при пищевой аллергии.
Гистамин увеличивает проницаемость кровеносных сосудов, вызывая образование щелей между эндотелиальными клетками посткапиллярных венул, что позволяет жидкости проходить в окружающие ткани (образование волдырей). Кровеносные сосуды расширяются, т. к. гистамин стимулирует выход NO из эндотелия, а также оказывает прямое релаксирующее действие на сосуды. Стимулируя чувствительные нервные окончания кожи, гистамин может вызывать зуд.
б) Рецепторы. Гистаминовые рецепторы связаны с белками G. Гистаминовые Н1- и Н2-рецепторы служат мишенями для веществ с антагонистическими свойствами. Н3-рецепторы находятся в нервных клетках и могут ингибировать выход разнообразных медиаторов, включая сам гистамин. Позже был обнаружен еще один подтип рецепторов — Н4-рецепторы; они локализуются на определенных клетках воспаления.
в) Метаболизм. Гистаминсодержащие клетки образуют гистамин путем декарбоксилирования аминокислоты гистидина. Выброшенный гистамин разрушается, т. к. для негоотсутствуетсистема обратного захвата, как для норадреналина, дофамина и серотонина.
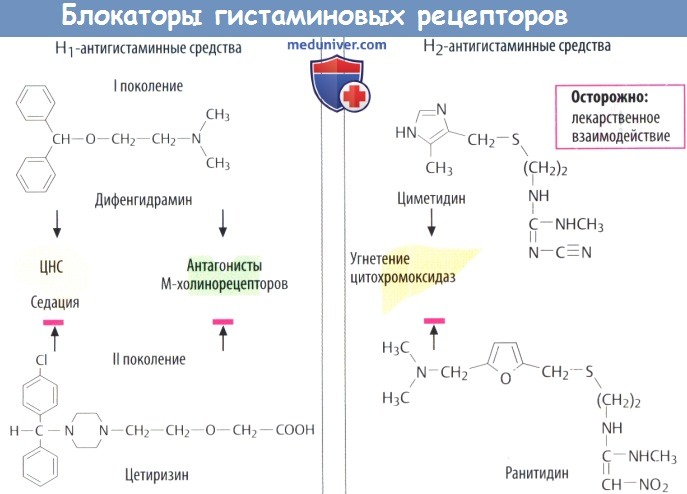
г) Антагонисты. Селективные антагонисты могут блокировать Н1- и Н2-гистаминовые рецепторы.
Н1-антигистаминные средства. Давно открытые вещества этой группы (I поколения) неспецифичны и блокируют другие рецепторы (М-холинорецепторы). Эти средства используют для устранения симптомов аллергии (бамипин, клемастин, диметинден, мебгидролин, фенирамин), в качестве противорвотных (меклизин, дименгидринат) и как седативные снотворные, отпускаемые без рецепта врача.
Прометазин олицетворяет собой переход к психофармакологическим средствам типа нейролептиков из группы фенотиазинов.
Большинство Н1-антигистаминных препаратов вызывает сонливость (ослабляя реакцию при управлении автомобилем) и атропиноподобные реакции (сухость во рту, запор). Более новые вещества (Н1-антигистаминные препараты II поколения) не проникают в ЦНС и поэтому практически не оказывают седативного действия. Предположительно, они переносятся обратно в кровь с помощью Р-гликопротеида находящегося в эндотелии ГЭБ.
Более того, они практически не обладают какой-либо антихолинергической активностью. В эту группу входят цетиризин (рацемат) и его активный энантиомер левоцетиризин, а также лоратадин и его активный метаболит дезлоратадин. Фексофенадин — активный метаболит терфенадина, чрезмерная концентрация в крови которого достигается при слишком медленной биотрансформации (посредством CYP3A4), что может приводить к сердечным аритмиям (удлинение интервала ОТ). Также к этой группе препаратов относятся эбастин и мизоластин.
Н2-блокаторы (циметидин, ранитидин, фамотидин, низатидин) угнетают секрецию кислоты желудочного сока и поэтому подходят для лечения пептических язв. Применение циметидина может сопровождаться межлекарственными взаимодействиями, т. к. он ингибирует печеночную цитохромоксидазу. У последующих поколений (ранитидин) эти побочные эффекты практически отсутствуют.
д) Стабилизаторы тучных клеток. Кромогликат (кромолин) и недокромил уменьшают (по пока еще неизвестному механизму) способность тучных клеток высвобождать гистамин и другие медиаторы в ходе аллергических реакций. Оба препарата применяются местно.

— Также рекомендуем «Механизм действия серотонина и его эффекты»
Оглавление темы «Фармакология лекарств»:
- Парасимпатомиметики — холиномиметики и блокаторы ацетилхолинэстеразы
- Парасимпатолитики — холиноблокаторы и их эффекты
- Механизм действия дофамина и его эффекты
- Механизм действия гистамина и его эффекты
- Механизм действия серотонина и его эффекты
- Механизм действия нейрокинина (вещества Р) и его эффекты
- Механизм действия глутамата, ГАМК и их эффекты
- Лекарства для расширения сосудов
- Механизм действия нитратов и их эффекты
- Механизм действия антагонистов кальция и их эффекты
Роль биологически-активных веществ в патогенезе воспалительного процесса.Тенденция воспалительного процесса, выраженность компенсаторно-приспособительных реакций в значительной степени определяются концентрацией биологически-активных веществ, выделяемых клетками в очаге воспаления и образующихся в значительном количестве в процессе превращений компонентов плазмы. Ключевую роль при этом играют продукты активированных полиморфно-ядерных лейкоцитов, фактор активации тромбоцитов, лейкотриены (С4, В4, Е4), а также вещества плазменного происхождения (продукты активирования калликреин-кининовой системы, компоненты комплемента)» и выделяемые тучными клетками гистамин и серотонин. Существенную роль в патогенезе воспаления играет гистамин, который выделяется тканями при действии на них патогенных факторов, инициирующих воспалительный процесс. Наибольшее количество гистамина обнаружено в тучных клетках и базофильных лейкоцитах, где он содержится в гранулах. В ходе воспалительной реакции активируются процессы высвобождения гистамина из гранул при параллельном увеличении его синтеза. Воздействуя на H1 и Н2-гистаминовые рецепторы, гистамин способен вызвать различные биологические эффекты. Связывание H1 гистаминовых рецепторов с гистамином сопровождается внутриклеточным увеличением концентрации цГМФ. Интенсивность данного процесса в значительной степени возрастает в присутствии ионов кальция. Следовательно, в ходе воспалительных реакций, сопровождаемых ростом кальция в цитозоле, создаются дополнительные условия для высвобождения избыточного количества гистамина.
Основные эффекты гистамина заключаются в сокращении гладких мышц, расширении микрососудов, влиянии на секреторные процессы железистой ткани. Воздействие гистамина на эндотелиальные клетки сопровождается деструктивными изменениями их цитоскелета, что приводит к увеличению проницаемости сосудистой стенки. Активированные гистамином эндотелиоциты обладают повышенной адгезивной способностью по отношению к полиморфноядерным лейкоцитам, что в значительной степени облегчает их миграцию в интерстициальное пространство при воспалении. Полагают, что гистамин оказывает существенное влияние на процессы регуляции кровотока в микроциркуляторном русле, как в обычных условиях, так и при течении воспалительного процесса. Увеличение концентрации этого вещества в очаге воспаления сопровождается расширением сосудов микроциркуляторного русла, что приводит к повышению объемной скорости локального кровотока в ткани и органе в целом. Блокирование гистаминовых рецепторов влечет за собой снижение активности и темпов развития воспалительного процесса. При значительной выраженности первичной и вторичной альтерации, приводящей к нарушениям функций клеточных мембран и сопровождаемой ростом содержания Са в цитозоле, создаются условия для избыточного высвобождения гистамина. Это приводит к увеличению микроциркуляторных расстройств в очаге воспаления, усилению процессов экстравазации жидкости, нарастанию венозного полнокровия ткани, нарушениям метаболических процессов за счет недостаточного поступления кислорода к клеткам, находящимся в зоне очага воспаления. Перечисленные изменения представляют собой патогенетическую цепь перерастания компенсаторно-приспособительных реакций экссудативной стадии воспаления в преимущественно патологические. Характеризуя биологические эффекты гистамина, необходимо отметить, что значительная часть их при воспалении связана с воздействием на гистаминовые рецепторы клеточных мембран лейкоцитов, лимфоцитов и тучных клеток. Увеличение концентрации гистамина в очаге воспаления сопровождается его связыванием с Н2 гистаминовыми рецепторами тканевых базофилов, в результате чего тормозятся процессы дальнейшей дегрануляции гистаминсодержащих клеток. Ингибирование высвобождения гистамина опосредуется через систему цАМФ тканевых базофилов. Таким образом, рост концентрации гистамина в очаге воспаления с одной стороны приводит к увеличению микроциркуляторных расстройств, а с другой стороны, по принципу обратной связи, блокирует процесс его дальнейшего высвобождения. В ходе одновременного взаимодействия гистамина с H1 и Н2-гистаминовыми рецепторами создаются условия для оптимального регулирования сосудистых реакций в очаге воспаления, снижения степени выраженности патологической направленности воспалительного процесса. Связывание гистамина с Н2-гистаминовыми рецепторами лимфоцитов приводит к активированию синтеза цАМФ в их цитозоле и уменьшению темпов развития цитолитических процессов. Воздействуя на Н2-гистаминовые рецепторы, гистамин приводит к ингибированию основных звеньев анафилактической реакции. — Также рекомендуем «Серотонин, большой эозинофильный белок в очаге воспаления.» Оглавление темы «Ключевые механизмы воспаления легких.»: |
Тучные клетки и гистамин. Роль гистамина в воспалении бронхов.Тучные клетки бывают разных видов и от этого зависят морфологические изменения, сопровождающие их дегрануляцию: если в коже тучные клетки выделяют интактные гранулы, которые могут быть фагоцитированы фибробластами, то в легких гранулы тучных клеток растворяются внутриклеточно, и часть мембран гранул вместе с клеточной мембраной формируют каналы, через которые содержимое гранул выделяется наружу. Специфические морфологические, биохимические и функциональные черты тучных клеток диктуются специфическим микроокружением: так, тучные клетки кожи после стимуляции морфином in vitro выделяют медиаторы воспаления, а тучные клетки легких, сердца и желудочно-кишечного тракта — нет. Конечно, гетерогенность тучных клеток выходит далеко за рамки ответа на опиаты. Кроме антигензависимой дегрануляции тучных клеток, связанной с реакцией ГНТ, существует большое количество либераторов гистамина (токсины, ферменты, лекарства, различные макромолекулы и др.), вызывающих дегрануляцию тучных клеток неиммунологическим путем. Гистамин считается своеобразным маркером тучной клетки, но последняя выделяет большое количество медиаторов, среди которых лейкотриены С4, Д4, Е4, простагландин Д гепарин, триптаза, причем не исключается, что гистамин и другие цитокины играют роль в генезе хронического воспаления при БА, выделяясь в небольшом количестве даже в фазе ремиссии. Имеются данные об активации тучноклеточной триптазой латентной коллагеназы, что, в итоге, приводит к повреждению соединительной ткани легких. Не исключено, что различные стимуляторы выделения БАВ, воздействуя на тучные клетки, могут избирательно потенцировать выделение или синтез de novo тех или иных медиаторов: так, местное воздействие на слизистую бронхов аденозинмонофосфата достоверно повышает выделение тучными клетками вторичного медиатора-простагландина Д2, но не первичных медиаторов (гистамина и триптазы).
Выделены разные группы больных атопической БА с одинаково повышенным уровнем гистамина и достоверно отличавшихся по уровню гистаминазы; причем эти группы больных отличались также по клинической картине болезни; больные с более высокой активностью гистаминазы были старше, имели более длительный анамнез заболевания и более тяжелое его течение. Участие гистамина в патологических процессах в легких, как органе-мишени, не всегда сопровождается повышением уровня гистамина в крови. Показано, что в ряде случаев уровень гистамина крови после провокации аллергеном был тем меньше, чем большей была гиперреактивность бронхов. Найдено повышение содержания гистамина в конденсате влаги выдыхаемого воздуха и в мокроте больных БА и хроническим бронхитом. В.А. Гончарова и соавт. считают, что из целого ряда БАВ, выявленных в конденсате влаги выдыхаемого воздуха (серотонин, гистамин, ацетилхолин, катехоламины), у больных БА наиболее информативно повышение уровня гистамина. У больных БА с хроническим бронхитом в ряде случаев продуцентами гистамина могут быть содержащиеся в бронхиальном дереве различные бактерии, а не тучные клетки. Вместе с тем, выделяющийся в легких свободный гистамин ответственен за начало ранней стадии воспаления. У больных БА гистамин не является, возможно, главным медиатором, но все же принимает участие в развитии отека слизистой и бронхоспазма. У некоторых больных гистамин реализует свое действие не только прямым влиянием на бронхи, но также путем усиления генерации фагоцитами активных форм кислорода. Активация тучных клеток может зависеть от тяжести течения БА. Rankin J. et al. не нашли повышения уровня гистамина в содержимом бронхоальвеолярного лаважа у больных легкой БА, в отличие от больных тяжелой БА. Гистамин повышает капиллярную проницаемость, повреждает капиллярную стенку и усиливает деполимеризацию основного вещества соединительной ткани. Получены данные о повышении гистамином посткапиллярного сопротивления на фоне относительно постоянного значения сопротивления артериальной части сосудистого русла, что приводит к росту капиллярного гидростатического давления и усилению процессов фильтрации в легочный интерстиций. Действуя на Н1-рецепторы бронхов гистамин вызывает бронхоконстрикцию, а действие гистамина на Н1-рецепторы сосудов малого круга вызывает их сужение. Повышение давления в системе легочной артерии под влиянием гистамина связано с увеличением проницаемости гладкомышечных клеток для внеклеточного кальция и мобилизации внутриклеточного кальция. Возможно, легочная гипертензия, возникающая при гипоксической гипоксии, опосредуется тучными клетками, выделяющими гистамин. Гистамин модулирует активность многих клеток, принимающих участие в иммунном воспалении, и оказывает влияние на клеточные иммунные реакции. Через Н1-рецепторы реализуется провоспалительный эффект гистамина, а все ингибирующие эффекты гистамина на функцию лимфоцитов и противовоспалительное действие реализуются через Н2-рецепторы, и не исключается, что одновременная стимуляция Н1 и Н2-рецепторов на иммунокомпетентных клетках приводит к развитию супрессорной активности, а дефект Н2-рецепторов при аллергических заболеваниях может иметь генерализованный характер и приводить к повышению функциональной активности Н1-рецепторов, усилению воспалительных реакций и увеличению выхода гистамина из тучных клеток. Высказывается предположение, что в ряде случаев для больных БА повышенный уровень гистамина может иметь положительное значение: благодаря существованию двух функционально противоположных типов гистаминовых рецепторов гистамин через отрицательную обратную связь играет роль ограничителя аллергического воспаления, а патологические изменения, вызванные гистамином, возникают лишь при нарушении гомеостатического механизма регуляции через систему Н1 и Н2-рецепторов, т.е. при сдвиге механизмов контроля. Считается, что у больных аллергическими болезнями, в том числе при БА, гистамининдуцированная супрессия иммунного ответа нарушается из-за уменьшения Н2-позитивных Т-лимфоцитов, вырабатывающих HSF (гистамин-индуцированный фактор супрессии). Несмотря на многообразие действия гистамина и его роль «маркера» тучных клеток, не всегда просто выяснить его значение в патогенезе легочных заболеваний, поскольку в организме гистамин высвобождается при любой травме и находится также вне тучных клеток, являясь постоянной составной частью почти всех органов, тканей, жидких сред и выделений. Помимо тучных клеток, существенную роль в выделении гистамина могут играть базофилы, различающиеся по своей плотности и наличию в них гистамина: несмотря на небольшое содержание в крови, базофилы могут становиться многочисленными в зоне воспаления и играть важную роль в поздней фазе аллергических реакций, а также получены данные о повышенном выходе гистамина из базофилов под действием ФАТ. Существенная роль в генезе различных видов воспаления взаимодействия «тучная клетка — эозинофил» дополняется не менее важной осью «тучная клетка — нейтрофил»: медиаторы тучных клеток влияют на выделение нейтрофилами свободных радикалов кислорода, а активированные нейтрофилы стимулируют выделение гистамина из тучных клеток. Сейчас считается, что тучные клетки играют центральную роль в возникновении бронхообструкции в течение ранней астматической реакции, выделяя гистамин, простагландин Д2, цистеиновые ЛТ, ферменты (триптаза, протеаза), не только вызывающие спазм гладкой мускулатуры бронхов, но также влияющие на сосудистую проницаемость, усиливающие деятельность железистого аппарата бронхов, и разрыхляющие соединительнотканный матрикс. Привлечение различными тучноклеточными медиаторами, такими как ИЛ-3, ИЛ-4, ИЛ-5, нейтрофильный хемотаксический фактор, ФАТ, гранулоцитарно-макрофагальный колониестимулирующий фактор других клеток воспаления, приводит к развитию персистирующей воспалительной реакции в бронхах больных БА, что типично для хронического течения этой болезни, а активация протеазами тучных клеток разных коллагеназ приводит к нарушениям соединительной ткани и способствует не только хронизации воспаления, но и формированию необратимых морфологических изменений. — Также рекомендуем «Эйкозаноиды. Воспаление бронхов и выделение эйкозаноидов.» Оглавление темы «Воспаление бронхов.»: |