Клетки принимающие участие в развитии хронического воспаления
Клетки участвующие в хроническом воспалении — макрофаги и другие клетки
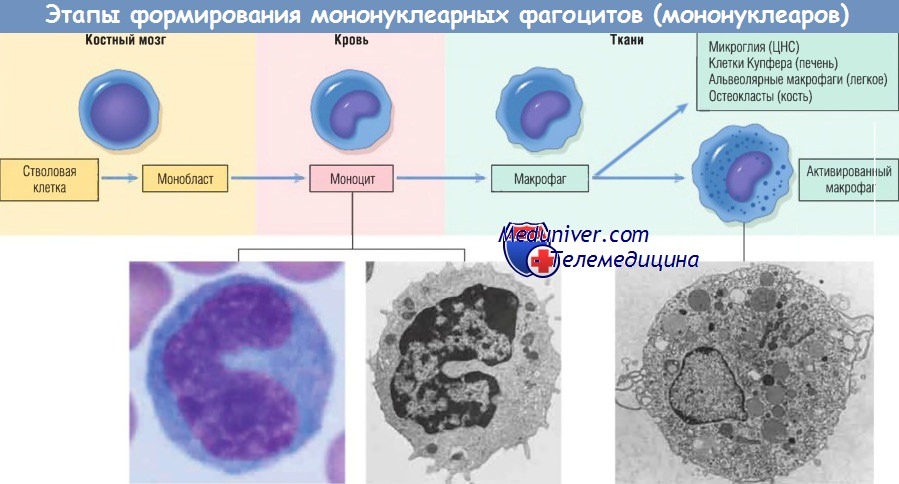
Макрофаг — главная клетка, участвующая в процессе хронического воспаления. Макрофаги являются частью системы мононуклеарных фагоцитов (иногда называемой ретикулоэндотелиальной системой), состоящей из клеток, близкородственных клеткам костного мозга, включая моноциты и тканевые макрофаги.
Тканевые макрофаги диффузно разбросаны по соединительной ткани или расположены в таких органах, как печень (клетки Купфера), селезенка и лимфатические узлы (гистиоциты синусов), легкие (альвеолярные макрофаги), а также в ЦНС (микроглия). Мононуклеарные фагоциты происходят из клеток-предшественников костного мозга, которые дифференцируются в моноциты. Из крови моноциты мигрируют в разные ткани и дифференцируются в макрофаги.
Период полужизни моноцитов длится около 1 дня, когда как период жизни тканевых макрофагов составляет несколько месяцев или лет. Превращение стволовой клетки костного мозга в тканевый макрофаг регулируется различными факторами роста и дифференцировки, цитокинами, молекулами адгезии и клеточными взаимодействиями.
Моноциты начинают мигрировать во внесосудистые ткани на ранних стадиях развития острого воспаления и в течение 48 час могут стать доминирующим типом клеток инфильтрата. Экстравазация моноцитов управляется теми же стимулами, которые участвуют в миграции нейтрофилов и представлены молекулами адгезии и химическими медиаторами с хемотаксическими и активирующими свойствами.
При попадании моноцита во внесосудистую ткань он подвергается трансформации в большую фагоцитарную клетку — макрофаг. Макрофаги активируются различными стимулами, включая микробные продукты, активирующие TLR и другие клеточные рецепторы, цитокины (например, IFN-y), секретированные сенсибилизированными Т-лимфоцитами и естественными клетками-киллерами, и другие химические медиаторы.
В результате активации макрофагов происходят элиминация таких повреждающих агентов, как микробы, и инициация процессов репарации, а также повреждение ткани (при хроническом воспалении).
Активация макрофагов приводит также к повышению уровней лизосомных ферментов и активных форм кислорода и азота, продукции цитокинов, факторов роста и других медиаторов воспаления. Некоторые из этих продуктов токсичны для микробов и организма (например, активные формы кислорода и азота) или ВКМ (протеазы); другие вызывают миграцию клеток (например, цитокины, хемотаксический стимул); третьи влияют на пролиферацию фибробластов, отложение коллагена и ангиогенез (например, факторы роста).
Разные популяции макрофагов выполняют различные функции: некоторые необходимы при киллинге микробов и воспалении, другие очень важны при репарации.
Впечатляющий арсенал медиаторов делает макрофаги мощным союзником организма в защите от непрошеных гостей, но в то же время при неправильной активации макрофаги могут вызывать значительное разрушение ткани, которое является одним из признаков хронического воспаления. Процесс разрушения ткани сам по себе может активировать каскад воспалительной реакции, поэтому одновременно могут присутствовать признаки и острого, и хронического воспаления.
При недолгом процессе воспаления, если стимул удален, макрофаги в итоге либо умирают, либо уходят в лимфатические сосуды и лимфоузлы. При хроническом воспалении происходит накопление макрофагов в результате их мобилизации из кровотока и местной пролиферации в очагах воспаления.
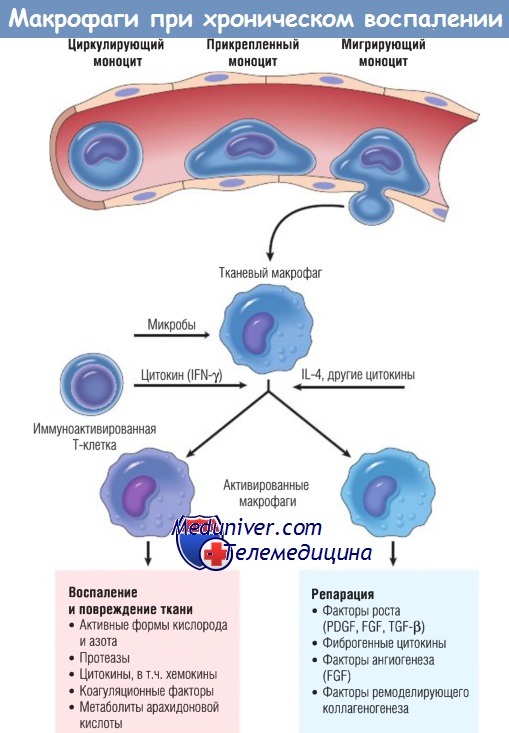
Роль активированных макрофагов при хроническом воспалении.
Макрофаги активируются неиммунными стимулами, например эндотоксином, или цитокинами из иммуноактивированных Т-клеток (особенно IFN-y).
Перечислена продукция активированных макрофагов.
FGF — фактор роста фибробластов; IFN — интерферон; IL — интерлейкин;
PDGF — тромбоцитарный фактор роста; TGF — трансформирующий фактор роста.
В развитии хронического воспаления участвуют и другие типы клеток: лимфоциты, клетки плазмы крови, эозинофилы и тучные клетки:
— лимфоциты мобилизуются в ходе как антителоопосредованных, так и клеточно-опосредованных иммунных реакций. Антиген-стимулированные лимфоциты (эффекторные клетки и клетки памяти) различных типов (Т- и В-клетки) используют разные пары адгезивных молекул (селектинов, интегринов и их лигандов) и хемокины для миграции в очаг воспаления. Цитокины активированных макрофагов, в основном TNF, IL-1 и хемокины, усиливают мобилизацию лейкоцитов, запуская стадию персистенции воспалительной реакции.
Лимфоциты и макрофаги взаимодействуют по реверсивному типу, что играет важную роль в развитии хронического воспаления. Макрофаги презентируют антигены Т-клеткам и продуцируют мембранные молекулы (костимуляторы) и цитокины (например, IL-12), которые стимулируют ответ Т-клеток. Активированные Т-клетки продуцируют цитокины, некоторые из которых мобилизуют моноциты из кровотока, и IFN-y — мощный активатор макрофагов. В результате этих взаимодействий Т-клеток и макрофагов в воспалительную реакцию вовлекается иммунная система, что делает реакцию хронической и тяжелой. Термин «иммунное воспаление» отражает наличие выраженного иммунного компонента в воспалительном процессе, например ответа Т- и В-клеток;
— клетки плазмы крови образуются из активированных В-клеток и продуцируют антитела, направленные либо против персистирующих чужеродных или собственных антигенов в очаге воспаления, либо против компонентов поврежденной ткани. При некоторых сильных воспалительных реакциях скопление лимфоцитов, антигенпрезентирующих клеток и клеток плазмы крови может напоминать морфологическое строение лимфоидного органа, особенно лимфоузла, содержащего хорошо сформированные герминативные центры.
Подобные очаги скопления лимфоцитов называют третичными лимфоидными органами. Такой тип лимфоидного органогенеза часто встречается в синовиальных оболочках у пациентов, длительно страдающих ревматоидным артритом;
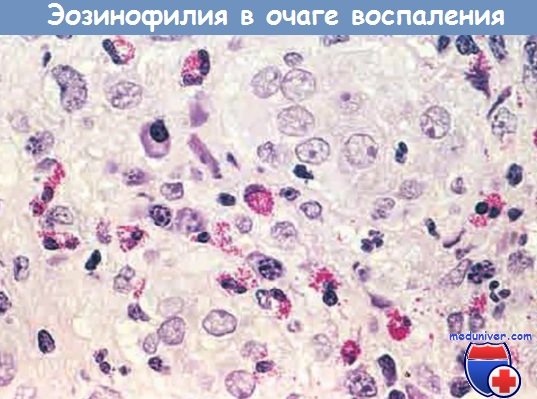
— эозинофилами изобилуют иммунные реакции, опосредованные IgE и паразитарными инфекциями. Особо важный хемокин для мобилизации эозинофилов — эотаксин. Эозинофилы содержат гранулы, имеющие главный основной белок (высокоактивный катионный белок), который токсичен для паразитов, но может вызвать лизис эпителиальных клеток млекопитающих. Таким образом, эозинофилы контролируют паразитарные инфекции, но также участвуют в повреждении ткани при иммунных реакциях, например аллергии;
— тучные клетки широко распространены в соединительных тканях по всему телу и могут участвовать как в острых, так и в хронических воспалительных реакциях. Тучные клетки экспрессируют на своей поверхности рецептор FceRI, связывающийся с Fc-фракцией антитела IgE. При реакции гиперчувствительности немедленного типа антитела IgE связываются с клеточными Fc-peцепторами, специфично распознающими антиген, клетка дегранулируется и высвобождает медиаторы — гистамин и простагландины. Этот тип ответа наблюдается при пищевой аллергии, укусах насекомых, лекарственной аллергии, иногда с ужасающими исходами (например, анафилактическим шоком).
Тучные клетки тоже присутствуют при реакциях хронического воспаления и секретируют множество цитокинов, т.е. они способны как усиливать, так и ограничивать воспалительную реакцию в разных ситуациях.
Как правило, присутствие нейтрофилов характерно для острого воспаления, но и при многих формах хронического воспаления, длящегося месяцами, выявляется большое количество нейтрофилов, индуцированных либо персистирующими микробами, либо медиаторами, продуцированными активированными макрофагами и Т-лимфоцитами. При хронических бактериальных инфекциях костей (остеомиелите) нейтрофильный экссудат может сохраняться многие месяцы. Нейтрофилы также важны при хроническом воспалении в легких, индуцированном курением или другим стимулом.
Помимо мононуклеарного характера клеточного инфильтрата при хроническом воспалении часто происходит пролиферация кровеносных и лимфатических сосудов. Этот процесс стимулируют факторы роста, продуцируемые макрофагами и эндотелиальными клетками.

Очаг воспаления с большим количеством эозинофилов (эозинофилия)
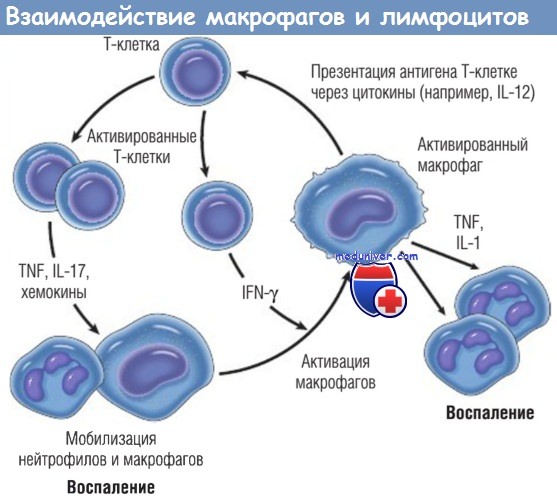
Взаимодействия макрофагов и лимфоцитов при хроническом воспалении.
Активированные Т-клетки продуцируют цитокины, которые мобилизуют макрофаги (TNF, IL-17, хемокины), и IFN-y, который является мощным активатором макрофагов.
Разные типы Т-клеток (Тh1 и Тh17) могут продуцировать различные типы цитокинов.
В свою очередь, активированные макрофаги стимулируют Т-клетки, презентируя им антигены через цитокины (например, IL-12).
IFN — интерферон; IL — интерлейкин; TNF — фактор некроза опухоли.
— Рекомендуем ознакомиться со следующей статьей «Причины и механизмы гранулематозного воспаления. Что такое гранулема?»
Оглавление темы «Патофизиология»:
- Клетки участвующие в хроническом воспалении — макрофаги и другие клетки
- Причины и механизмы гранулематозного воспаления. Что такое гранулема?
- Влияние воспаления на организм в целом (системные симптомы воспаления)
- Варианты воспалительной реакции и ее последствия
- Пути заживления и обновления тканей — репарация, регенерация
- Регуляция деления и пролиферации клеток в тканях
- Виды стволовых клеток и их характеристика
- Эмбриональные стволовые клетки и их характеристика
- Индуцированные плюрипотентные стволовые клетки (ИПСК) и их характеристика
- Где присутствуют стволовые клетки у взрослых?
Воспаление всегда начинается с изменения. Через некоторое время процессы инфильтрации, протеолиза, некроза и синяков уменьшаются или прекращаются, и на первый план выходит регенерация тканей.
Наибольшее повреждение тканей вызывает гнойное воспаление. После эвакуации гноя в тканях остается полость (тканевой дефект), которая постепенно заполняется соединительнотканными элементами – происходит разрастание соединительной ткани.
Разрастанию соединительной ткани в месте воспаления способствует особый материал, присутствующий в повышенных количествах в воспаленных тканях и экссудате, активаторы роста, возникающие в результате процессов изменения, снижение хилона (ингибиторы пролиферации), пролиферация cAMF и слабый ацидоз.
В условиях слабого ацидоза для диссоциации оксигемоглобина на ткани требуется более высокое парциальное давление кислорода, чем обычно – кривая диссоциации Hb02 смещается вправо. Это уже начало следующей фазы – регенерации. Все интенсивно пролиферирующие ткани нуждаются в большом количестве воды, и регенерация соединительной ткани также начинается в гипергидратационных условиях (фаза гипергидратации).
Микрофаги в очаге воспаления постепенно погибают, и начинают преобладать макрофаги. Повышается фагоцитарная активность этих клеток, они фагоцитируют мертвые клетки и другие продукты изменения. В очаге воспаления один тип клеток заменяет другой (микрофаги – макрофаги – фибробласты), каждый из которых выполняет свою функцию, а затем отдает свое место другому типу клеток.
Таким образом, основные изменения соединительной ткани в очаге воспаления – это разрастание макрофагов, фибробластов и гистиоцитов, образование капилляров (2-3 дня) и развитие волокон соединительной ткани (3-6 дней). Дефект ткани постепенно заполняется грануляционной тканью – новой, энергично растущей и богатой сосудами тканью, которая окружает очаг воспаления.
В условиях повышенной активности фагоцитоза, ацидоза, протеолитических и липолитических ферментов уничтожаются микроорганизмы и элементы омертвевшей ткани, ограничивается воспаление, уменьшается экссудация и площадь гиперемии.
После заполнения дефекта ткани кровеносные сосуды и лимфатические сосуды начинают опорожняться (лимфатические сосуды выполняют дренажную функцию для устранения воспалительного отека). Воспалительный отек исчезает, наступает фаза гипогидратации. Происходит регенерация не только соединительной ткани, но и клеток органов и тканей. Однако по мере увеличения числа дифференцированных клеток, интенсивность регенерации снижается.
Если повреждение ткани невелико, регенерация часто бывает полной, тогда как при большом повреждении возникает рубцевание. Клетки высокодифференцированной паренхимы органов (головной мозг, миокард) неспособны к регенерации после травмы. Соединительная ткань часто перерастает в некротическую массу, например, после инфаркта миокарда, плеврита, операций на брюшной полости. Особенно интенсивно разрастается соединительная ткань вокруг инородного тела – вокруг него образуется плотная капсула.
Асептическая рана, края которой соприкасаются, заживает в первую очередь. В этом случае происходит выраженное разрастание макрофагов и интенсивное образование соединительнотканных волокон, которые вместе с эпителиальными клетками замещают фибрин тромба в ране.
Иногда поврежденные клеточные элементы, такие как слизистые оболочки, кожа, способны регенерировать и заполнить дефект определенными тканями, и тогда рана заживает без рубца. Напротив, инфицированные раны, а также асептические раны, если их края не совпадают, заживают вторично, и образуется рубец.
Последствия воспаления
Если регенерация ткани, поврежденной при воспалении, завершена, то функции также полностью восстанавливаются (restitutio ad integrum). Когда определенные ткани заменяются соединительной тканью, функции восстанавливаются только частично (restitutio incpleta). В результате такого воспаления образуется рубец, а функции тканей остаются ограниченными (замещение).
Рубец
Большой рубец часто негативно влияет на организм. По мере сокращения рубцовой ткани развивается значительная дисфункция органа или конечности. Спайки и рубцы, например, в брюшной полости после перитонита или хирургического вмешательства, стеноз пищевода и желудка после ожога кислотой или щелочью, деформируют органы и нарушают их функцию. Распространены нарушения движений конечностей из-за воспаления нервов, сухожилий и суставов. Также в паренхиматозных органах (легких, печени, поджелудочной железе, почках) часто возникают тяжелые функциональные нарушения после воспаления.
Процессы изменения, которые убивают высокодифференцированные клетки жизненно важных органов, могут угрожать существованию организма. Очень опасны рубцы, например, после воспаления сердечных клапанов или мозговых оболочек.
Биологическое значение воспаления в организме
Уже И. Мечников доказал, что воспаление, усложняющееся в ходе эволюции, является одним из неспецифических механизмов защиты всех организмов от действия патогенного агента. Даже сегодня воспаление считается типичным патологическим процессом, при котором компоненты повреждения и защиты связаны в неразрывное целое, а также во взаимной борьбе.
Вредные для организма процессы – это ухудшение функции и интоксикация, когда нарушаются функции воспаленного органа (ткани). Например, при воспалении сустава движения в нем болезненны и ограничены или даже невозможны.
Воспаление как защитная реакция организма проявляется по-разному. Уже во время смены высвобождаются биологически активные вещества, которые участвуют в сосудистых реакциях и процессах пролиферации. Спазм сосудов предотвращает дальнейшее распространение инфекционного агента в организме. В условиях венозной гиперемии уменьшается кровоток и лимфоток, поэтому токсические и пирогенные вещества дольше задерживаются в очаге воспаления.
Также важен для защиты воспалительный экссудат.
- Из-за кислой среды экссудат является бактерицидным. Его белки связывают бактериальные токсины.
- Экссудат разжижает и ферментативно расщепляет, препятствуя абсорбции и дальнейшему распространению токсинов в организме.
- Экссудат используется для доставки антител к специфическим антигенам в месте воспаления.
Особое значение имеет фагоцитарная и пролиферативная функция клеток соединительной ткани. Грануляционная ткань, образующаяся в процессе пролиферации, и соединительнотканный барьер изолируют воспаление от окружающих тканей. Благодаря этим защитным механизмам подопытному животному можно вводить токсины в очаге воспаления, но заметной реакции организма не происходит. С другой стороны, в здоровых тканях токсины вызывают у животного значительную реакцию или даже гибель.
Грануляционная ткань
Как и другие типичные патологические процессы в организме, защитная функция воспаления не безгранична. Если действие вредного агента сильное, защитные реакции могут стать ненормальными, вредными для организма. Например, тяжелый фурункулез, разлитой гнойный перитонит, септическое состояние и т. д. нельзя считать положительной защитной реакцией.
Способность реагировать на действие болезнетворных агентов воспалением – очень важный типичный патологический процесс в организме, нарушение которого может иметь опасные последствия. Эти нарушения могут быть связаны с уменьшением количества нейтрофилов (нейтропения) и проблемами с их функцией.
В свою очередь, наиболее частыми причинами тяжелой нейтропении являются лекарственный агранулоцитоз и лейкоз. В редких случаях возникает так называемая циклическая (периодическая) нейтропения, когда каждые 21 день наблюдается значительное снижение количества нейтрофилов. Эта нейтропения чаще встречается у пациентов с инфекционными кожными заболеваниями, отитом и артритом.
Дисфункция лейкоцитов может включать хемотаксис, эмиграцию и фагоцитоз. Например, нарушения хемотаксиса и эмиграции лейкоцитов возникают при диабете, пародонтите, терапии кортикостероидами и других.
Также описаны многие наследственные дефекты фагоцитарной системы. Некоторые дефекты – это нарушения бактерицидной активности фагоцитов, другие – нарушения подвижности фагоцитов.
- К первой группе относится хронический гранулематоз у детей, в основе которого лежит снижение активности НАДН2-зависимой оксидазы. В результате в клетке не образуется H 2 O 2 и не повреждается мембрана фагоцитирующего объекта. Процесс фагоцитоза не завершается, и из гистиоцитов развиваются гранулемы (чаще всего в легких). Гранулемы разрушаются, лейкоциты и микроорганизмы оставляют очаги воспаления, развивается сепсис.
- Вторая группа наследственных дефектов включает синдром Чедиака-Хигаси. Признаки включают лейкоцитарные аномалии и нарушения пигментации кожи, склонность к рецидивам, гнойные инфекции, анемию, лейкоцитопению, тромбоцитопению и т. д.
Воспаление развивается плохо из-за нарушения фагоцитоза. Снижается сопротивляемость организма инфекции, и ухудшается состояние больного. Например, в случае пониженной реактивности смертность больных пневмонией намного выше.
Принципы противовоспалительной терапии
Поскольку воспаление и часто связанная с ним лихорадка являются защитными, с ними не всегда нужно бороться. Иногда эти типичные патологические процессы изолируют возбудителя болезни, иногда – благотворно влияют на течение некоторых хронических заболеваний. Однако при многих острых воспалительных заболеваниях (фурункулез, тромбофлебит, острый аппендицит, острый панкреатит и т. д.) Необходимо бороться с воспалением, чтобы избежать опасных для организма осложнений.
Воспалительная терапия бывает этиологической и патогенетической.
- Цель этиологической терапии – устранить биологический агент воспаления (антибиотики, противотуберкулезные препараты, терапевтические сыворотки и т. д.) Или подавить действие аллергена.
- Задача патогенетического лечения – предотвратить или полностью заблокировать один из этапов воспалительного патогенеза.
Например:
- Противовоспалительные препараты (салицилаты, глюкокортикоиды) стабилизируют лизосомальную мембрану, снижают активность ферментов (трансаминаз, дегидрогеназ, эстераз, протеаз) и тем самым уменьшают образование биологически активных веществ.
- Индометацин подавляет синтез простагландинов. Гиперосмолярные растворы (как местные, так и внутривенные) используются для уменьшения воспалительного отека.
- Глюкокортикоиды подавляют фагоцитоз, пролиферацию клеток и иммунологические процессы. В результате течение воспаления ослабевает и замедляется. Эти препараты широко используются при лечении аллергических воспалений.
Противовоспалительная терапия
Чтобы создать наиболее благоприятные условия для развития воспаления как защитного процесса организма, воспаленным тканям нужен покой. В случае острого воспаления механические движения могут помешать локализации воспаления и способствовать распространению инфекции.
В лечении воспалений играют роль различные тепловые процедуры: они улучшают кровообращение и циркуляцию лимфы в воспаленных тканях и стимулируют экссудацию, тем самым усиливая и ускоряя воспалительные процессы. Холод снижает интенсивность этих процессов.
Основная задача хирургических методов лечения – удаление внутренних ограниченных инфекционных очагов воспаления (флегмонозный отросток, желчный пузырь), а также вскрытие и дренирование гнойной полости (абсцесс, флегмона).
В современной медицине, в том числе при лечении воспалений, успешно применяются каликреин и препараты ингибиторов каликреина.
Ингибиторы протеаз, обладающие широким спектром действия, участвуют в регуляции хининов и фибринолитической системы. Эти ингибиторы играют защитную роль при различных заболеваниях, включая панкреатит. Они препятствуют образованию калькреина и прогрессированию воспаления. Многие ингибиторы каликреина содержатся в бычьей печени, слюнных железах, поджелудочной железе. Препараты-ингибиторы (трасилол, калол, контральтик) используются при лечении острого панкреатита.
Препараты каликреина (падутин, депокаликреин, дилминал D, ангиотропин) расширяют кровеносные сосуды и играют важную роль в лечении облитерирующего эндартериита.
В период разрастания соединительной ткани для борьбы с негативными последствиями рубцевания, особенно контрактур, движения следует выполнять постепенно, увеличивая их амплитуду до максимума.
Продолжение статьи
- Часть 1. Этиология и патогенез воспаления. Классификация.
- Часть 2. Особенности обмена веществ при воспалении.
- Часть 3. Физико – химические изменения. Роль нервной и эндокринной систем в развитии воспаления.
- Часть 4. Изменения в периферическом кровообращении при воспалении.
- Часть 5. Экссудация. Экссудат и транссудат.
- Часть 6. Эмиграция лейкоцитов. Хемотаксис.
- Часть 7. Фагоцитоз. Асептическое и острое воспаление.
- Часть 8. Распространение. Последствия. Принципы лечения воспаления.
