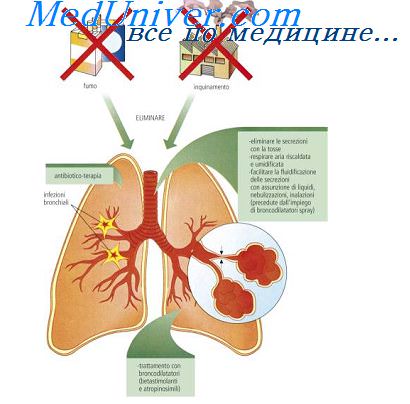
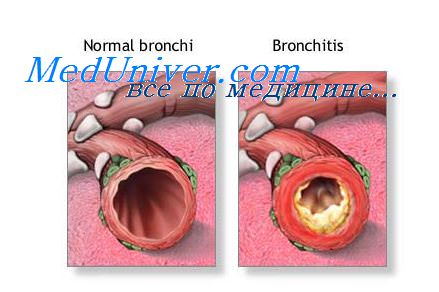
Клеточная реакция при воспалении

Клеточные механизмы защитных реакций организма при воспалении.Основные закономерности развития необратимых патологических изменений в клетках при первичной и вторичной альтерации Рассматривая воспаление как типовой патологический процесс, протекающий в виде последовательно сменяющих друг друга, а в ряде случаев развивающихся параллельно стадий альтерации, экссудации и пролиферации, необходимо отметить, что при определенных условиях течение воспалительных реакций может иметь как преимущественно защитно-приспособительный, так и разрушительный характер. Воздействие на ткани различных по своей природе факторов (химических, физических, бактериальных), как правило, приводит к развитию первичной альтерации. Степень выраженности и распространенность альтеративных изменений определяется интенсивностью действующего фактора, устойчивостью клеток к этому воздействию и способностью клеточных механизмов компенсировать патологические изменения. Повреждение ткани сопровождается выделением биологически активных веществ, способных еще в большей степени увеличивать альтеративные процессы — вызывать вторичную альтерацию. Независимо от особенностей воздействующего фактора, индуцирующего воспалительный процесс, все изменения в клетках можно свести к следующим типам:
Деструктивные процессы в тканях, возникающие в альтернативной стадии (фазе) воспаления, имеют преимущественно патологический характер. Их выраженностью в значительной степени определяется возможная степень неблагоприятного течения воспалительного процесса в целом. При обратимых сублетальных изменениях клетка способна адаптироваться и восстанавливать свою структуру и функцию. В этом случае, как правило, происходит снижение интенсивности метаболических процессов, ограничение потребления кислорода, угнетение процессов окислительного фосфорилирования, активирование гликолиза, уменьшение запасов макроэргических фосфорных соединений, падение уровня активности K-Na-АТФ-азы, ингибирование внутриклеточных ферментов, активирующих анаболические процессы. В процессе необратимого повреждения клетки наблюдается постепенное увеличение объема внутриклеточных структур (расширение эндоплазматической сети, набухание митохондрий, увеличение объема лизосом). Летальные изменения в клетках сопровождаются повреждением наружной и внутриклеточных мембран, в результате чего повышается их пассивная проницаемость для ионов. Одним из кардинальных признаков повреждения клетки является увеличение содержания натрия в цитозоле и выход во внеклеточную среду калия. Тяжелые метаболические расстройства клеточных функций сопровождаются увеличением содержания кальция в цитозоле. В нормальных условиях в цитоплазме регистрируется низкая концентрация кальция, не превышающая 10″‘ моль/л, которая обеспечивается непрерывной работой Са-АТФаз. Основные запасы кальция содержатся в эндоплазматическом ретикулуме, большая часть мембраны которого плотно покрыта белком с молекулярной массой 110 кДа, являющегося Са-насосом. Концентрация кальция в эндоплазматическом ретикулуме в 10 000-100 000 раз выше чем в цитозоле. Деполяризация клеточной мембраны и гидролиз мембранных липидов сопровождаются раскрытием кальциевых каналов, по которым кальций из внутриклеточных депо (цистерн эндоплазматического ретикулума, митохондрий) или интерстициального пространства устремляется в цитозоль. Возникающие в ходе воспаления метаболические нарушения энергообеспечения работы транспортных систем клеток изменяют нормальное протекание процессов реабсорбции кальция, который устремляется из кальцийсодержащих структур и внеклеточной среды в цитозоль по механизмам пассивного транспорта. — Также рекомендуем «Изменения клеток при альтеративной стадии воспаления.» Оглавление темы «Ключевые механизмы воспаления легких.»: |
Воспаление (лат. inflammatio) – это сложный процесс реакции организма на внешний или внутренний повреждающий (болезненный) фактор. Воспаление направлено на устранение этого фактора, восстановление поврежденных тканей и защиту от развития заболеваний.
Таким образом, воспаление выполняет защитную функцию в организме, но только тогда, когда оно острое. Хроническое воспаление перестает быть физиологическим фактором и становится патогеном, ведущим к аутоиммунным заболеваниям и раку.
Воспаление – это естественный процесс, который происходит на определенных этапах. Без воспалительной реакции, которая активирует иммунную систему для борьбы с патогеном, например, вирусом, бактериями, травмированными участками, мы не смогли бы пережить даже самую маленькую инфекцию.
Сложность воспалительного процесса отражается в часто используемых терминах – состояние, процесс или воспалительная реакция.
Симптомы воспаления
Симптомы острого воспаления были впервые описаны римским ученым и энциклопедистом Аврелием Цельсом (25 г. до н.э. – 50 г. н.э.). в единственной работе «Медицина», которая сохранилась до наших дней, он описал четыре основных симптома острого воспаления, которые иногда называют тетрадой Цельса:
- боль (лат. dolor);
- повышенная температура (лат. calor);
- покраснение (лат. rubor);
- отек (лат. tumor).
Пятый признак воспаления – потеря функции и повреждение органов (лат. Functiolaesa) был добавлен немного позже, возможно, греческим врачом и философом Галеном (129-200 н.э).
Покраснение кожи является результатом увеличения кровотока в области, пораженной патогенными микроорганизмами, отек – это результат проникновения белка и клеток из сосудов в ткани – все это вызывает боль. Температура также является следствием увеличения кровотока. В свою очередь, «потеря функции» означает, что орган не функционирует должным образом.
В развитии воспалительной реакции участвуют многие физиологические механизмы, связанные как с клетками – гранулоцитами, моноцитами, тромбоцитами, лимфоцитами Т и В, тучными клетками, эндотелиальными клетками кровеносных сосудов, макрофагами, фибробластами, так и с веществами, выделяемыми ими – медиаторами воспаления. Со временем могут быть поражены целые органы и могут возникнуть системные симптомы – повышение температуры тела, потеря веса, мышечная атрофия, чувство общей слабости.
Воспаление при ларингите
Как возникает воспаление?
Чаще всего повреждающий фактор, который инициирует воспалительный процесс, приходит извне. Это может быть:
- физическое повреждение – химическое, тепло или холод, механическая травма;
- биологический агент – бактерии, вирус, чужеродный белок.
Также бывает, что причиной воспаления является процесс, происходящий внутри организма – эмболия артерии, сердечный приступ или развитие рака.
Изменения в кровеносных сосудах всегда являются корнем воспалительной реакции. Сосуды расширяются, и их проницаемость увеличивается. Это приводит к проникновению медиаторов и воспалительных клеток в окружающие ткани.
Составляющие воспаления
Острое воспаление выполняет важную защитную функцию – оно удаляет возбудителя и восстанавливает нормальную функцию органа. Переход острой фазы в хроническую фазу часто связан с потерей контроля организма над воспалительными механизмами и, следовательно, с функциональными нарушениями и даже повреждением пораженной ткани. Этот процесс можно сравнить с превращением острой боли (защитной функции) в хроническую боль, которая становится самой болезнью.
Патогенез воспалительного процесса
Воспалительная реакция неразрывно связана с иммунным ответом. Начинается с контакта патогена со специализированными клетками иммунной системы, так называемыми антигенпрезентирующие клетки. Когда клетки стимулируются, они продуцируют и высвобождают медиаторы воспаления, которые имеют решающее значение для инициации и поддержания воспалительного процесса.
Медиаторы оказывают про-и противовоспалительное действие на клетки-мишени, модулируя течение воспаления. Со временем адаптивная иммунная система (специфическая реакция) также участвует в борьбе с повреждающим фактором. Работа этой системы чрезвычайно точна – взаимодействие лимфоцитов Т и В приводит к выработке специфических антител, которые селективно нейтрализуют возбудителя.
Правильно функционирующая иммунная система эффективно распознает патогены и эффективно уничтожает их, не повреждая свои собственные клетки и ткани. Однако в определенных ситуациях иммунорегуляторные механизмы могут работать с дефектом – возникает воспалительная реакция на аутоантигены.
Это состояние встречается при многих аутоиммунных заболеваниях (диабет 1 типа, ревматоидный артрит, красная волчанка, целиакия, болезнь Хашимото).
Поделиться ссылкой:
Своеобразие вирусного воспаления на клеточном уровне.Особенности вирусного воспаления на клеточном уровне, также как и на субклеточном, обусловлены морфологическими и функциональными особенностями вирусных частиц. Аналогично воспалению, обусловленному другими инфекционными агентами, возможно развитие двух основных форм воспаления: острого и хронического. Принципиальная схема острого воспаления также сходна: повреждение клеток — выход гидролитических ферментов — нарушение проницаемости сосудистой стенки эндотелия и его базальной мембраны под влиянием продуктов деградации тучных клеток и активированных фагоцитов — диапедез форменных элементов крови и появление экссудата. И все-таки существуют принципиальные различия. Бактерии, за редким исключением (гонококки, менингококки), воздействуют на клетки-мишени извне с помощью различных ферментов и токсинов, которые нередко ведут к полному расплавлению наружнрой мембраны. Вирусы осуществляют процесс воспаления как снаружи, так и изнутри клетки. Основой защитной воспалительной реакции при бактериальной инфекции служат нейтрофилы, заглатывающие и переваривающие их, а также выделяющие ряд высокоактивных веществ. При этом возникает целый ряд кислородозависимых и кислородонезависимых защитных реакций, продукты которых (супероксид О2, Н202, ОН и др.) обладают мощным бактерицидным действием и в то же время способны повреждать собственные клетки хозяина. Кроме того, полиморфноядерные лейкоциты (ПМЛ) выделяют лизосомальные гидролазы, катепсины и эластазу, которая отслаивает эндотелиоциты от базальной мембраны. Биоокислители (02, Н202) разрушают ингибиторы протеаз и провоцируют образование медиаторов проницаемости, которые, наряду с системой комплемента, способствуют фокусированию нейтрофилов в очаге воспаления. Значительные скопления ПМЛ в сочетании с тромбоцитами способствуют не только повышению проницаемости стенок сосудов, но и их разрушению, что, чаще всего, имеет место при аллергических процессах в легких, бронхиальной астме, острых сливных пневмониях и респираторном дистресс-синдроме. Сравнительно недавно участие нейтрофилов в развитии воспалительного процесса при респираторных вирусных инфекциях практически отрицалось. Полагали, что это исключительная прерогатива бактерий. Тем не менее, в последние годы представлены убедительные данные о значительном вкладе нейтрофилов в процессы образования активных форм кислорода (АФК) при гриппе. Доказано, что одним из основных механизмов воспалительного процесса при гриппе является образование свободных радикалов кислорода. С генерированием этих форм связаны мутагенез, протеолитическая активация вируса гриппа, цитопатический эффект вирусной инфекции, деструкция капиллярной сети и стенок капилляров, развитие сливных пневмоний с отеком легких. Установлено также, что липидная пероксидация (ЛП), активируемая вирусом гриппа в клетках легкого, является одним из узловых метаболических процессов наряду с генерацией АФК. Именно эти процессы определяют тяжесть и распространенность воспалительной реакции. При резкой активации АФК и ЛП ферментная защита от них в виде супероксиддисмутазы (СОД), каталазы, глютатион-пероксидазы и аскорбиновой кислоты становится недостаточной. Преимущественная генерация при гриппе гипохлорида, который является мощным неспецифическим окислителем, способным окислять не только липиды, но и белки, безусловно, требует переоценки стратегии антиоксидантной терапии при гриппе, с подключением не только токоферола, ионола, но и более эффективной супероксиддисмутазы.
Несмотря на явное участие нейтрофилов в развитии воспаления при вирусных инфекциях, по мнению многочисленных авторов, основой фагоцитарной защитной реакции при вирусной инвазии являются моноциты и их зрелые формы — макрофаги. В чем сходство и отличие фагоцитоза, осуществляемого нейтрофилами и макрофагами? Сходство в наличии ряда аналогичных по функциональной направленности этапов при взаимодействии с чужеродными агентами: хемотаксис, активация, выброс активных веществ, адсорбция, захват, переваривание. Однако много принципиальных отличий. В противоположность нейтрофилам макрофаги — долгоживущие клетки и рассеяны по всему организму, они входят в состав соединительной ткани, содержатся в базальной мембране кровеносных сосудов. Соответствующую фокусировку макрофагов можно обнаружить как в ткани, так и в полостях и экссудатах. При хронической бронхолегочной патологии альвеолярные макрофаги нередко содержат вирусные антигены. Набор выделяемых активированным макрофагом веществ значительно больше и многообразнее, чем у ПМЛ. Соответственно этому спектр выбрасываемых активных веществ при вирусном воспалении значительно шире. К числу секретируемых им веществ следует отнести гидролазные ферменты (лизоцим, кислые гидролазы, нейтральные протеазы, липазы), ингибиторы протеолитических ферментов, факторы, меняющие клеточную пролиферацию и функцию (интерлейкин 1, фактор созревания тимоцитов, ангиогенный фактор, интерферон и фибронектин), производные липидов (простагландины, лейкотриены, фактор активации тромбоцитов), факторы, меняющие процесс свертывания крови (тромбопластин, активатор плазминогена), вирусоцидные агенты (супероксид — радикал О2, Н202, интерфероны), компоненты комплемента и их ингибиторы. Обилие секретируемых макрофагами веществ определяет и большую сложность и многообразие их функций. Активные МФ из очага воспаления участвуют во всех процессах по обеспечению гомеостаза, являясь главными его эффекторами. В отличие от нейтрофилов макрофаги способны фагоцитировать крупные, более 1 мкм объекты, именно они поглощают фрагменты клеток с содержащимися в них вирусами. В силу многообразия секретируемых веществ и выполняемых функций макрофаг активно вступает в контакт с другими клетками, осуществляющими более высокий уровень клеточной защиты организма. Именно макрофаг представляет Т-хелперам вирусный антиген, который находится на поверхности МФ в комплексе с клеточными маркерами главного комплекса гистосовместимости. Макрофаги запускают и регулируют деятельность всех видов лимфоцитов (В, Т с хелперной и супрессорной активностью). Под влиянием активированных МФ Т-лимфоциты продуцируют разнообразные растворимые факторы — лимфокины, которые, в свою очередь, оказывают активирующее воздействие на макрофаги. Макрофаги в значительно большей степени участвуют в развитии наиболее сложных и актуальных в настоящее время хронических форм воспаления. Причин для возникновения хронического воспаления при активации макрофагов значительно больше в силу их более длительного жизненного цикла, полифункциональности и значительной связи с элементами, контролирующими клеточный иммунитет, который при вирусных инфекциях, в отличие от бактериальных, имеет доминирующее значение. Функциональная недостаточность МФ, в том числе альвеолярных, нередко возникает именно под влиянием респираторных вирусов, встраивающихся в мембрану макрофага, повреждающих их рецепторный аппарат и внутренние структуры. Известно также, что для вирусов характерен незавершенный механизм фагоцитоза, при котором сами фагоциты способствуют диссеминации вирусного агента на значительные расстояния от первичного очага воспаления. — Также рекомендуем «Фагоцитоз при вирусной инфекции. Хроническое вирусное воспаление.» Оглавление темы «Воспаление в легких.»: |
Расстройства микроциркуляции и повышение сосудистой проницаемости обусловливают не только экссудацию, но и лежат в основе лейкоцитарной инфильтрации очага воспаления, которая порой достигает 50% суточной продукции фагоцитов. Процесс инфильтрации очага лейкоцитами проходит в три этапа: маргинация (принятие околостеночного положения) лейкоцитов; движение лейкоцитов через стенку сосудов; движение лейкоцитов к очагу (рис. 2.4). Эти процессы индуцируются медиаторами воспаления, резко увеличивающими экспрессию на фагоцитах ряда антигенов (Мас-1 и р150, 95), существенно повышающих адгезию клеток к эндотелию, друг к другу и их спонтанную миграцию в воспалительный очаг. Первые два этапа проходят на фоне замедления кровотока и перехода артериальной гиперемии в венозную, третий — в фазу стаза. Механизм маргинации лейкоцитов в венулах объясняется их приклеиванием к эндотелию при повреждении фибринового слоя, сопровождающемся нарастанием клейкости, изменением электростатического заряда и уменьшением электростатического отталкивания. Не исключено, что лейкоциты пассивно фиксируются в межэндотелиальных щелях — ловушках, а возможно, перемещаются в токе жидкости в ходе экссудации или даже фиксируются посредством взаимодействия суперсемейства RGD-рецепторов с соответствующими гликопротеидными лигандами эндотелиоцитарной поверхности. Из главных медиаторов воспаления, усиливающих маргинацию (и последующую эмиграцию) лейкоцитов следует назвать большой фрагмент фактора В альтернативного пути активации комплемента (Вв) и фибронектин. Первый из них секретируется макрофагами, имеется на их поверхности и, обладая активностью серинэстеразы, опосредует прикрепление лейкоцитов к эндотелию. Второй — тоже вырабатывается макрофагами, секретирующими его в плазму. При повреждении ткани фибронектин связывается с коллагеном и фибрином и вызывает фиксацию макрофагов, имеющих на мембране фиб-ронектиновый рецептор. Лейкоциты мигрируют через межэндотелиальные щели, лимфоциты — способом эмпериолеза, то есть непосредственно через эндо-телиальные клетки, не повреждая их. Выход лейкоцитов из сосудов является энергоемким процессом и контролируется хемотаксическими факторами. Преодоление базаль-ной мембраны опосредуется действием лизосомальных ферментов (коллагеназы, эластазы). Движение лейкоцитов к огагу воспаления (хемотаксис) обеспечивается градиентом концентраций хемоаттрактантов. Свойствами хемоаттрактантов обладают: микроорганизмы и их продукты; компоненты сторожевой системы плазмы; продукты повреждения и метаболизма клеток, например, тучных, продукты дегенерации коллагена; фибронектин; опиоидные пептиды. Действие хемоаттрактантов может быть общим или избирательным в отношении тех или иных клеток. Гранулоциты выделяют хемоаттрактанты для мононуклеаров. Миграция лимфоцитов контролируется монокинами, в частности, макрофагальным интерлейки-ном-1. Лимфоциты способны обеспечить клеточно-специфическую хемоаттрактивную стимуляцию различными лимфокинами. Механизм хемотаксиса предопределен наличием поверхностных рецепторов к хемоаттрактантам. Градиент хемоаттрактанта обнаруживается пространственным механизмом, сравнивающим в одно и то же время концентрацию хемоаттрактанта в двух или более участках клеточной поверхности. Рецепторы концентрируются на одном из полюсов клетки в виде кластера скопления, и полюс, обращенный в сторону нарастания концентрации, становится ведущим. Направление движения лейкоцита обеспечивается микрофиламен-тами и микротрубочками цитоскелета. Сопряжение функций цито-скелета и рецепции достигается с участием Са++ и кальций связывающего белка гельзолина. Чем выше концентрация кальция, тем активнее гельзолин ассоциирует в кортикальном слое цитоплазмы лейкоцита с актином, способствуя образованию актином и актин-связывающими белками гелеподобной структуры. При снижении концентрации кальция в данном отсеке кортикальной зоны цитоплазмы гельзолин выходит из комплекса с актином, и сокращение заканчивается. В зоне максимальной концентрации внутриклеточного Са ++ на ведущем полюсе при этом оказывается соседний участок эндоплазмы, где, в свою очередь, происходит образование актин-гельзо-линового комплекса. Фагоцит как бы вращается вокруг зоны жела-тинизации эктоплазмы. Так как рецепторы к различным хемоаттрактантам неодинаково представлены на поверхности разных лейкоцитов, течение лейкоцитарной инфильтрации характеризуется стадийностью. Аккумуляция нейтрофилов в очаге воспаления достигает пика через 2—4 часа от начала воспаления. Следует отметить, что местным изменениям предшествуют и сопутствуют реакции всех подотделов системы крови. В частности, имеют место двухфазная активация костномозгового грануло-моно-цитопоэза и изменения характера лейкоцитоза. Эти изменения по механизмам возникновения и проявлениям (вначале — ранний перераспределительный лейкоцитоз, затем — активация костно-мозгового миелопоэза) близки к таковым при стрессорных воздействиях, но выражены в большей степени. В этих процессах определенную роль играют глюкокортикоиды. Кроме того, активированные продуктами распада клеток нейтрофилы очага воспаления способны вырабатывать колониестимулирующий фактор и гранулоцитарный антикейлон, действующие на клетки митотического пула костного мозга. Накопление лейкоцитов в очаге воспаления требует торможения их миграции. Многие медиаторы воспаления обладают такими свойствами. Так, фактор, активирующий макрофаги (лимфокин), является одновременно фактором, ингибирующим их миграцию. Сходной активностью обладает Вв фрагмент комплемента, стимулятор краевого стояния лейкоцитов и другие. В крови лейкоциты находятся в неактивированном состоянии, их активация происходит в очаге воспаления (рис. 2.5—2.8). Поступившие в очаг воспаления лейкоциты принимают участие в фагоцитозе — опознании и транспорте в клетку внеклеточного материала. В ходе фагоцитоза реализуется не только бактерицидный эффект, но и экзоцитоз и процессы, обеспечивающие как кооперацию клеток в иммунном ответе, так и взаимодействие медиаторов иммунитета с нейроэндокринной системой. В самом процессе фагоцитоза можно проследить четыре стадии: приближение к фагоцитируемому объекту; контакт, распознавание и прилипание к объекту; поглощение объекта; переваривание. Главным механизмом приближения является хемотаксис. Во второй стадии действует несколько механизмов. Первый из них — опсонизация — покрытие объекта фагоцитоза сывороточными факторами (антителами нормальных и иммунных сывороток). Иммуноглобулины М, G и Е метят объекты фагоцитоза. Роль метки они выполняют либо сами, либо с участием компонентов комплемента. Прилипание осуществляется посредством связи опсонинов со специфическими поверхностными рецепторами фагоцитов: для Fc-фрагмента иммуноглобулинов, для компонентов комплемента (СЗ). Причем имеет место комодуляция рецепторов: в условиях блокады Fc-рецепторов (избыточное количество иммунных комплексов или агрегированного IgG) макрофаг начинает вырабатывать фактор, индуцирующий продукцию Т-клетками лимфокина, который активирует фагоцитоз, опосредованный СЗ-рецепторами. Второй механизм — инициация сигнала для поглощения частицы. Сигналом для поглощения объекта и последующих метаболических изменений может быть освобождение под влиянием макрофагаль-ной лейкопептидазы из состава молекулы IgG тетрапептидов тафцина и ригина. Тафцин и регин, действуя как медиаторы воспаления, резко усиливают фагоцитоз, антителогенез, антителозависимую клеточ-но-опосредованную цитотоксичность, миграцию лейкоцитов и стимулирует секрецию интерлейкина-2, выполняя регуляторную функцию в иммунной системе. Механизм поглощения, составляющий третью стадию фагоцитоза, оптимально происходит только в условиях полного и равномерного покрытия объекта фагоцитоза опсонинами и включает: последовательную ассоциацию опсонических детерминант частиц с панелью рецепторов фагоцита, инвагинацию наружной мембраны фагоцита по типу застегивания молнии; образование псевдоподий, охватывающих объект и сливающихся друг с другом. Первый механизм, присущ фагоцитозу клеток и крупных частиц, второй характерен для поглощения микроорганизмов. Результат в обоих случаях один — образование фагосомы с частицей внутри. В поглощении участвует цитоскелет фагоцитов, в частности, белки клатрин и актин. В течение 1—2 минут в клетке формируется несколько фагосом. При участии цитоскелета происходит слияние ли-зосом с фагосомами с образованием фаголизосомы. В фаголизосоме рН меняется от нейтральной в первые минуты (оптимум ферментов специфических гранул) до 4,7, что служит условием для конверсии супероксидного аниона в перекись водорода без участия супероксид-димутазы, которая в фаголизосому, по-видимому, не секретируется, а также для активации кислых лизосомальных гидролаз. В стадии переваривания наибольшее значение для бактерицидного эффекта при фагоцитозе имеют антимикробные факторы. Их можно разделить на две группы. К первой относятся компоненты, присутствующие в зрелом лейкоците. Это лизоцим, лактоферин, ка-тионные белки. Они лизируют (лизоцим), убивают (катионные белки) или задерживают рост (лактоферин) микробов. Факторы второй группы образуют кислородные радикалы (супероксидный анион и др.), которые вместе с перекисью водорода, миелопероксидазой и галогенами составляют эффекторное звено кислородозависимого аппарата цитотоксичности нейтрофила. По мере реализации фагоцитарной реакции формируются условия для полного развития стадии пролиферации. В частности, мономерная форма С-реактивного белка, образующаяся в процессе его фагоцитоза и обладающая выраженной хемоаттрактивной активностью, замещается пентамерной, обладающей митогенной активностью. В результате этого происходит переключение неспецифического ответа в специфический, определяемый доминированием в очаге лимфоцитов и макрофагов. Таким образом, нейтрофилы обладают способностью убивать патогенные микроорганизмы, а также переваривать подвергшиеся фагоцитозу омертвевшие ткани (рис. 2.9—2.11). При этом необходимо отметить, что окислительные возможности лейкоцитов во многом определяют прогноз как местного раневого процесса, так и течения ^ожоговой болезни (при обширных поражениях кожи) в целом. При ожогах происходит респираторный взрыв нейтрофилов, в результате чего образуется большое количество активированных форм кислорода, которые в свою очередь вызывают поражения внутренних Органов (см. ниже), но на этом свойства ПЯЛ не ограничиваются. Нейтрофилы воздействуют на межклеточный матрикс путем секреции коллагеназы, эластазы, нейтральных протеиназ, катепсинов, кислых гидролаз. Коллаген и его пептиды, в свою очередь, являются хемотаксическими факторами для макрофагов и фибробластов. Кроме того, нейтрофилы обладают способностью синтезировать факторы, усиливающие и ингибирующие миграцию фибробластов. Таким образом, нейтрофилы, не только фагоцитируют омертвевшие ткани и микроорганизмы, но также поддерживают каскад воспа-лительно-репаративного процесса. Роль макрофагов в очаге воспаления. Если нейтрофилы погибают при фагоцитозе, то макрофаги сохраняются в процессе фагоцитоза, резорбируют продукты распада клеток и межклеточного вещества, расчищая поле для регенерации. Процесс этот реализуется с помощью таких лизосомальных ферментов, как коллагеназа и эласта-за. Через них, по-видимому, устанавливается подвижное равновесие между макрофагами и фибробластами — основными продуцентами коллагена. Активированный лимфокинами лимфоцитов макрофаг повышает свой коллагенолитический потенциал, что по механизму обратной связи включает нарастающую способность фибробластов синтезировать коллаген I, III и V типов, гликозаминогликаны, фиб-ронектин и другие вещества. Если этого не происходит, то нарушается репарация дефекта. Таким образом, макрофаги играют важную роль в сопряжении экс-судативной и пролиферативной фаз воспаления, регенерации и фиброза. Они (совместно с нейтрофилами) ограничивают пораженный участок тканей, формируя нейтрофильно-макрофагальный барьер (см. рис. 2.6). Вначале в нем превалируют нейтрофилы, но впоследствии клеточный состав этого барьера меняется на преимущественно макрофагальный и далее, на макрофагально-фибробластический, что предшествует формированию грануляционной ткани. Макрофаги стимулируют пролиферацию фибробластов за счет секреции ряда биологически активных веществ (цитокинов и ростовых факторов). К ним относятся макрофагальный фактор роста (MDGF), тромбоци-тарный фактор роста (PDGF), трансформирующий ростовой фактор (TGF-p), фактор некроза опухолей (TNF), интерлейкин-1 (IL-1). Кроме того, хемотаксис фибробластов усиливает секретируемый макрофагами фибронектин. За счет выделения TGF-a, TGF-p, pFGF, EGF, IL-8 они стимулируют ангиогенез. На синтез коллагена и секрецию коллагеназы макрофаги влияют через выделяемые ими факторы PDGF, TGF-p, TNF-a, IGF-1, IL-1. Формирование внеклеточного мат-рикса усиливается за счет выделения TGF-a, EGF, TNF-a, IL-1, pFGF. Выделяя монокины, макрофаги влияют на дифференцировку из стволовых клеток, миграцию, пролиферацию и функцию моноцитов. В кооперации с Т- и В-лимфоцитами они участвуют в иммунном ответе организма, тесно связанном с воспалением. Есть данные, что макрофаги секретируют более 60 монокинов, что определяет ведущую роль этого вида клеток в этой стадии воспаления. Благодаря этому макрофаг может взаимодействовать практически со всеми клеточными популяциями и межклеточным матриксом. По сути дела он является дирижером клеточного ансамбля. Не исключено, что активированные макрофаги, также как и нейтрофилы, могут усиливать регенерацию и по другим каналам, например, отменяя антипролифе-ративное действие глюкокортикоидов через выделение факторов-антагонистов (дефинсинов и протегринов). Макрофаги в функциональном отношении гетерогенны: имеются фагоциты, детерминированные на синтез и секрецию медиаторов воспаления, и фагоциты, кооперирующие с лимфоцитами в иммунном ответе, влияя на их таксис и функции, продуцируя монокины. Отличительной чертой этих макрофагов является экспрессия на плазматической мембране продуктов Ir-генов, контролирующих силу иммунного ответа, так называемые Ja-белки. Необходимо отметить, что секрети-руемые цитокины не только непосредственно, внутрисистемно, участвуют в регуляции функции кооперирующих в процессе воспаления клеток, но и опосредованно, за счет взаимодействия с другими системами, например нейроэндокринной, что предопределяет появление ряда общих реакций, типичных для воспаления. Материальным субстратом нейроиммунного взаимодействия являются рецепторы к пептидным лигандам, общие для обеих систем. Так, интерлейкин-1 (эндогенный пироген) воздействует на терморегуляторный центр в гипоталамусе. Этот цитокин непосредственно, а также через продукцию простагландинов, способен вызывать лихорадку, стимуляцию метаболизма норадреналина в ЦНС, вызывать нейтрофилию, усиливать синтез белков острой фазы, обеспечивать анальгезирующий эффект, а через активацию гипоталамо-гипофизарно-надпочечниковой оси воздействовать на прочие иммунологические параметры. В конечном счете наступает пролиферативная фаза воспаления, что обеспечивает воссоздание архитектуры ткани, включая все элементы органотканевого функционального комплекса. Фибробласты в огаге воспаления. Фибробласты — главные эффекторы репаративной фазы, ими генерируются основные элементы стромы и микроциркуляторной единицы. Они являются основными клетками, действующими в следующей стадии воспаления. Параллельно пролиферации фибробластов происходит новообразование сосудов. Путем почкования от капилляров отделяются тяжи клеток, образующихся из эндотелия. Позднее в этих тяжах появляется просвет вновь образовавшихся капилляров. Последние имеют вертикальную направленность, вокруг них расположены фибробласты и гистиоциты. Как следует из исследований Н. Г. Хрущева (1976) в заживлении ран принимает участие короткоживущая популяция фибробластов, имеющая общее происхождение с другими кроветворными клетками. Фибробласты являются основными продуцентами компонентов межклеточного матрикса (коллагенов I, III, V типов, гликоз-аминогликоанов, фибронектина и др.). Вместе с тем, в наработке этих компонентов принимают участие и другие виды клеток (макрофаги, нейтрофилы). Таким образом, на этом этапе ведущая роль уже принадлежит фибробластам, которые становя? |