Клеточные и молекулярные процессы при воспалении
Воспаление
– сложный патологический процесс, с
помощью которого организм реагирует
на повреждение тканей и целью которого
является восстановление исходного
состояния.
Любой
повреждающий агент (фактор), который
по силе и длительности превосходит
адаптационные возможности ткани, может
вызвать воспаление.
Классификация повреждающих факторов
Экзогенные
факторы:
Микроорганизмы
(бактерии, вирусы)Животные
организмы (простейшие, черви, насекомые)Физические
факторы:
а) термические
воздействия (холод, тепло)
б) ультрафиолетовое
излучение
в) радиоактивное
и рентгеновское излучение
г) механические
воздействия (инородные тела, давление,
разрыв).
Химические
факторы:
а) кислоты
б) щелочи
в) токсические
вещества и ксенобиотики
Эндогенные
факторы.
Они
возникают в самом организме в результате
тех или иных заболеваний или нарушений
(опухоль, желчные и мочевые камни, тромб
в кровеносном сосуде и т.д.).
В классическом
понимании принято выделять три стадии
воспаления:
Альтерацию
(повреждение)Экссудацию
Пролиферацию
Однако
нередко бывает затруднительно определить
четкие границы между вышеперечисленными
стадиями воспаления. Поэтому в зависимости
от процессов, преобладающих на определенном
этапе воспаления, в настоящее время его
стадийность представляется следующим
образом:
Стадия
альтерации:
а) первичная
альтерация
б) вторичная
альтерация
Стадия
экссудации и эмиграцииСтадия
пролиферации и репарации:
а) пролиферация
б) завершение
воспаления
Первичная
альтерация.
Воспаление всегда начинается с повреждения
ткани. После воздействия повреждающего
фактора в клетках происходят структурные
и метаболические изменения. Они бывают
разными в зависимости от силы повреждения,
вида клеток, степени их зрелости и т.д.
Одни клетки при этом гибнут, другие
продолжают жить, третьи даже активируются.
Вторичная
альтерация. Если
первичная альтерация является результатом
непосредственного действия воспалительного
агента, то вторичная – не зависит от
него и может продолжаться и тогда, когда
этот агент уже не оказывает влияния
(например, при лучевом воздействии).
Повреждающий фактор является инициатором,
пусковым механизмом процесса, а далее
воспаление будет протекать по законам,
свойственным определенной ткани или
органу. При этом некоторые клетки
продолжают функционировать, начинают
вырабатывать биологически активные
вещества, вовлекая в динамику воспаления
иные клетки как в зоне воспаления, так
и вне ее.
Клетки
воспаления:
Макрофаги
– они вырабатывают ряд биологически
активных веществ, таких как интерлейкин-I,
ферменты, антиинфекционные агенты –
интерфероны, трансферрин, транскобаламин;
дериваты арахидоновой кислоты –
простагландин Е2,
тромбоксан А2,
лейкотриены; ингибиторы протеаз.
Важнейшая функция макрофагов – фагоцитоз,
а также кооперация с другими клетками
воспаления.
Тучные
клетки. Эти
клетки вырабатывают гистамин, гепарин,
факторы хемотаксиса эозинофилов и
активации тромбоцитов.
Нейтрофилы.
Главная
функция этих клеток – фагоцитоз. Они
попадают из костного мозга в кровь,
эмигрируют из сосудов и в больших
количествах скапливаются в воспаленной
ткани. В нейтрофилах вырабатываются
лейкотриены, ряд ферментов, фактор
активации тромбоцитов и антимикробные
факторы.
Эозинофилы.
Их роль в воспалении определяется
рецепторами, расположенными на
поверхности, и ферментами, находящимися
внутри. Эозинофилы осуществляют
деградацию гистамина и лейкотриенов.
Тромбоциты.
Их роль в воспалении состоит главным
образом в том, что они имеют непосредственное
отношение к микроциркуляции и свертыванию
крови. В тромбоцитах вырабатываются
простагландины, серотонин, гистамин,
тромбоцитарный фактор роста.
Лимфоциты.
Эти клетки
играют роль при любом воспалении,
но
особенно при иммунном.
Фибробласты.
Действие фибробластов проявляется в
последней
стадии
процесса, когда в очаге воспаления
увеличивается число этих клеток,
активизируется синтез в них коллагена
и гликозаминогликанов.
Медиаторы
воспаления.
Медиаторами воспаления называются
биологически активные вещества, которые
синтезируются в клетках или в жидкостях
организма и оказывают непосредственное
влияние на воспалительный процесс.
Таблица 1.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Клеточные механизмы защитных реакций организма при воспалении.Основные закономерности развития необратимых патологических изменений в клетках при первичной и вторичной альтерации Рассматривая воспаление как типовой патологический процесс, протекающий в виде последовательно сменяющих друг друга, а в ряде случаев развивающихся параллельно стадий альтерации, экссудации и пролиферации, необходимо отметить, что при определенных условиях течение воспалительных реакций может иметь как преимущественно защитно-приспособительный, так и разрушительный характер. Воздействие на ткани различных по своей природе факторов (химических, физических, бактериальных), как правило, приводит к развитию первичной альтерации. Степень выраженности и распространенность альтеративных изменений определяется интенсивностью действующего фактора, устойчивостью клеток к этому воздействию и способностью клеточных механизмов компенсировать патологические изменения. Повреждение ткани сопровождается выделением биологически активных веществ, способных еще в большей степени увеличивать альтеративные процессы — вызывать вторичную альтерацию. Независимо от особенностей воздействующего фактора, индуцирующего воспалительный процесс, все изменения в клетках можно свести к следующим типам:
Деструктивные процессы в тканях, возникающие в альтернативной стадии (фазе) воспаления, имеют преимущественно патологический характер. Их выраженностью в значительной степени определяется возможная степень неблагоприятного течения воспалительного процесса в целом. При обратимых сублетальных изменениях клетка способна адаптироваться и восстанавливать свою структуру и функцию. В этом случае, как правило, происходит снижение интенсивности метаболических процессов, ограничение потребления кислорода, угнетение процессов окислительного фосфорилирования, активирование гликолиза, уменьшение запасов макроэргических фосфорных соединений, падение уровня активности K-Na-АТФ-азы, ингибирование внутриклеточных ферментов, активирующих анаболические процессы. В процессе необратимого повреждения клетки наблюдается постепенное увеличение объема внутриклеточных структур (расширение эндоплазматической сети, набухание митохондрий, увеличение объема лизосом). Летальные изменения в клетках сопровождаются повреждением наружной и внутриклеточных мембран, в результате чего повышается их пассивная проницаемость для ионов. Одним из кардинальных признаков повреждения клетки является увеличение содержания натрия в цитозоле и выход во внеклеточную среду калия. Тяжелые метаболические расстройства клеточных функций сопровождаются увеличением содержания кальция в цитозоле. В нормальных условиях в цитоплазме регистрируется низкая концентрация кальция, не превышающая 10″‘ моль/л, которая обеспечивается непрерывной работой Са-АТФаз. Основные запасы кальция содержатся в эндоплазматическом ретикулуме, большая часть мембраны которого плотно покрыта белком с молекулярной массой 110 кДа, являющегося Са-насосом. Концентрация кальция в эндоплазматическом ретикулуме в 10 000-100 000 раз выше чем в цитозоле. Деполяризация клеточной мембраны и гидролиз мембранных липидов сопровождаются раскрытием кальциевых каналов, по которым кальций из внутриклеточных депо (цистерн эндоплазматического ретикулума, митохондрий) или интерстициального пространства устремляется в цитозоль. Возникающие в ходе воспаления метаболические нарушения энергообеспечения работы транспортных систем клеток изменяют нормальное протекание процессов реабсорбции кальция, который устремляется из кальцийсодержащих структур и внеклеточной среды в цитозоль по механизмам пассивного транспорта. — Также рекомендуем «Изменения клеток при альтеративной стадии воспаления.» Оглавление темы «Ключевые механизмы воспаления легких.»: |
Подобный материал:
- Л. И. Параллелизмы в молекулярной организации генома и проблемы эволюции. В кн.: Молекулярные, 251.18kb.
- Передовая статья, 401.51kb.
- И. П. Павлова (наб. Макарова, 6) >10. 30 Открытие конференции 11. 45 Первое пленарное, 519.2kb.
- Молекулярные механизмы обеспечения метаболической толерантности в условиях действия, 553.73kb.
- § Клеточные и молекулярные механизмы обучения и памяти, 230.65kb.
- План лекции Острое воспаление. Определение. Общая схема острого воспаления Основные, 241.55kb.
- Молекулярные механизмы апоптоза при окислительном стрессе 14. 00. 16 патологическая, 606.37kb.
- Рабочая программа дисциплины «введение в биохимическую экологию» Код дисциплины, 145.9kb.
- Молекулярные механизмы формирования множественной лекарственной резистентности у Burkholderia, 787.44kb.
- Плейотропные эффекты статинов при ишемической болезни сердца, 102.84kb.
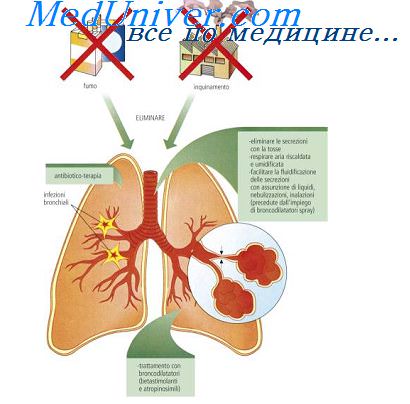
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ВОСПАЛЕНИЯ
Воспаление
– сложный патологический процесс, с помощью которого организм реагирует на повреждение тканей и целью которого является восстановление исходного состояния.
Любой повреждающий агент (фактор), который по силе и длительности превосходит адаптационные возможности ткани, может вызвать воспаление.
Классификация повреждающих факторов
- Экзогенные факторы:
- Микроорганизмы (бактерии, вирусы)
- Животные организмы (простейшие, черви, насекомые)
- Физические факторы:
а) термические воздействия (холод, тепло)
б) ультрафиолетовое излучение
в) радиоактивное и рентгеновское излучение
г) механические воздействия (инородные тела, давление, разрыв).
- Химические факторы:
а) кислоты
б) щелочи
в) токсические вещества и ксенобиотики
- Эндогенные факторы.
Они возникают в самом организме в результате тех или иных заболеваний или нарушений (опухоль, желчные и мочевые камни, тромб в кровеносном сосуде и т.д.).
В классическом понимании принято выделять три стадии воспаления:
- Альтерацию (повреждение)
- Экссудацию
- Пролиферацию
Однако нередко бывает затруднительно определить четкие границы между вышеперечисленными стадиями воспаления. Поэтому в зависимости от процессов, преобладающих на определенном этапе воспаления, в настоящее время его стадийность представляется следующим образом:
- Стадия альтерации:
а) первичная альтерация
б) вторичная альтерация
- Стадия экссудации и эмиграции
- Стадия пролиферации и репарации:
а) пролиферация
б) завершение воспаления
Первичная альтерация
. Воспаление всегда начинается с повреждения ткани. После воздействия повреждающего фактора в клетках происходят структурные и метаболические изменения. Они бывают разными в зависимости от силы повреждения, вида клеток, степени их зрелости и т.д. Одни клетки при этом гибнут, другие продолжают жить, третьи даже активируются.
Вторичная альтерация.
Если первичная альтерация является результатом непосредственного действия воспалительного агента, то вторичная – не зависит от него и может продолжаться и тогда, когда этот агент уже не оказывает влияния (например, при лучевом воздействии). Повреждающий фактор является инициатором, пусковым механизмом процесса, а далее воспаление будет протекать по законам, свойственным определенной ткани или органу. При этом некоторые клетки продолжают функционировать, начинают вырабатывать биологически активные вещества, вовлекая в динамику воспаления иные клетки как в зоне воспаления, так и вне ее.
Клетки воспаления: Макрофаги
– они вырабатывают ряд биологически активных веществ, таких как интерлейкин-I, ферменты, антиинфекционные агенты – интерфероны, трансферрин, транскобаламин; дериваты арахидоновой кислоты – простагландин Е2, тромбоксан А2, лейкотриены; ингибиторы протеаз. Важнейшая функция макрофагов – фагоцитоз, а также кооперация с другими клетками воспаления.
Тучные клетки.
Эти клетки вырабатывают гистамин, гепарин, факторы хемотаксиса эозинофилов и активации тромбоцитов.
Нейтрофилы.
Главная функция этих клеток – фагоцитоз. Они попадают из костного мозга в кровь, эмигрируют из сосудов и в больших количествах скапливаются в воспаленной ткани. В нейтрофилах вырабатываются лейкотриены, ряд ферментов, фактор активации тромбоцитов и антимикробные факторы.
Эозинофилы
. Их роль в воспалении определяется рецепторами, расположенными на поверхности, и ферментами, находящимися внутри. Эозинофилы осуществляют деградацию гистамина и лейкотриенов.
Тромбоциты.
Их роль в воспалении состоит главным образом в том, что они имеют непосредственное отношение к микроциркуляции и свертыванию крови. В тромбоцитах вырабатываются простагландины, серотонин, гистамин, тромбоцитарный фактор роста.
Лимфоциты.
Эти клетки играют роль при любом воспалении,
но особенно при
иммунном
.
Фибробласты.
Действие фибробластов проявляется в последней стадии процесса, когда в очаге воспаления увеличивается число этих клеток, активизируется синтез в них коллагена и гликозаминогликанов.
Медиаторы воспаления
. Медиаторами воспаления называются биологически активные вещества, которые синтезируются в клетках или в жидкостях организма и оказывают непосредственное влияние на воспалительный процесс.
Таблица 1.
Медиаторы воспаления
Название | Оказываемый эффект | Происхождение |
Клеточные медиаторы | ||
Гистамин | Местное расширение сосудов, повышение их проницаемости | Тучные клетки |
Серотонин | Повышение проницаемости стенки сосудов | Тромбоциты, хромафинные клетки слизистой ЖКТ |
| Лизосомальные ферменты | Вторичная альтерация, хемотаксис | Гранулоциты, макрофаги |
Катионные белки | Повышение проницаемости стенки сосудов | Нейтрофильные гранулоциты |
| Продукты расщепления арахидоновой кислоты | ||
Простагландины(ПГЕ1) | Повышают проницаемость сосудов, отек, хемотаксис | Арахидоновая кислота |
Тромбоксан(ТХА2) | Агрегация тромбоцитов, вазоконстрикция | Тромбоциты |
Простакциклин | Дезагрегация тромбоцитов, расширение сосудов | Эндотелиоциты |
Лейкотриены | Хемотаксис, сокращение гладких мышц, отек | Лейкоциты |
Гуморальные медиаторы | ||
Кинины (брадикинин, каллидин) | Расширение капилляров, увеличение проницаемости, боль, зуд. | α2-глобулины крови |
Система комплемента | Цитолиз, хемотаксис | Плазма крови |
Вторая стадия воспаления –
экссудация
. Это выход жидкой части крови, электролитов, белков и клеток из сосудов в ткани. Выход лейкоцитов (эмиграция) занимает в этом процессе особое место.
Пролиферация и репарация
. На этой стадии постепенно прекращаются деструктивные процессы, которые сменяются созидательными изменениями. Это проявляется размножением клеток и возмещением возникшего ранее дефекта новообразованными клетками. Одновременно идет процесс активного погашения воспалительного процесса, что проявляется ингибированием ферментов, расщеплением и выведением токсических продуктов. Активность клеток воспаления тормозится разными механизмами. Что касается ингибиторов, то здесь важную роль играет α2-макроглобулин. Этот белок является главным ингибитором кининообразующих ферментов крови и таким образом устраняет их влияние: расширение и повышение проницаемости сосудов. Кроме того, он ингибирует большинство протеиназ из лейкоцитов (коллагеназу, эластазу) и тем самым предохраняет от разрушения элементы соединительной ткани.
В прекращении деструктивных явлений при воспалении важную роль играет устранение свободных радикалов. Внутри клеток свободные радикалы нейтрализует супероксиддисмутаза, а в экстрацеллюлярной фазе – церулоплазмин. Изменяется взаимоотношения между клетками. Они перестают вырабатывать одни медиаторы и начинают синтезировать другие. Теперь на тот же медиатор клетка может дать совсем другой ответ, потому что на её поверхности изменяется состав рецепторов.
4.5. клеточные и молекулярные процессы воспаления
Нарушение структуры эндотелия и усиление его проницаемости — один из важнейших этапов воспаления. В зоне повреждения происходят кратковременный спазм прекапилляр-ных артериол, последующая их дилатация с усилением перфузии и, как следствие, увеличение проницаемости мелких и средних посткапиллярных венул (схема 4.6). Описаны 5 основных механизмов увеличения проницаемости эндотелия при воспалении.
Сокращение эндотелиальных клеток под действием гиста-мина, брадикинина, лейкотриенов и некоторых других классов медиаторов приводит к расширению межклеточных шелей. Это наиболее распространенный механизм сосудистой проницаемости. Подобное повышение сосудистой проницаемости развивается сразу после воздействия медиатора, обычно непродолжительного (15—30 мин) и обратимого.
Реорганизация цитоскелета и межклеточных контактов происходит под действием таких цитокинов, как ИЛ-1, ФНО и у-интерферон. Эти цитокины вызывают структурную реорганизацию цитоскелета, в результате чего эндотелиальные клетки отделяются друг от друга в местах межклеточных контактов.
Прямое повреждение эндотелия, приводящее к некрозу и слущиванию эндотелиальных клеток, обычно возникает при непосредственном воздействии повреждающих факторов на эндотелий, например при тяжелых ожогах или под действием бактерий, вызывающих лизис тканей (через ФНОа). В большинстве случаев увеличение проницаемости сосудов происходит сразу после повреждения и поддерживается на высоком уровне в течение нескольких часов, пока поврежденные сосуды не тромби-руются или не восстановятся. При этом механизме нарушены все уровни микроциркуляции, включая венулы, капилляры и артериолы. Отслойка эндотелиальных клеток часто сопровождается прилипанием тромбоцитов и тромбозом.
Повреждение эндотелия, вызванное лейкоцитами. Адгезия активированных лейкоцитов к эндотелию развивается на относительно ранней стадии воспаления. Активированные лейкоциты способны выделять токсичные соединения кислорода и про-теолитические ферменты, вызывающие повреждение или отслойку эндотелия, что ведет к повышению сосудистой проницаемости.
5. Повышенная проницаемость регенерирующих капилляров.
В процессе репарации эндотелиальные клетки пролиферируют и образуют новые кровеносные сосуды (ангиогенез). Эти капиллярные ростки остаются проницаемыми, пока идет дифферен-цировка эндотелиальных клеток и образуются межклеточные соединения.
Аккумуляция лейкоцитов в зоне повреждения вызывает серию комплексных взаимодействий между эндотелиальными клетками и лейкоцитами. От момента ухода лейкоцитов из просвета сосуда до проникновения в интерстициальную ткань происходит следующее: в просвете сосуда развивается феномен «краевого стояния лейкоцитов», затем феномен «катящихся лейкоцитов» по поверхности эндотелиальных клеток и их прилипание; проникновение сквозь эндотелий (диапедез); миграция в интерстициальную ткань по направлению хемотаксичес-ких сигналов.
В нормальном кровотоке эритроциты и лейкоциты концентрируются в центральной зоне сосуда, покидая бедные клетками слои плазмы около эндотелия. В раннюю стадию воспаления, одновременно с повышением сосудистой проницаемости, происходит изменение поверхности эндотелиальных клеток — появляются многочисленные выросты, способствующие замедлению кровотока и созданию турбулентных завихрений, в результате чего лейкоциты покидают центральную часть кровотока и занимают позиции на периферии вдоль эндотелиальной выстилки. Этот инициальный процесс, называемый маргинацией, или краевым стоянием лейкоцитов, связан главным образом с изменениями гемодинамики. В результате лейкоциты как бы катятся вдоль эндотелия, задерживаясь на короткое время, затем полностью останавливаются и плотно прилипают. После плотного прилипания лейкоциты выпускают псевдоподии в местах межклеточных соединений эндотелиальных клеток, проникают сквозь интерэндотелиальные контакты, пенетрируют базальную мембрану и попадают в околососудистое пространство.
Прилипание и проникновение лейкоцитов определяется связыванием адгезивных молекул на лейкоцитах и поверхности эндотелия химическими медиаторами — хемоаттрактантами и некоторыми цитокинами. Адгезивные рецепторы представлены тремя семействами молекул — селектинами, иммуноглобулинами и интегринами.
На начальных этапах адгезия нейтрофилов осуществляется с помощью связывания селектинов лейкоцитов и эндотелиальных клеток с их лигандами (Р-селектина на эндотелии и L-селекти-на на нейтрофилах). Поскольку количество Р-селектинов постоянно меняется (за счет интернализации рецепторов), ней-трофилы задерживаются на поверхности эндотелия на короткое время и катятся дальше. Гистамин и тромбин стимулируют продукцию ИЛ-1 и ФНОа лейкоцитами. Эти цитокины инициируют появление дополнительных адгезивных молекул на эндотелии — Е-селектина и межклеточной адгезивной молекулы-1 (ІСАМ-1), семейства иммуноглобулинов и р2-интегРинов на лейкоцитах, обеспечивающих полную остановку нейтрофилов и их проникновение через сосудистую стенку. Во время адгезии
происходит слущивание L-селектинов с поверхности лейкоцитов, поскольку функциональная необходимость в этих рецепторах исчезает (схема 4.7).
* Хемоаттрактанты — вещества, вызывающие хемотаксис, а хемо-кины — вещества, способствующие передвижению клеток.
Миграция всех типов лейкоцитов сквозь сосудистую стенку происходит в области межклеточных соединений. После пересечения эндотелиальных контактов лейкоциты временно задерживаются базальной мембраной, но окончательно проникают сквозь нее благодаря выделению нейтральных протеаз, разрушающих базальную мембрану. Миграция нейтрофилов в место повреждения — хемотаксис — обеспечивается хемотаксическими молекулами, выделяемыми как эндотелиальными клетками, так и другими клетками зоны повреждения. Хемоаттрактанты — С5а, лейкотриен В4″ фактор активации тромбоцитов и хемоки-ны (ИЛ-8)* вызывают образование инозитол-трифосфата (1Р3) и 1,2-диацилглицерола (ДАТ), которые через вторичные мессенд-жеры (фосфолипазу С, протеинкиназу С) создают градиент (изменение концентрации) внутриклеточного кальция, обеспечивающий движение клеток в очаг повреждения (см. главу 2).
Обозначения: CR3рецептор комплемента, ІСЗЬ компонент комплемента. Масі рецептор макрофага, НАДФ никотинамидадениндинуклеотидфосфаг
В более поздние сроки изменяется спектр адгезивных молекул на эндотелии. Комплексное действие ИЛ-1, ФНОа и у-интерферона вызывает появление на эндотелии сосудистой адгезивной молекулы — 1 (VCAM-1), соответствующей лиганду на моноцитах и лимфоцитах — рі-интегрину (VLA-4), и исчезновение Е-селектина. В результате в процессе адгезии участвуют преимущественно моноциты и лимфоциты. Появление среди хемоаттрактантов хемокина — моноцитарного хемоаттрактант-ного белка 1 (МСР-1) одновременно с экспрессией определенных адгезивных рецепторов на эндотелии способствует смене клеточных популяций в инфильтрате. Нейтрофильная инфильтрация сменяется моноцитарно-лимфоцитарной. Моноциты в очаге повреждения трансформируются в макрофаги.
Фагоцитоз и выброс ферментов нейтрофилами и макрофагами являются наиболее важными процессами, связанными с накоплением лейкоцитов в очаге воспаления (схема 4.8). Фагоцитоз состоит из трех взаимосвязанных стадий: 1) распознавания и связывания частиц лейкоцитом; 2) поглощения частиц с одновременным образованием фагоцитарной вакуоли; 3) уничтожения или разрушения поглощенного материала.
Распознавание и связывание. Нейтрофилы и макрофаги распознают и поглощают бактерии и инородные вещества вне сыворотки крови. Большинство микроорганизмов не распознается до тех пор, пока они не окружены опсонинами, которые связывают специфические рецепторы на лейкоцитах. Двумя основными опсонинами являются Fc-фрагмент IgG — естественное антитело против перевариваемых частиц — и СЗЬ, так называемый опсониновый фрагмент СЗ, образованный в результате активации комплемента с помощью иммунных и неиммунных механизмов.
Захват и поглощение. Связывание опсонизированных частиц является началом их захвата. Связывание СЗ-рецепторов требует их активации до захвата. Такая активация происходит в результате одновременного связывания внеклеточного фибронек-тина и ламинина или некоторых цитокинов. В процессе захвата псевдоподии окружают объект, после чего он оказывается в фа-госоме, окруженный цитоплазматической мембраной клетки. Ограничивающая мембрана этой фагоцитарной вакуоли сливается с мембраной, окружающей лизосому, и в результате образуется фаголизосома. В процессе захвата наблюдается дегрануля-ция нейтрофилов и макрофагов. Многие биохимические процессы, сопровождающие фагоцитоз и дегрануляцию, похожи на таковые при хемотаксисе. Захват сопровождается связыванием рецептора с лигандом, активацией фосфолипазы С и повышением концентрации кальция в цитозоле.
Уничтожение и разрушение. Основной этап фагоцитоза бактерий — их уничтожение и разрушение. Уничтожение бактерий обычно осуществляется с помощью кислородзависимого механизма. Фагоцитоз стимулирует усиленное потребление кислорода, гликогенолиз, окисление глюкозы, а также образование реактивных метаболитов кислорода. Количество Н202, образующейся в фаголизосоме, недостаточно для того, чтобы убить бактерии. Азурофильные гранулы нейтрофилов содержат фермент миелопероксидазу, антимикробное действие которой связано с окислением белков и липидов (перекисное окисление липидов). Подобный механизм эффективен также против грибов, вирусов, простейших и гельминтов.
Уничтожение бактерий может происходить и с помощью веществ, содержащихся во вторичных гранулах лейкоцитов. Они включают бактерицидный катионный белок, вызывающий активацию фосфолипазы, разрушение фосфолипидов и повышение проницаемости наружной мембраны микроорганизмов; лизо-цим, вызывающий гидролиз соединения мураминовой кислоты с N-ацетил-гликозамином, находящегося в гликопептидной оболочке всех бактерий; лактоферринсодержащий белок — в специфических гранулах; главный основной белок — катионный белок эозинофилов, обладающий ограниченной бактерицидной активностью, но цитотоксичный для многих паразитов; дефензины — катионные белки, содержащиеся в гранулах, богатых аргинином, и цитотоксичные для микробов.
Разрушение убитых микробов происходит под действием кислых гидролаз, находящихся в азурофильных гранулах фаго-лизосом. При этом рН в фаголизосомах после фагоцитоза колеблется от 4 до 5, что является оптимальным для действия ферментов. Изменения в мембранах, развивающиеся в нейтрофилах и моноцитах/макрофагах в процессе хемотаксиса и фагоцитоза, приводят к выделению определенных веществ не только в фаго-лизосомы, но и во внеклеточное пространство. Наиболее важные из них: ферменты лизосом, находящиеся в нейтрофильных гранулах; активные метаболиты кислорода; продукты метаболизма арахидоновой кислоты, в том числе простагландины и лейкотриены. Эти вещества являются сильными медиаторами для повреждения эндотелия и разрушения тканей. Поэтому, если лейкоцитарный инфильтрат персистирует и ничем не ограничен, он сам по себе может вызывать повреждение тканей, что наблюдается при ревматоидном артрите и некоторых формах хронических заболеваний легких.
Таким образом, для острого воспаления характерно увеличение кровотока через зону повреждения, возникающее в связи с расширением артериол и открытием капилляров. Повышенная сосудистая проницаемость приводит к накоплению богатой белком жидкости за пределами сосудов и формированию экссудата. Белки плазмы покидают сосуды преимущественно через расширенные промежутки между эндотелиальными клетками венул или в результате повреждения эндотелиальных клеток. Лейкоциты, вначале преимущественно нейтрофилы, прилипают к эндотелию с помощью адгезивных молекул, мигрируют сквозь эндотелий и проникают в место повреждения под влиянием хемо-таксических агентов. Далее происходит фагоцитоз чужеродных агентов, который может привести к гибели микроорганизмов. В процессе хемотаксиса и фагоцитоза активированные лейкоциты могут выделять токсические метаболиты и протеазы за пределы клеток, вызывая повреждение ткани и создавая основу для развития хронического воспаления.
При хроническом воспалении накопление макрофагов, поддерживаемое различными механизмами, приобретает устойчивый характер. Преобладает один из следующих типов реакций:
1) продолжение инфильтрации ткани моноцитами из кровотока возникает из-за постоянной индукции экспрессии адгезивных молекул и хемотаксических факторов. Эти клетки — наиболее важный источник макрофагов. Хемотаксическими стимулами для моноцитов, помимо С5а, ИЛ-8 и МСР-1, являются некоторые факторы роста, фрагменты разрушенного коллагена и фибронектина, а также фибринопептиды;
местная пролиферация макрофагов после их эмиграции из кровеносного русла имеет исключительное значение, в частности при формировании атеросклеротических бляшек;
иммобилизация макрофагов в месте воспаления. Некоторые цитокины (фактор торможения макрофагов) и окисленные ли-пиды могут вызывать такую иммобилизацию.
Макрофаг является центральным элементом хронического воспаления. Это связано с множеством биологически активных веществ, которые он продуцирует. Некоторые из них токсичны для клеток (например, метаболиты кислорода) или внеклеточного матрикса (протеазы), другие вызывают выход иных типов клеток (например, цитокины, хемотаксические факторы), третьи — пролиферацию фибробластов и накопление коллагена (например, ТФРр). Этот обширный арсенал медиаторов делает макрофаги мощными союзниками в защите организма, однако макрофаги могут вызывать и значительные повреждения ткани. Поэтому деструкция ткани становится одним из основных проявлений хронического воспаления.