Лихорадка при асептическом воспалении
Механизм развития лихорадки — патогенезПовышение температуры тела является распространенным клиническим симптомом, отмечается при самых различных заболеваниях и возникает разными путями. Понимание основ патофизиологии важно для рационального лечения детей с высокой температурой тела. Различают два типа повышения температуры тела — лихорадку и тепловые заболевания. Лихорадка — это состояние, при котором центр терморегуляции стремится к увеличению температуры тела. Тепловые заболевания — это такие состояния, при которых температура тела повышается в результате действия внутренних или внешних факторов вопреки попыткам центра терморегуляции удержать нормальную температуру. Лихорадка как терморегуляторая реакция организмаВ клинической практике наиболее распространенным механизмом повышения температуры тела является увеличение референтной температуры «установочной точки», локализованной в преоптической области передней части гипоталамуса (ПОПГ). В этих условиях «установочная точка» настраивается на более высокую, чем в норме, температуру и воспринимает сущствующую температуру «ядра» как очень низкую, хотя на самом деле она является нормальной. «Установочная точка» дает команды на увеличение температуры тела путем повышения активности центра теплопродукции и снижения активности центра теплоотдачи. Строго говоря, только такое состояние, при котором центр терморегуляции сам активно стремится к более высокой, чем в норме, температуре тела, имеет право называться лихорадкой. Все другие состояния, протекающие с повышением температуры, правильно именовать как повышенная температура тела (также правомерно использовать термины: пирексия, гиперпирекоия, гипертермия, или тепловая болезнь). Хотя в настоящее время все типы повышения температуры тела, часто весьма неточно, обозначаются термином лихорадка, в этой книге мы проведем различие между лихорадкой и другими типами гипертермии. При лихорадке неверно программированная «установочная точка» заставляет препотическую область гипоталамуса функционировать таким образом, как если бы фебрильная температура была нормальной. При этом достигается новое равновесие между теплопродукцией и теплоотдачей уже на фоне повышенной температуры тела. Терморегуляторный контроль остается эффективным, но при более высоком, чем в норме, уровне. У собак при лихорадке отмечается избыточный термогенный ответ на холод и уменьшенный тер’молитический ответ на тепло. Животные реагируют на изменения окружающей температуры таким образом, чтобы удержать организм в равновесии с новой температурой «установочной точки». Cooper описал несколько интересных больных с исходной гипотермией, вызванной различными заболеваниями ЦНС или неизвестными причинами. Возможно, что у этих больных механизм терморегуляции не был поврежден, но была более низкая, чем в норме, температура «установочной точки». При введении пирогена у них отмечалось повышение температуры тела. Степень этого повышения была такой же, как у больных с нормальным исходным уровнем, однако температура, естественно, не достигала таких же абсолютных величин. Lipton сообщил о больном с саркоидозом ЦНС и глубокой гипотермией. У этого больного сохранялась способность к развитию лихорадки, что указывает на независимость механизма контроля температуры тела от механизма возникновения лихорадки. Stitt подчеркнул, что повышение температуры тела при лихорадке представляет собой центрально регулируемый ее подъем, который полностью направляется, контролируется и защищается функциональными терморегуляторными механизмами.
Механизм (патогенез) развития лихорадкиУвеличение температуры «установочной точки» преоптической области гипоталамуса. Повышение температуры «установочной точки» преоптической области гипоталамуса почти всегда возникает под влиянием эндогенного пирогена — вещества, выделяемого фагоцитирующими лейкоцитами и макрофагами. Эндогенный пироген является конечным общим звеном при подавляющем большинстве фебрильных заболеваний. Исключением является действие облучения ЦНС, яда скорпиона и ДДТ, которые прямым путем увеличивают температуру «установочной точки». Было предложено, что адреналин и норадреналин при передозировке могут прямым образом повышать температуру «установочной точки» преоптической области гипоталамуса. Некоторые виды опухолей выделяют эндогенные пирогены или эндогенные пирогеноподобные вещества. Повреждение мозга способно повлиять на «установочную точку», как и на другие области преоптической области гипоталамуса. Эндогенный пироген при развитии лихорадкиБактериальный эндотоксин при внутривенном введении вызывает лихорадку только после латентного периода, продолжающегося около 90 мин. Эндогенный же пироген при том же способе введения вызывает лихорадку в течение нескольких минут. Человеческая кровь после инкубации с бактериальным эндотоксином при ее введении добровольцам также быстро вызывает лихорадку, что подтверждает мнение о выделении эндогенного пирогенного вещества лейкоцитами. Большинство исследований показало, что введение эндотоксина непосредственно в преоптической области гипоталамуса неэффективно, в то время как инъекция даже минимальной дозы эндогенного пирогена в ту же область немедленно вызывает лихорадку. Однако в одной из работ описана лихорадка при прямом введении эндотоксина в желудочки или переднюю часть гипоталамуса мозга крыс. Первоначально предполагали, что только циркулирующие полиморфноядерные лейкоциты могут выделять эндогенный пироген. Поэтому развитие лихорадки у больных с гранулоцитопенией казалось загадкой. Однако впоследствии было доказано, что большинство, если не все, фагоцитирующих клеток, развивающихся из костномозговых предшественников, выделяют эндогенный пироген. Некоторые клетки, не происходящие из костного мозга, например фибробласты, фагоцитируют частицы латекса в культуре тканей, но они не выделяют эндогенный пироген. Продуцировать эндогенный пироген могут альвеолярные и перитонеальные макрофаги, а также ретикулоэндотелиальные клетки печени и селезенки. Эндотоксин, который быстро связывается с циркулирующими гранулоцитами, вызывает лихорадку прежде всего путем стимуляции выработки этими клетками эндогенного пирогена. С другой стороны, живые бактерии и вирусы элиминируются из крови главным образом ретикулоэндотелиальной системой и вызывают лихорадку путем стимуляции образования и освобождения эндогенного пирогена клетками этой системы в печени и селезенке. Хотя лимфоциты не образуют эндогенный пироген, они выделяют лимфокинин, который стимулирует продукцию и выделение эндогенного пирогена гранулоцитами и моноцитами. Освобождение эндогенного пирогена отмечается не только при инфекционных заболеваниях. Основным пусковым механизмом образования и выделения эндогенного пирогена является фагоцитоз микроорганизмов, комплексов антиген—антитело, погибших или поврежденных клеток, клеточных фрагментов. Например, при введении эритроцитов группы D больным с антителами против антигена D отмечаются озноб и лихорадка после латентного периода продолжительностью 90 мин, что подтверждает наличие промежуточного этапа в продукции эндогенного пирогена. Эндогенный пироген образуется при аллергических заболеваниях, болезнях соединительной ткани и воспалительных реакциях в ответ на опухоли. По-видимому, существует особый механизм развития лихорадки при травме и тканевой деструкции. Эндогенный пироген — это белок с низкой молекулярной массой. После того как он выделился фагоцитирующими клетками, он покидает кровоток и быстро проникает в преоптическую область гипоталамуса. Эндогенный пироген является чрезвычайно мощным веществом и способен вызвать лихорадку у лабораторных животных при внутривенном введении в нанограммовых количествах. В настоящее время считается, что эндогенный пироген не содержится как таковой в фагоцитирующих клетках, а образуется в них под воздействием соответствующих стимулов. Этот этап требует определенного времени, так как включает синтез новой информационной РНК. Секреция эндогенного пирогена не ведет к лизису или гибели фагоцитов. Нейромедиаторы, действующие в установочной точке при лихорадкеЕсть серьезные основания предполагать, что нейрохимическим медиатором, повышающим температуру «установочной точки» преоптической области гипоталамуса при воздействии эндогенного пирогена, является простагландин. Минимальные дозы простагландинов E1 и Е2 при инъекции их в мозг лабораторных животных быстро вызывают лихорадку. Парентерально введенные простагландины, как правило, являются пирогенными только в больших дозах, возможно, из-за их инактивации в легких. Однако лихорадочные реакции были отмечены у больных после инъекций простагландина Е2; описана выраженная пирексия после его внутривлагалищного введения. Увеличение концентрации простагландинов обнаружено в мозге лабораторных животных во время лихорадки. Ингибирование простагландинсинтетазы ЦНС (ацетилсалициловой кислотой или парацетамолом) ведет к снижению температуры тела при лихорадке, но не влияет на нормальную температуру. Это наблюдение подтверждает мнение о том, что значение простагландинов в преоптической области гипоталамуса ограничено повышением температуры «установочной точки» при лихорадке, а в нормальных условиях они не играют роли. Значение таких медиаторов, как циклический АМФ и моноамины, неясно . Развитие лихорадкиПроцесс развития лихорадки при повышении температуры «установочной точки» преоптической области гипоталамуса включает сложную серию эффекторных шагов. Нарастает метаболическая активность и повышается напряжение кислорода, вызванные в первую очередь увеличением мышечного тонуса, которое иногда может переходить в дрожание. Также отмечается общее увеличение скорости метаболизма, независимо от возрастания активности скелетной мускулатуры. После введения бактериального эндотоксина усиление метаболической активности является самым ранним термогенным эффектом . Вскоре после этого развивается вазоконстрикция сосудов кожи, что ведет к снижению ее температуры и уменьшению потерь тепла путем радиации, кон-дукции и конвекции. Это особенно заметно в конечностях. Замедление кожного кровотока также способствует снижению потоотделения. Пилоэрекция, служащая у современного человека больше символом, чем способом сохранения тепла, является рудиментарным отголоском далеко прошлого, когда волосяной покров был для человека эффективной теплозащитой. Снижение температуры кожи субъективно воспринимается как ощущение холода, и больной старается согреться, несмотря на рост внутренней температуры тела. Ребенок сворачивается калачиком, что ведет к уменьшению площади открытой поверхности тела, и плотно натягивает на себя одеяло. Охлаждение кожи также включает сенсорную обратную связь с преоптической областью гипоталамуса, что еще больше вызывает усиление теплопродукции. Нередко начало лихорадки, особенно внезапное, сопровождается ознобом — сильным ощущением холода в сочетании с интенсивным дрожанием. Хотя озноб считается типичным для гнойных инфекций и бактериемии, его диагностическое значение оказалось меньшим, чем ранее предполагалось. Озноб может наблюдаться при вирусных и бактериальных инфекциях, а также при неинфекционных заболеваниях, таких, как лимфома. Важно помнить, что жаропонижающие средства могут вызывать озноб при снижении температуры тела до нормального уровня. Такое побочное действие этих препаратов не следует путать с ознобом, обусловленным основным заболеванием. Температура тела нарастает до тех пор, пока она не достигнет референтной температуры «установочной точки». При этом теплопродукция снова приходит в равновесие с теплоотдачей, хотя и при более высокой, чем в норме, температуре. Больной ощущает прилив тепла или по крайней мере больше не страдает от холода. Кожная температура при этом повышается, что отражает высокую температуру «ядра» и возросшую скорость метаболизма. Дальнейшему росту температуры кожи также способствует резко усиленная теплопродукция скелетной мускулатуры, расположенной под кожей. В одном из исследований при клиническом осмотре было обнаружено, что кожа была горячей у 60% детей с лихорадкой. — Также рекомендуем «Каков верхний предел повышения температуры тела? Предел лихорадки» Оглавление темы «Повышение температуры тела у ребенка — лихорадка»:
|
Повышение температуры тела является достаточно частым и одним из важных симптомов болезней органов дыхания у детей. Поэтому вопросы этиопатогенеза гипертермии и современные подходы к терапии лихорадочных состояний до настоящего времени являются актуальными проблемами педиатрии [2, 4, 5, 6, 7].
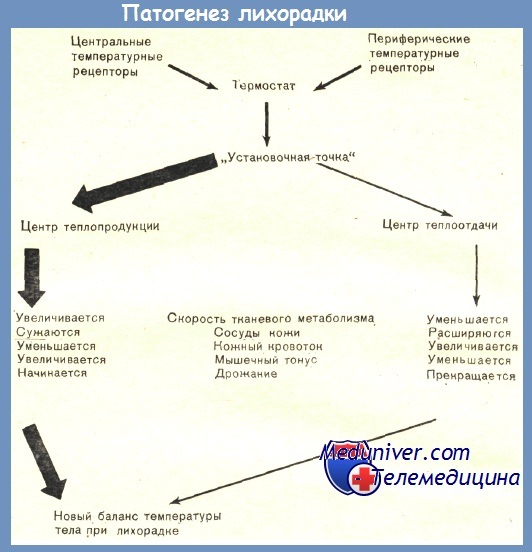
Известно, что способность поддерживать температуру тела на постоянном уровне независимо от температурных колебаний внешней среды (гомойотермность) позволяет организму сохранять высокую интенсивность метаболизма и биологическую активность. Контроль за уравновешиванием процессов теплопродукции и теплоотдачи осуществляется центром терморегуляции, расположенным в преоптической области передней части гипоталамуса. Информация о температурном балансе организма в центр терморегуляции поступает, во-первых, через нейроны центра терморегуляции, реагирующие на изменение температуры крови, и, во-вторых, от периферических терморецепторов. Кроме того, в осуществлении гипоталамической регуляции температуры тела участвуют и железы внутренней секреции, главным образом щитовидная железа и надпочечники.
Лихорадка — это защитно-приспособительная реакция организма, возникающая в ответ на воздействие патогенных раздражителей и характеризующаяся перестройкой процессов терморегуляции, приводящих к повышению температуры тела и стимулирующих естественную реактивность организма. Биологическое значение лихорадки заключается в активизации иммунологической защиты. Подъем температуры тела приводит к повышению фагоцитоза, увеличению синтеза интерферонов, активации и дифференцировке лимфоцитов и стимуляции антителогенеза. Повышенная температура тела препятствует размножению вирусов, кокков и других микроорганизмов.
Лихорадка принципиально отличается от повышения температуры тела, наблюдающегося при перегревании организма, которое возникает вследствие различных причин: при значительном повышении температуры окружающей среды, активной мышечной работе и др. При перегреве сохраняется установка центра терморегуляции на нормализацию температуры, в то время как при лихорадке центр терморегуляции целенаправленно перестраивает «установочную точку» на более высокий уровень температуры тела.
Поскольку лихорадка является неспецифической защитно-приспособительной реакцией организма, то причины, ее вызывающие, весьма разнообразны. Наиболее часто лихорадка встречается при инфекционных болезнях, среди которых доминируют острые респираторные заболевания верхних и нижних дыхательных путей. Лихорадка инфекционного генеза развивается в ответ на воздействие вирусов, бактерий и на продукты их распада. Повышение температуры тела неинфекционного характера может быть различного генеза: центрального (кровоизлияние, опухоль, травма, отек мозга), психогенного (невроз, психические расстройства, эмоциональное напряжение), рефлекторного (болевой синдром при мочекаменной болезни), эндокринного (гипертиреоз, феохромацитома), резорбтивного (ушиб, некроз, асептическое воспаление, гемолиз); оно может также возникать в ответ на введение некоторых лекарственных препаратов (эфедрина, ксантиновых производных, антибиотиков и др.).
Установлено, что интегральным компонентом патогенеза лихорадки является реакция фагоцитов периферической крови и/или тканевых макрофагов на инфекционную инвазию или неинфекционный воспалительный процесс [3, 4]. Первичные пирогены, как инфекционные, так и неинфекционные, только инициируют развитие лихорадки, стимулируя клетки организма к синтезу вторичных медиаторов-пирогенов. Источником вторичных пирогенов становятся преимущественно клетки фагоцитирующих мононуклеаров. Вторичные пирогены — неоднородная группа провоспалительных цитокинов (интерлейкины-1, -6, фактор некроза опухоли альфа и др.), однако основную инициирующую роль в патогенезе лихорадки играет интерлейкин-1 (ИЛ-1).
В нормальных условиях ИЛ-1 не проникает через гематоэнцефалический барьер. Однако при наличии воспаления (инфекционного или неинфекционного) ИЛ-1 достигает преоптической области передней части гипоталамуса и взаимодействует с рецепторами нейронов центра терморегуляции. При этом активизируется циклооксигеназа (ЦОГ), что приводит к увеличению синтеза простагландина Е1 и повышению внутриклеточного уровня циклического аденозин-3,5-монофосфата (цАМФ). Увеличение концентрации цАМФ способствует внутриклеточному накоплению ионов кальция, изменению соотношений Na/Ca и перестройке активности центров теплопродукции и теплоотдачи. Устанавливается новый уровень температурного гомеостаза — на более высокой точке, повышается теплопродукция, снижается теплоотдача. Повышение температуры тела достигается за счет изменения активности метаболических процессов, сосудистого тонуса, периферического кровотока, потоотделения, синтеза гормонов поджелудочной железы и надпочечников, сократительного термогенеза (мышечное дрожание) и других механизмов [1, 3].
Лихорадочный процесс при острых респираторных заболеваниях обычно протекает в три стадии. На первой из них температура повышается за счет значительного преобладания теплопродукции над теплоотдачей. На второй стадии увеличивается теплоотдача, дальнейшего изменения температуры в течение некоторого времени (дни, часы) не происходит. На третьей — после прекращения действия пирогенов «установочная точка» центра терморегуляции опускается до нормального уровня. Теплоотдача увеличивается за счет расширения кожных сосудов, обильного потоотделения, частого дыхания. Снижение температуры может быть постепенным (литическим) или быстрым (критическим). Если критическое снижение температуры, сопровождающееся резким расширением сосудов, сочетается с интоксикацией, то может возникнуть опасный для жизни ребенка коллапс.
Особо следует отметить, что при одинаковом уровне гипертермии лихорадка у детей может протекать по-разному. Так, если теплоотдача соответствует теплопродукции, это свидетельствует об адекватном течении лихорадки и клинически проявляется относительно нормальным самочувствием ребенка, розовой или умеренно гиперемированной окраской кожи, влажной и теплой на ощупь («розовая лихорадка»). Этот тип лихорадки часто не требует применения жаропонижающих средств.
В случае когда при повышенной теплопродукции теплоотдача неадекватна из-за нарушения периферического кровообращения, течение лихорадки прогностически неблагоприятно. Клинически при этом отмечаются выраженный озноб, бледность кожных покровов, акроцианоз, холодные стопы и ладони («бледная лихорадка»). Эти дети, как правило, нуждаются в назначении жаропонижающих препаратов в сочетании с сосудорасширяющими и антигистаминными средствами (или нейролептиками).
Одним из клинических вариантов неблагоприятного течения лихорадки является гипертермическое состояние у детей раннего возраста, в большинстве случаев обусловленное инфекционным воспалением, сопровождающимся токсикозом. При этом отмечается стойкое (6 и более часов) и значительное (выше 40,0°С) повышение температуры тела, сопровождающееся нарушением микроциркуляции, метаболическими расстройствами и прогрессивно нарастающей дисфункцией жизненно важных органов и систем [3, 6]. Развитие лихорадки на фоне острых микроциркуляторных обменных нарушений, лежащих в основе токсикоза, приводит к декомпенсации терморегуляции с резким нарастанием теплопродукции, неадекватно сниженной теплоотдачей. Все это связано с высоким риском развития метаболических нарушений, а также отека мозга и требует срочного применения неотложной комплексной терапии. Парентерально вводятся жаропонижающий препарат, проводят лечение токсикоза, при необходимости противосудорожную терапию.
Таким образом, наиболее часто лихорадочные состояния у детей возникают при острых заболеваниях органов дыхания. В соответствии с рекомендациями ВОЗ «Лечение лихорадки при острых респираторных инфекциях у детей» (WHO, 1993) и отечественными разработками жаропонижающие препараты следует назначать, когда температура у ребенка превышает 39,0°С (измеренная ректально). Исключение составляют дети с риском развития фебрильных судорог, с тяжелым заболеванием легочной или сердечно-сосудистой системы и малыши первых 2 мес жизни.
У ребенка с инфекционно-воспалительными заболеваниями органов дыхания и неотягощенным преморбидным фоном температурная реакция, как правило, имеет благоприятный характер («розовая лихорадка»), температура не превышает 38,5°С, и от использования лекарственных средств следует воздержаться. В этих случаях показаны обильное питье, могут быть использованы физические методы охлаждения (ребенка следует раскрыть и обтереть водой комнатной температуры, одежда должна быть свободной, легкой, температура в комнате не более +20°С).
Однако в любом случае основу терапии составляет этиотропное лечение основного заболевания, а жаропонижающая терапия носит симптоматический характер.
Жаропонижающие лекарственные средства (анальгетики-антипиретики) используются в медицине более 200 лет. Так, в 1763 г. было сделано первое научное сообщение о жаропонижающем действии препарата, полученного из ивовой коры (R. E. Stone). Позже было установлено, что активным началом этого препарата является салицин. Постепенно синтетические аналоги салицина (салицилат натрия и ацетилсалициловая кислота АСК) полностью заменили в терапевтической практике природные соединения. В настоящее время созданы несколько фармакологических групп анальгетиков-антипиретиков, большинство из которых относятся к нестероидным противовоспалительным препаратам (НПВП).
В основе жаропонижающего эффекта анальгетиков-антипиретиков лежат механизмы угнетения синтеза простагландинов за счет снижения активности циклооксигеназы. Блокада аналгетиками-антипиретиками ЦОГ в ЦНС позволяет добиться жаропонижающего и анальгезирующего эффекта (центральное действие), а снижение содержания простагландинов в месте воспаления — противовоспалительного и, за счет уменьшения болевой рецепции, обезболивающего действия (периферическое действие) [1, 2, 3].
При выборе жаропонижающих средств для детей особенно важно ориентироваться на препараты с наименьшим риском возникновения побочных эффектов. В настоящее время только парацетамол и ибупрофен полностью отвечают критериям высокой эффективности и безопасности и официально рекомендуются ВОЗ и национальными программами в педиатрической практике в качестве жаропонижающих средств (WHO, 1993; S. M. Lesko et al., 1997; Практические рекомендации для врачей Российской ассоциации педиатрических центров, 2000; и др.). Парацетамол и ибупрофен могут назначаться детям с первых месяцев жизни (с 3-месячного возраста). Рекомендованные разовые дозы: парацетамола — 10–15 мг/кг, ибупрофена — 5–10 мг/кг. Повторное использование антипиретиков возможно не ранее, чем через 4–5 ч, но не более 4 раз в сутки [2, 9].
Необходимо отметить, что механизм действия этих препаратов несколько различен. Парацетамол обладает жаропонижающим, аналгезирующим и очень незначительным противовоспалительным действием, так как блокирует ЦОГ преимущественно в ЦНС и не обладает периферическим действием. Имеются качественные изменения метаболизма парацетамола в зависимости от возраста ребенка, которые связаны со зрелостью системы цитохрома Р-450. Кроме того, задержка выведения препарата и его метаболитов может отмечаться при нарушении функций печени и почек. Суточная доза 60 мг/кг у детей является безопасной, но при ее увеличении может наблюдаться гепатотоксическое действие препарата. Описан случай фулминантной печеночной недостаточности с гипогликемией, коагулопатией при хроническом превышении дозы парацетамола (150 мг/кг) в течение нескольких дней [14]. При наличии у ребенка недостаточности глюкозо-6-фосфатдегидрогеназы и редуктазы глютатиона назначение парацетамола может вызвать гемолиз эритроцитов, лекарственную гемолитическую анемию.
Ибупрофен обладает выраженным жаропонижающим, аналгезирующим и противовоспалительным действием. В большинстве исследований показано, что ибупрофен так же эффективен при лихорадке, как и парацетамол [16, 17, 18]. В ходе других исследований удалось выявить, что жаропонижающий эффект ибупрофена в дозе 7,5 мг/кг выше, чем у парацетамола в дозе 10 мг/кг и АСК (10 мг/кг) [15]. Это проявлялось большим снижением температуры через 4 ч и у большего числа детей. Такие же данные были получены в ходе двойного слепого исследования в параллельных группах при повторном приеме ибупрофена 7 и 10 мг/кг и парацетамола 10 мг/кг у детей от 5 мес до 13 лет [19]. Ибупрофен блокирует ЦОГ как в ЦНС, так и в очаге воспаления (периферический механизм), что и обусловливает наличие у него не только антипиретического, но и противовоспалительного эффекта. В результате уменьшается фагоцитарная продукция медиаторов острой фазы, в том числе и ИЛ-1. Снижение концентрации ИЛ-1 также способствует нормализации температуры. Ибупрофен проявляет двойное болеутоляющее действие — периферическое и центральное. Болеутоляющее действие проявляется уже в дозе 5 мг/кг и более выражено, чем у парацетамола. Это позволяет эффективно использовать ибупрофен при слабой и умеренной боли в горле, боли при тонзиллитах, острых средних отитах, зубной боли [3, 20].
Несмотря на высокую эффективность анальгетиков-антипиретиков, использование их у детей не всегда безопасно [11, 12]. Так в 70-е гг. прошлого столетия появились убедительные данные, что применение АСК при вирусных инфекциях у детей может сопровождаться синдромом Рея (Reye), который характеризуется токсической энцефалопатией и жировой дегенерацией внутренних органов, преимущественно печени и головного мозга [10]. Кроме того, ацетилсалициловая кислота повышает риск развития воспалительных изменений со стороны желудочно-кишечного тракта, нарушает свертываемость крови, повышает ломкость сосудов, у новорожденных может вытеснять билирубин из его связи с альбуминами и тем самым способствовать развитию билирубиновой энцефалопатии. Эксперты ВОЗ не рекомендуют применение АСК как жаропонижающего средства у детей до 12 лет, что нашло отражение в национальном Формуляре (2000) [8]. Приказом Фармкомитета РФ от 25.03.99 назначение АСК при острых респираторных инфекциях разрешено с 15-летнего возраста.
Одновременно накапливались данные о побочных эффектах и других антипиретиков. Так, амидопирин из-за своей высокой токсичности был исключен из номенклатуры лекарственных препаратов. Анальгин (метамизол, дипирон) может угнетать кроветворение вплоть до развития фатального агранулоцитоза, что привело к резкому ограничению его использования во многих странах мира (International Agranulocytosis and Aplastic Anaemi a Study Group, 1986). Однако в ургентных ситуациях, таких, как гипертермический синдром, острые боли в послеоперационном периоде и других, не поддающихся иной терапии, допустимо парентеральное использование анальгина и метамизолсодержащих препаратов.
Как уже упоминалось, наиболее безопасными для детей с болезнями органов дыхания антипиретиками являются ибупрофен и парацетамол. Сравнительное двойное слепое рандомизированное исследование при многократном их использовании показало сходную частоту неблагоприятных явлений (8–9%) [13]. Кроме того, в ходе этого крупного исследования, в котором приняли участие более 80 тыс. детей, удалось выявить, что при приеме ибупрофена по сравнению с парацетамолом не повышается риск госпитализации, связанной с желудочно-кишечными кровотечениями, почечной недостаточностью или анафилаксией.
У детей самого раннего возраста острые респираторные заболевания нередко протекают с бронхиальной обструкцией, что заставляет говорить об особенностях применения жаропонижающих препаратов у таких малышей и риске провокации бронхоспазма. Известно, что АСК и другие НПВП могут провоцировать бронхоспазм у лиц с непереносимостью АСК, так как угнетают синтез ПГЕ2, простациклина и тромбоксанов, способствуют увеличению синтеза лейкотриенов. Парацетамол не оказывает влияния на синтез этих медиаторов аллергического воспаления, однако бронхоконстрикция возможна и при приеме парацетамола, что связывают с истощением системы глютатиона в респираторном тракте и снижением антиоксидантной защиты. В то же время крупное международное исследование показало, что при использовании ибупрофена и парацетамола у 1879 детей с бронхиальной астмой было госпитализировано только 18 человек, из них сходное число получали парацетамол и ибупрофен [13], что и свидетельствует об относительной безопасности этих лекарственных средств у детей с бронхиальной астмой. При бронхиолите у детей первых 6 мес жизни ибупрофен и парацетамол также не оказывали бронхоспастического действия. Непереносимость АСК у детей встречается довольно редко, но в этих случаях применение НПВП противопоказано.
Таким образом, ибупрофен и парацетамол являются препаратами выбора у детей и могут использоваться в качестве жаропонижающих средств при болезнях органов дыхания, и прежде всего при острых респираторных инфекциях. Отмечено, что хронические заболевания легких, даже в период обострения, довольно редко протекают с высокой лихорадкой. Однако надо учитывать тот факт, что выраженное жаропонижающее действие антипиретиков затрудняет контроль лихорадки и, соответственно, своевременную коррекцию антибактериальной терапии. Особое внимание необходимо уделять рациональной жаропонижающей терапии у детей с аллергическими болезнями дыхательных путей.
Аллергические заболевания у детей в настоящее время можно считать одними из наиболее распространенных, число пациентов с аллергией постоянно растет. Аллергия, как преморбидный фон, у этой группы пациентов нередко определяет особенности течения состояний, протекающих с лихорадкой и, кроме того, повышает риск возникновения аллергических реакций на применяемые медикаменты.
Лихорадка у детей с аллергическими заболеваниями имеет свои особенности. Во-первых, у этих больных имеется склонность к выраженному и затяжному течению лихорадки, что обусловлено высоким уровнем ИЛ-1 у пациентов с атопией и, следовательно, патологическим, «замкнутым» кругом его синтеза, особенно в острый период аллергической реакции. Во-вторых, дети, предрасположенные к атопии, имеют высокую вероятность развития лихорадки лекарственного генеза (так называемая «аллергическая лихорадка»). В-третьих, надо учитывать, что на фоне обострения аллергии может отмечаться повышение температуры неинфекционного характера. В-четвертых, необходимо исключить непереносимость АСК у детей с бронхообструктивным синдромом, полипами верхних дыхательных путей и рецидивирующими синуситами. Назначение жаропонижающих препаратов детям с аллергическими заболеваниями и реакциями требует строгого врачебного контроля. Целесообразно в комплексное лечение лихорадочных состояний у детей с аллергическими заболеваниями наряду с жаропонижающими включать и антигистаминные препараты.
По вопросам литературы обращайтесь в редакцию.
О. В. Зайцева, доктор медицинских наук, профессор
РГМУ, Москва
