Маркеры воспаления и артериальная

Комментарии
Всероссийское научное общество кардиологов. Москва 2011
Предыдущий раздел | Содержание | Следующий раздел
15. Маркеры воспаления и гемостатические факторы
В настоящее время активно изучается роль маркеров воспаления и гемостатических факторов в развитии атеросклероза. Эти маркеры связаны с различными биологическими системами, такими как регуляция активности тромбоцитов, коагуляция, фибринолиз, эндотелиальная функция и воспалительный ответ. Помимо потенциальной значимости перечисленных маркеров в качестве предикторов ССЗ, была установлена тесная связь маркеров воспаления с ожирением и СД [213].
Воспаление – одно из основных патологических изменений, наблюдающихся при атеросклерозе артерий, включая наиболее ранние стадии, которые обусловливают формирование АСБ; кроме того, оно лежит в основе изменений, способствующих повреждению бляшки и образованию тромба. В эпидемиологических и морфологических исследованиях последних двух десятилетий были получены убедительные доказательства того, что уровень С-реактивного белка (СРБ) в плазме крови является признаком вялотекущего воспалительного процесса и неблагоприятным прогностическим фактором как у больных с острым коронарным синдромом, так и у здоровых лиц, не имеющих клинических проявлений ССЗ [214, 215]. Установлено, что маркеры активного воспаления тесно ассоциируются с развитием фатального и нефатального ИМ [216–219].
СРБ является высокочувствительным, но неспецифичным маркером воспаления и повреждения (таблица 14). Любое повреждение тканей, как вызванное травмой, так и связанное с воспалением, приводит к повышению уровня СРБ в плазме крови. Концентрация СРБ возрастает уже в первые 6–9 часов, достигая пика на 1–3 день с момента повреждения, и достаточно быстро снижается на фоне эффективного лечения или элиминации очага воспаления. Учитывая низкую специфичность СРБ для оценки риска нежелательных ССО, анализ рекомендуется проводить дважды с интервалом в 2 недели. Для анализа используется венозная кровь, которая берется независимо от приема пищи (у лиц с отсутствием нарушений обмена веществ). Если в одном из анализов уровни СРБ превышают 10 мг/л, следует исключить наличие инфекционных или воспалительных заболеваний и повторить измерение.
Таблица 14. Риск нежелательных ССО в зависимости от уровня СРБ
| Уровни С-реактивного белка | Риск нежелательных сердечно-сосудистых событий |
| <1 мг/л | Низкий риск |
| 1–3 мг/л | Умеренный риск |
| 3–10 мг/л | Высокий риск |
| >10 мг/л | Результат не может быть использован для оценки риска, так как повышение уровней высокочувствительного маркера воспаления может быть связано с травмой, инфекционным или воспалительным заболеванием |
Лечебные вмешательства, снижающие уровни СРБ:
- “Здоровая” диета с низким содержанием жиров, легкоусвояемых углеводов, богатая растительными волокнами;
- Снижение уровня общего ХС в крови;
- Снижение избыточной МТ;
- Регулярная аэробная физическая нагрузка умеренной интенсивности;
- Снижение повышенных уровней глюкозы в крови у больных СД;
- Снижение повышенного АД;
- Отказ от курения;
- Уменьшение употребления алкоголя;
- Прием статинов, тиазолидиндионов (росиглитазон, пиоглитазон), тиенопиридиновых производных (клопидогрель, тиклопидин), аспирина и противовоспалительных лекарственных средств.
Учитывая низкую специфичность СРБ, использование его как скринирующего метода для оценки кардиоваскулярного риска было бы в настоящее время преждевременно.
Другим заслуживающим внимания маркером воспаления является неоптерин. Неоптерин является высокоспецифичным и высокочувствительным маркером активации макрофагов, играющих важную роль на всех этапах формирования и развития АСБ. Повышение содержания неоптерина в биологических жидкостях – крови, моче, слюне свидетельствует об активации клеточного иммунитета. Несмотря на то, что неоптерин является маркером воспаления, его уровни слабо коррелируют с уровнями СРБ. В ряде исследований было показано, что повышенные уровни неоптерина у лиц с низкими уровнями ХС-ЛНП (Плацентарный фактор роста (PlGF), играющий роль первичного воспалительного медиатора неоангиогенеза, является маркером нестабильного течения атеросклероза. PlGF участвует в ключевых механизмах, приводящих к дестабилизации АСБ. Он способен инициировать неоангиогенез в артериальной стенке путем привлечения моноцитов/макрофагов и стимуляции клеток воспаления, эндотелиоцитов и гладкомышечных клеток к выбросу хемоаттрактантов, провоспалительных цитокинов и матриксных металлопротеиназ. Прогностическая значимость определения уровней PlGF изучалась в рамках ряда проспективных исследований. Так, в группе больных с острым коронарным синдромом, принимавших участие в исследовании CAPTURE, повышенные уровни PlGF достоверно предсказывали увеличение риска развития нефатального ИМ и сердечно-сосудистую смерть в течение ближайших 30 дней. Показано, что уровни PlGF не зависят от возраста и пола, ИМТ, среднего уровня систолического и диастолического АД, СД II типа, наличия в анамнезе перенесенного ИМ или нарушения мозгового кровообращения. Не выявлено зависимости между уровнями PlGF с уровнями СРБ и интерлейкина-6. Наблюдение в течение 2 лет показало, что выявление в крови больных ИБС уровней PlGF выше 20,5 пг/мл свидетельствует о более неблагоприятном прогнозе (смерть от ССЗ, нефатальный ИМ) по сравнению с больными с низкими (Недавно стало известно, что ассоциированный с беременностью протеин плазмы-А (PAPP-A), представляющий собой цинксодержащую металлопротеиназу, в изобилии продуцируется клетками АСБ, особенно нестабильной. У больных острым коронарным синдромом уровень PAPP-A выше, чем у больных стабильной стенокардией, и его определение в крови можно использовать в качестве предиктора неблагоприятного прогноза больных ИБС, который может оказаться более чувствительным маркером воспаления и предиктором нестабильности АСБ, чем тропонины и кардиоспецифические ферменты.
Результаты исследований свидетельствуют, что у практически здоровых лиц повышенные уровни РАРР-А предсказывают наличие эхогенных бляшек в сонных артериях. Уровни РАРР-А достоверно выше у больных с гиперлипидемией по сравнению с нормолипидемическими пациентами.
На сегодняшний день нет ответа на вопрос, является ли повышение уровней РАРР-А в крови больных следствием или одним из предикторов развития ОКС. Повышение уровней PAPP-A может иметь место еще до развития ОКС: у больных с так называемыми легкоранимыми АСБ в сонных артериях уровни PAPP-A в крови выше по сравнению с теми, у кого отмечаются только начальные признаки атеросклероза сонных артерий.
Таким образом, PAPP-A является биохимическим маркером, участвующим в патогенезе ИБС. Уровень PAPP-A в плазме крови коррелирует с выраженностью системного воспаления, он повышен у больных острым коронарным синдромом. У больных с более высокими уровнями PAPP-A отмечается менее благоприятный прогноз в течение 2 лет наблюдения.
До сих пор остается открытым вопрос, какова в действительности роль маркеров воспаления и гемостатических факторов в патогенезе ССЗ, насколько независимы они от других ФР и свидетельствует ли их динамика (например, СРБ и фибриногена) об изменении активности воспаления при атеросклерозе [219–220]. В ряде исследований было показано, что добавление “новых” ФР к уже существующим стандартным моделям оценки риска позволяет точнее предсказать вероятность развития ИБС и других ССЗ (в частности АГ и инсульта [219– 222]. Однако в настоящее время было бы преждевременным широко использовать СРБ и другие “новые” маркеры в рутинной практике кардиолога для оценки кардиоваскулярного риска.
Предыдущий раздел | Содержание | Следующий раздел
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 Скорость оседания эритроцитов (СОЭ) — неспецифический лабораторный показатель крови, отражающий соотношение фракций белков плазмы. Раньше этот показатель носил название «реакция оседания эритроцитов» (РОЭ). Это одно и то же. Несколько фактов из истории изучения этого вопроса. В 1918 г. Fahraeus обнаружил, что скорость оседания эритроцитов изменяется у беременных, в последующем он выявил, что СОЭ изменяется также при многих заболеваниях. Вестергрен в 1926 г. и Уинтроп 1935 г. разработали методы, которые и сейчас используют в клинической практике для определения СОЭ.
Скорость оседания эритроцитов (СОЭ) — неспецифический лабораторный показатель крови, отражающий соотношение фракций белков плазмы. Раньше этот показатель носил название «реакция оседания эритроцитов» (РОЭ). Это одно и то же. Несколько фактов из истории изучения этого вопроса. В 1918 г. Fahraeus обнаружил, что скорость оседания эритроцитов изменяется у беременных, в последующем он выявил, что СОЭ изменяется также при многих заболеваниях. Вестергрен в 1926 г. и Уинтроп 1935 г. разработали методы, которые и сейчас используют в клинической практике для определения СОЭ.
Повторю, что СОЭ — это высокочувствительный, но неспецифичный и нестабильный показатель воспаления. На результаты определения СОЭ влияют возраст, пол, уровень фибриногена, ревматоидного фактора (РФ), анемия и другие факторы. Эту фразу следует понимать так, что повышение СОЭ укажет на наличие какого-то воспаления в организме (инфекционного или нет), НО не ответит на вопрос — КАКОЕ ИМЕННО ВОСПАЛЕНИЕ И ГДЕ?
На сегодняшний день рекомендуется международный метод определения СОЭ по Вестергрену как наиболее чувствительный.
Верхняя граница СОЭ в норме по Вестергрену зависит от возраста и пола, рассчитывается по формуле:
- для женщин СОЭ (мм/час)=(возраст в годах+10)/2;
- для мужчин СОЭ (мм/час) = (возраст в годах)/2
Теперь коснусь значения определения СОЭ у ревматологических больных. СОЭ рекомендовано определять у всех пациентов при подозрении на ревматологическое заболевание. Да и вообще определение СОЭ входит в «золотой стандарт» обследования при подозрении на множество различных заболеваний, как ревматических, так и других (инфекционных и нет).
Увеличение СОЭ служит лабораторным классификационным критерием ревматоидного артрита. Повышение СОЭ>50 мм/час является критерием гигантоклеточного артериита. Повышение СОЭ>35 мм/час является диагностическим признаком ревматической полимиалгии. Рекомендуемая кратность определения СОЭ при установленном диагнозе составляет 1 раз в 1-3 месяца.
 C-реактивный белок (СРБ) – классический острофазовый белок плазмы крови, который рассматривается как наиболее чувствительный лабораторный маркер инфекции, воспаления и тканевого повреждения. В зависимости от цели исследования определение концентрации СРБ проводится классическими и высокочувствительными методами. Классические методы количественного анализа СРБ в сыворотке крови (радиальная иммунодиффузия, иммунотурбидиметрия и иммунонефелометрия) предназначены для выявления повышенного уровня СРБ при остром воспалении и тканевом повреждении в пределах диапазона концентраций 5-500 мг/л.
C-реактивный белок (СРБ) – классический острофазовый белок плазмы крови, который рассматривается как наиболее чувствительный лабораторный маркер инфекции, воспаления и тканевого повреждения. В зависимости от цели исследования определение концентрации СРБ проводится классическими и высокочувствительными методами. Классические методы количественного анализа СРБ в сыворотке крови (радиальная иммунодиффузия, иммунотурбидиметрия и иммунонефелометрия) предназначены для выявления повышенного уровня СРБ при остром воспалении и тканевом повреждении в пределах диапазона концентраций 5-500 мг/л.
Высокочувствительный анализ СРБ (вчСРБ), основанный на усилении аналитической чувствительности иммунохимических методов (иммуноферментного, иммунотурбидиметрического и иммунонефелометрического) в 10 и более раз с помощью специальных реагентов, позволяет измерять концентрации СРБ ниже 5 мг/л и используется для оценки базального уровня вчСРБ и связанного с ним риска сердечно-сосудистых катастроф. Индивидуальная концентрация СРБ достаточно стабильна и не подвержена суточным изменениям.
Нормальный уровень СРБ у взрослых составляет менее 5 мг/л (однако значения, превышающие 3 мг/л, могут указывать на высокий риск развития сердечно-сосудистой патологии); у новорожденных (до 3 недель) – менее 4,1 мг/л; у детей – менее 2,8 мг/л.
Определение СРБ является полезным тестом для оценки активности патологического процесса у больных ревматическими заболеваниями. СРБ входит в критерии ревматоидного артрита. Увеличение концентрации СРБ может говорить о развитии рентгенологических изменений, свидетельствующих о тяжелом деструктивном поражении суставов при раннем ревматоидном артрите. Рекомендуемая кратность определения СРБ составляет 1 раз в 1-3 месяц.

Среди многочисленных маркеров воспаления, исследованных за последнее десятилетие, высокочувствительный С-реактивный белок является наиболее полно изученным в полном спектре популяций: от практически здоровых до пациентов с факторами риска ССЗ, стабильной стенокардией и ОКС. Физиологическая роль С-реактивного белка ясна не полностью, но его свойства относятся к неспецифическим защитным механизмам. В ответ на повреждение миокарда или местное воспаление, С-реактивный белок синтезируется гепатоцитами, стимулируемыми различными цитокинами [158, 159]. Кроме того, существуют некоторые данные, позволяющие предположить местное высвобождение С-реактивного белка из атеросклеротических бляшек. У больных с ИМ повышению уровня С-реактивного белка также способствует острый воспалительный процесс, индуцированный повреждением миокарда [119, 147].
Результаты нескольких эпидемиологических исследований показали, что повышения концентраций высокочувствительного С-реактивного белка в пределах референтного интервала связаны с повышенным риском развития ИМ, инсульта, поражения периферических артерий и ВСС у практически здоровых мужчин и женщин [160-163]. Эти данные сочетаются с данными фундаментальных исследований, подтверждающими, что воспаление играет важную роль в запуске и прогрессии атеросклероза. Однако в сравнительных исследованиях С-реактивный белок мало добавил к прогностическим данным, получаемым в результате проведения анализа традиционных факторов риска, включая ХС ЛПНП [164-167].
В приложении к ОКС результаты большого числа исследований с включением тысяч больных подтвердили, что изменения уровня высокочувствительного С-реактивного белка предопределяют развитие сердечно-сосудистых осложнений, развивающихся в краткосрочной, а также долгосрочной перспективе. Связь величины высокочувствительного С-реактивного белка с риском смерти у больных с ОКС оказалась независима от выбора стратегии лечения, и предикативная информация была инкрементна по отношению к шкале рисков TIMI и другим биохимическим маркерам. Существуют также твердые доказательства того, что среди больных с ОКС без повышения уровней тропонинов повышение уровня С-реактивного белка указывает на наличие риска [119, 168, 169]. Исследование FRISC подтвердило, что смертность связана с повышением уровня С-реактивного белка в момент знакового явления и что он продолжает расти в течение нескольких следующих лет [119, 168-174].
Поскольку С-реактивный белок не является «пассивным наблюдателем», а играет активную роль в прогрессии атеросклероза, исследования уровня высокочувствительного С-реактивного белка могут быть полезными для таргетной (целенаправленной) терапии. И действительно, результаты нескольких исследований продемонстрировали, что эффект агрессивного снижения уровня липидов статинами наиболее эффективен для больных, у которых ЛПНП были снижены ниже 70 мг/л и высокочувствительный С-реактивный белок ниже 2 мг/л [175-177]. После терапии высокими дозами статинов внутрисосудистое УЗИ может обнаружить даже регрессию бляшек, с наибольшим их уменьшением у тех пациентов, у кого уровни и ЛПНП, и С-реактивного белка были ниже средних значений [178]. Следовательно, существуют значимые доказательства того, что анализ высокочувствительного С-реактивного белка должен применяться для выявления тех пациентов, для кого применение ингибиторов ГМГ-КоА-редуктазы может быть наиболее благотворным.
Точно так же, как в случае классификации пациентов со стабильной стенокардией или в рамках первичной профилактики, значения концентрации высокочувствительного С-реактивного белка ниже 1 мг/дл выявляются у больных с низкой степенью риска, в пределах 1-3 мг/дл — у больных с умеренной степенью риска и выше 3 мг/дл — у больных высокого риска. Для оценки рисков в острой фазе ОКС в прогностических целях должно использоваться значение верхней границы, равное 10 мг/л [179].
Источник: Кэмм А. Джон, Люшер Томас Ф., Серруис П.В., «Болезни сердца и сосудов.Часть 4 (Главы 16-19)» 2011
А так же в разделе « МАРКЕРЫ ВОСПАЛЕНИЯ »
- ЖАЛОБЫ И АНАМНЕЗ
- ОСМОТР
- ЭЛЕКТРОКАРДИОГРАФИЯ
- БИОХИМИЧЕСКИЕ МАРКЕРЫ
- МАРКЕРЫ НЕКРОЗА МИОКАРДА
- БИОХИМИЧЕСКАЯ ДИАГНОСТИКА ИНФАРКТА МИОКАРДА
- ТРОПОНИНЫ И СТРАТИФИКАЦИЯ РИСКОВ
- ОСОБЕННОСТИ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ТРОПОНИНОВ
- ВНЕСЕРДЕЧНЫЕ ПРИЧИНЫ ПОВЫШЕНИЯ УРОВНЯ СЕРДЕЧНЫХ ТРОПОНИНОВ
- МАРКЕРЫ МИОКАРДИАЛЬНОГО СТРЕССА (НАТРИЙУРЕТИЧЕСКИЕ ПЕПТИДЫ)
- АНАЛИЗ «НА МЕСТЕ»
- КОМПЛЕКСНЫЙ БИОХИМИЧЕСКИЙ АНАЛИЗ В КЛИНИЧЕСКОЙ ПРАКТИКЕ
- НОВЫЕ БИОХИМИЧЕСКИЕ МАРКЕРЫ
- МЕТОДЫ ВИЗУАЛИЗАЦИИ ПРИ ОСТРОМ КОРОНАРНОМ СИНДРОМЕ
- СТРАТИФИКАЦИЯ РИСКА ПРИ ОСТРОМ КОРОНАРНОМ СИНДРОМЕ БЕЗ ПОДЪЕМА СЕГМЕНТА SТ
- СТРАТИФИКАЦИЯ РИСКА ПРИ ОСТРОМ КОРОНАРНОМ СИНДРОМЕ С ПОДЪЕМОМ СЕГМЕНТА SТ
- ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
В статье освещены методы визуализации сосудистого воспаления при артериите Такаясу
Введение
Артериит Такаясу (АТ), несмотря на несколько более высокие показатели выживаемости по сравнению с другими системными васкулитами [1], характеризуется высокой частотой развития нефатальных острых и хронических ишемических осложнений болезни (инсульт, сердечная недостаточность, вазоренальная гипертензия и др.), приводящих к стойкой утрате трудоспособности и способности к самообслуживанию [2].
Высокая частота ишемических осложнений АТ в большинстве диагностированных случаев обусловлена неадекватной по интенсивности и продолжительности иммуносупрессивной терапией, что во многом связано с отсутствием высокочувствительных и специфических методов динамической оценки сосудистого воспаления. В частности, клинические признаки активного сосудистого воспаления (например, боли в проекции сонных артерий) встречаются менее чем у 20% больных АТ и не могут служить надежным критерием активности болезни. Что касается таких общепринятых лабораторных маркеров воспаления, как СОЭ и СРБ, то и они не являются достаточно информативными в диагностике сосудистого воспаления при АТ, что было продемонстрировано в крупном проспективном международном исследовании [3]. Малоинформативными в диагностике воспаления сосудов оказались такие инструментальные радиоизотопные методы, как сцинтиграфия с Ga-67 [4] и In-111 [5], на которые возлагались особые надежды.
Среди инструментальных методов диагностики сосудистого поражения при артериите Такаясу одно из ведущих мест принадлежит ультразвуковому дуплексному сканированию артерий [6–8]. Дуплексное сканирование артерий позволяет оценить степень гемодинамических нарушений в режиме цветового допплеровского картирования и спектральной допплерографии, а также состояние артериальной стенки (по толщине комплекса интима-медиа). Наиболее характерной ультразвуковой картиной поражения артерии при АТ является равномерное концентрическое сужение сосуда без признаков кальцификации (рис. 1), более редкими типами поражений артерии являются дилатация и аневризма [6–8]. Основные преимущества ультразвукового сканирования артерий – относительно высокая информативность (в особенности на поздних стадиях болезни), доступность и относительная низкая стоимость метода. Тем не менее, несмотря на вышесказанное, многими крупными исследователями подчеркивается, что УЗИ артерий имеет ряд серьезных недостатков как для диагностики, так и для мониторинга АТ. К таким недостаткам можно отнести невозможность ранней диагностики сосудистого воспаления, когда еще не возникли ремоделирование стенки сосуда, невозможность оценить наличие остаточного сосудистого воспаления, а также трудности в сканировании некоторых артерий (средний сегмент подключичных артерий, грудная часть аорты, легочные и коронарные артерии) [8]. 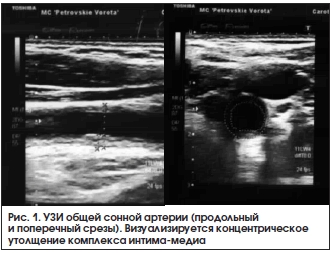
Для комплексной оценки всего древа магистральных артериальных сосудов, включая труднодоступные для УЗИ участки артериального русла, используется традиционная рентгеноконтрастная ангиография, а также такие современные неинвазивные методы, как КТ-ангиография [8–11] и МР-ангиография [8, 12, 13]. Несмотря на то что традиционная ангиография остается «золотым стандартом» визуализации артериального сосудистого русла, данный метод имеет целый ряд недостатков [7, 8, 14, 15]:
1) инвазивность;
2) высокая лучевая нагрузка;
3) малоинформативность на ранней стадии АТ или при вялотекущем воспалительном процессе;
4) невозможность определить характер поражения сосудистой стенки: воспалительное поражение отличить от интраваскулярного тромба или кальцифицированной атеромы, что в конечном итоге не позволяет дифференцировать острое внутристеночное воспаление и хроническое стенотическое поражение.
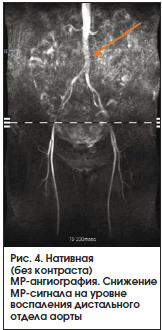
В настоящее время во многих отечественных и зарубежных клинических центрах вместо традиционной ангиографии используется КТ-ангиография (рис. 2) или МР-ангиография, в т. ч. без контрастной МРТ в «сосудистом режиме» (рис. 3 и 4) [8]. Основными преимуществами данных методов являются: неинвазивность, для КТ-ангиографии – относительно низкая лучевая нагрузка и для МР-ангиографии – отсутствие лучевой нагрузки, а также способность оценить толщину сосудистой стенки, визуализировать расслаивающие аневризмы или сформировавшийся тромб [9]. Тем не менее данные методы, так же как и ангиография, не способны визуализировать ранние этапы сосудистого воспаления или, напротив, остаточный воспалительный процесс у больных с длительно текущим заболеванием [6–8].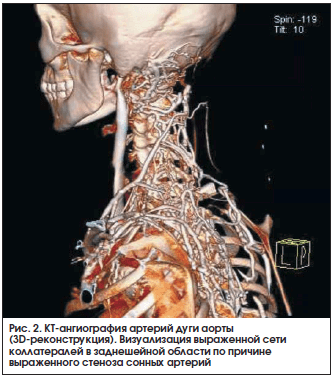

В связи с вышесказанным активно проводится поиск новых технологий, позволяющих, в первую очередь, оценить наличие или отсутствие воспаления стенки артерии. В прошлом для достижения этой цели использовались такие радионуклидные методы, как сцинтиграфия с In-111 [12] и Ga-67 [6]. Однако практическое использование этих диагностических методов оставалось ограниченным в связи с их недостаточной чувствительностью. В последние годы более перспективной в оценке сосудистого воспаления принято считать позитронно-эмиссионную томографию (ПЭТ) с 18F-фтордезоксиглюкозой (18F-ФДГ) [6–8, 16, 17]. В основе данного метода лежит повышенное потребление глюкозы макрофагами. При проведении ПЭТ пациенту внутривенно вводится глюкоза с радиоактивной меткой (18-й изотоп фтора) и при наличии артериита в проекции аорты и/или ее ветвей регистрируется повышенное накопление радиофармпрепарата (рис. 5). Таким образом, ПЭТ позволяет визуализировать очаги воспаления в артериальной стенке вне зависимости от степени стеноза артерии, что, по мнению многих специалистов, является преимуществом данного метода по сравнению с УЗИ или ангиографией как на ранних, так и на поздних стадиях болезни [6, 7, 16, 17]. Однако большими минусами данного метода являются его труднодоступность, высокая стоимость и лучевая (радиоизотопная) нагрузка.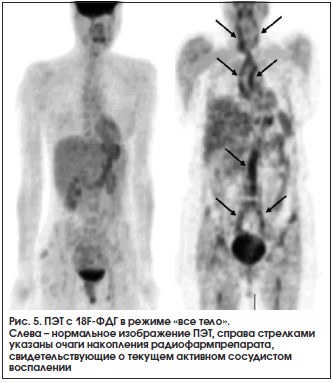
Цель исследования: оценить возможности современной МР-ангиографии для визуализации сосудистого поражения при артериите Такаясу.
Материал и методы
Исследование проводили И.О. Смитиенко, Е.В. Атясова, П.И. Новиков на протяжении 28 мес. 44 пациентам (средняя длительность болезни 7,5 года) с подтвержденным диагнозом «артериит Такаясу» (39 женщин и 5 мужчин; средний возраст 36 лет) было проведено исследование аорты и ее магистральных ветвей (преимущественно артерий дуги аорты); только 22 МР-ангиографии (5%) было выполнено с контрастным усилением. Исследование проводилось на аппарате Magnetom ES- SENZA 1,5 Тесла (Siemens) с использованием последова- тельностей с тонкими срезами space с толщиной среза 0,9–1,2 мм в режиме Т2 (с подавлением и без подавления жира); Т1-взвешенные последовательные DIXON 3D с толщиной среза 1 мм в двух режимах (с подавлением воды и с подавлением жира); бесконтрастная МР-ангиография в режиме 3D-TOF с толщиной среза 0,4 мм. Все исследова- ния проводил и оценивал один и тот же специалист по лучевой диагностике (Е.В. Атясова). Проводилась оценка как гемодинамических нарушений, возникающих в результате артериита Такаясу, так и степени (интенсивности) отека сосудистой стенки, что служило косвенным признаком активности васкулита (рис. 6). Именно визуализация и интерпретация интенсивности отека стенки аорты или магистральных артерий как показателя их воспаления являлись основой нашего исследования, по этой причине мы старались не злоупотреблять излишним удорожанием МР-ангиографии за счет контрастного усиления, т. к. применение контраста не улучшало визуализацию стенки сосудов несмотря на более четкую оценку гемодинамических изменений. У 26 пациентов (59%) выполнялась динамическая оценка МР-ангиографии в течение времени исследования с интервалами в 3, 6 и 12 мес., а также проводилось сопоставление МР-ангиографии с данными УЗИ, ПЭТ с 18F-ФДГ, острофазовыми показателями. 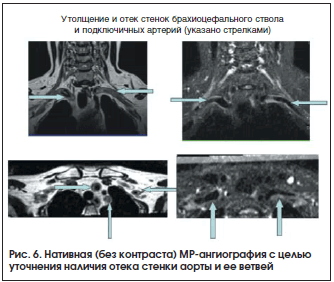
Результаты
В большинстве (62 исследования; 56%) интерпретаций МРТ мы визуализировали выраженный отек сосудистой стенки, что достоверно коррелировало с клинико-лабораторной картиной, динамическим ухудшением УЗ-картины стенки артерий и/или воспалением, по данным ПЭТ.
В 44 (39,5%) случаях МР-ангиографий мы фиксировали незначительную (остаточную?) степень отека сосудистой стенки в рамках вялотекущего воспалительного процесса, как правило, при нормальных значениях СОЭ и/или СРБ и минимальных воспалительных очагах, по данным ПЭТ. Именно эта группа пациентов расценивалась нами как наиболее перспективная для снижения интенсивности иммуносупрессивной терапии, однако у всех 11 пациентов, которым мы пробно проводили планомерное уменьшение дозировок иммуносупрессантов, отмечался рецидив болезни. В связи с этим возможно предположить, что наличие даже незначительного отека стенки аорты или магистральных артерий является фактором вероятного рецидива болезни при снижении активности проводимой терапии. Обращало на себя внимание, что в 3-х случаях МР-ангиография при регистрации минимальной степени отека сосудистой стенки имела расхождение с клинико-лабораторной или ПЭТ-картиной болезни, указывающей на текущее умеренное сосудистое воспаление.
Только в 5 (4,5%) случаях мы отмечали стойкое отсутствие отека сосудистой стенки, что полностью совпадало как с лабораторной ремиссией (нормальные значения СОЭ и СРБ), так и отсутствием признаков воспаления по данным ПЭТ.
Выводы
Приводим предварительные итоги нашей работы.
– МР-ангиография в целях оценки гемодинамических нарушений и состояния сосудистой стенки предположительно является информативным малоинвазивным методом визуализации аневризматических, стенотических и воспалительных изменений аорты и ее магистральных ветвей.
– МР-ангиография может быть использована как для диагностики, так и для мониторинга артериита Такаясу.
– Для повышения информативности оценки сосудистых изменений, в особенности у пациентов с длительным течением артериита Такаясу или нетипичной картиной болезни, рекомендовано сочетание различных методов визуализации.
