Механизм развития артериальной гиперемии в очаге воспаления
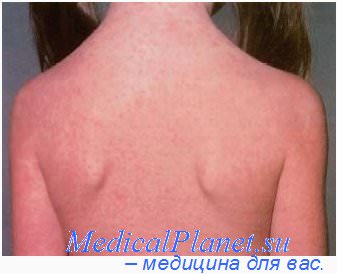
Артериальная гиперемия
Артериальной гиперемией (греч. «hyper» – сверх, «haema» – кровь) называется состояние повышенного кровенаполнения органа и ткани, возникающее в результате усиленного притока крови к ним по расширенным артериям.
Артериальная гиперемия может быть местной и общей.
Общее артериальное полнокровие развивается при значительном увеличении объема циркулирующей крови – например, при эритроцитозе. Патологическая артериальная гиперемия возникает также в условиях гипертермии при перегревании организма, при лихорадке у больных с инфекционными заболеваниями, при быстром падении барометрического давления.
Артериальная гиперемия может носить острый, преходящий характер, может быть часто повторяющейся, хронической.
Различают физиологические и патологические артериальные гиперемии.
При физиологической артериальной гиперемии усиление кровотока адекватно возросшим потребностям органа или ткани в кислороде и энергетических субстратах. Примерами физиологической артериальной гиперемии могут служить рабочая гиперемия, когда к усиленно работающему органу увеличивается приток крови, и гиперемия лица, появляющаяся при чувстве радости, гнева, стыда.
Патологическая артериальная гиперемия возникает вне зависимости от метаболических потребностей органа.
По особенностям этиологических факторов и механизмов развития выделяют следующие разновидности патологических артериальных гиперемий:
1) нейропаралитическую;
2) нейротоническую;
3) постишемическую;
4) вакатную;
5) воспалительную;
6) коллатеральную;
7) гипермию вследствие артериовенозного свища.
В основе патогенеза артериальных гиперемий лежат следующие механизмы:
1) миопаралитический;
2) нейрогенный (ангионевротический).
Миопаралитический механизм связан со снижением миогенного тонуса сосудов под влиянием метаболитов (лактата, пуринов, пировиноградной кислоты и др.), медиаторов, внеклеточного увеличения концентрации калия, водорода и других ионов, уменьшения содержания кислорода. Это самый частый механизм развития артериальной гиперемии. Он лежит в основе постишемического, воспалительного, физиологического рабочего артериального полнокровия.
Сущность нейрогенного механизма состоит в изменении нейрогенных констрикторных и дилататорных влияний на сосуды, приводящих к снижению нейрогенного компонента сосудистого тонуса. Данный механизм лежит в основе развития нейротонической, нейропаралитической гиперемии, а также воспалительного артериального полнокровия при реализации аксон-рефлекса.
Нейротоническая артериальная гиперемия возникает при повышении тонуса парасимпатических или симпатических холинергических сосудорасширяющих нервов или при раздражении их центров опухолью, рубцом и т. д. Этот механизм наблюдается только в некоторых тканях. Под влиянием симпатических и парасимпатических вазодилататоров артериальная гиперемия развивается в поджелудочной и слюнной железах, языке, кавернозных телах, коже, скелетных мышцах и др.
Постишемическая артериальная гиперемия представляет собой увеличение кровотока в органе или ткани после временного прекращения кровообращения. Подобная артериальная гиперемия возникает, в частности, после снятия жгута с конечности, быстрого удаления асцитической жидкости. Реперфузия способствует не только положительным изменениям в ткани. Приток большого количества кислорода и усиленное его использование клетками приводят к интенсивному образованию перекисных соединений, активации процессов перекисного окисления липидов и, как следствие, прямому повреждению биологических мембран и свободно-радикальному некробиозу.
Вакатная (лат. «vacuus» – пустой) гиперемия наблюдается при уменьшении барометрического давления над какой-либо частью тела. Данный вид гиперемии развивается при быстром освобождении от сдавления сосудов брюшной полости, например, при стремительном разрешении при родах, удалении опухоли, сдавливающей сосуды, или быстрой эвакуации асцитической жидкости.
Воспалительная артериальная гиперемия возникает под действием вазоактивных веществ (медиаторов воспаления), вызывающих резкое снижение базального тонуса сосудов, а также вследствие реализации в зоне альтерации нейротоничеекого, нейропаралитического механизмов и аксон-рефлекса.
Коллатеральная артериальная гиперемия носит приспособительный характер и развивается вследствие рефлекторного расширения сосудов коллатерального русла при затруднении притока крови по магистральной артерии.
Гиперемия вследствие артериовенозного свища может развиться при повреждении артериальных и венозных сосудов в результате образования соустья между артерией и веной. При этом артериальная кровь под давлением устремляется в венозное русло, обеспечивая артериальное полнокровие.
Для артериальной гиперемии характерны следующие изменения микроциркуляции:
1) расширение артериальных сосудов;
2) увеличение линейной и объемной скоростей кровотока в микрососудах;
3) повышение внутрисосудистого гидростатического давления, увеличение количества функционирующих капилляров;
4) усиление лимфообразования и ускорение лимфообращения;
5) уменьшение артериовенозной разницы по кислороду.
К внешним признакам артериальной гиперемии относится покраснение зоны гиперемии, обусловленное расширением кровеносных сосудов, увеличением количества функционирующих капилляров и повышением содержания оксигемоглобина в венозной крови. Артериальная гиперемия сопровождается местным повышением температуры, что объясняется усиленным притоком более теплой артериальной крови и повышением интенсивности обменных процессов. Вследствие возрастания крове– и лимфонаполнения зоны гиперемии происходит увеличение тургора (напряжения) и объема гиперемированной ткани.
Данный текст является ознакомительным фрагментом.
Похожие главы из других книг:
1. Гиперемия
Артериальная гиперемия не имеет большого значения. Венозная гиперемия выражается в повышенном кровенаполнении ткани, имеет значение затруднение оттока крови, в то время как артериальный приток не меняется или несколько снижен.Венозная гиперемия может быть
39. Артериальная гипертония. Артериальная гипотония
Первичная артериальная гипертония (гипертоническая болезнь) – заболевание, характеризующееся стойким повышением артериального давления.IA стадия – транзиторное повышение систолического давления до 130–150 мм рт. ст.
14. Артериальная гиперемия
Артериальной гиперемией называется состояние повышенного кровенаполнения органа и ткани, возникающее в результате усиленного притока крови к ним по расширенным артериям.Общее артериальное полнокровие развивается при значительном
15. Венозная гиперемия
Венозная гиперемия – это состояние повышенного кровенаполнения органа или ткани, обусловленное затрудненным оттоком крови по венам. Венозное полнокровие может быть местным и распространенным. Местное венозное полнокровие возникает при
10. Гиперемия
Венозная гиперемия может быть местной и общей.При быстро развивающемся венозном застое возникает отек ткани, но он образуется не во всех тканях, а в полостях и тех органах, где имеется пространство для размещения жидкости (в почках и печени).Транссудат
Венозная гиперемия
Венозная гиперемия – это состояние повышенного кровенаполнения органа или ткани, обусловленное затрудненным оттоком крови по венам.Венозное полнокровие может быть местным и распространенным. Местное венозное полнокровие возникает при затруднении
Локальная гиперемия
Знание основных форм воспаления кожи с относящимися к ним лекарственными средствами является основой для назначения терапии при определенных клинических формах болезней. Многообразные формы эритемы — скарлатинозная, ожоговая, рожистое воспаление
Артериальная гипертония
• Общий холестерин, ЛПВП, ЛПНП• Лептин• Протромбиновое время• Протромбиновый индекс• Фибриноген• Ренин• Ангиотензин• Альдостерон• К, Na, Cl сыворотки• Магний• Кортизол• Адреналин• Норадреналин• АКТГ• Т
Глава 2
Артериальная гипертензия или артериальная гипертония? И вообще, что это такое?
На самом деле это слова-синонимы. Традиционно в России говорят «гипертония». Все это из-за того, что дореволюционная медицинская школа восходила к немецким традициям, все врачи
Артериальная гипотензия
Артериальная гипотензия (гипотония) – это понижение по сравнению с нормой артериального давления.
Нижней границей нормы систолического (максимального) давления для детей 10–16 лет условно считают 100 мм рт. ст., диастолического (минимального)
ГИПЕРЕМИЯ — ВАКУУМНОЕ РАЗРЯЖЕНИЕ
Вакуумное разряжение в настоящее время переживает невиданный взлет популярности по обе стороны Атлантического океана из-за гарантии надежности сексуальной активности. Основной принцип такого метода весьма прост. Создавая низкое
АРТЕРИАЛЬНАЯ ГИПЕРТОНИЯ
Петрушечное молоко.Об этом рецепте для лечения артериальной гипертонии я узнала много лет назад от девушки-студенки.Корни петрушки хорошо промыть,поскоблить и мелко нарезать. На 1 стакан нарезанных корней добавить 2 стакана молока, затем смесь
Артериальная гипертензия
Очень часто больные сахарным диабетом страдают артериальной гипертензией, так как в результате основного заболевания развиваются ожирение, поражение почек и другие осложнения.Основная причина гипертензии – слишком большое употребление соли.
Артериальная гипотония (первичная артериальная гипотензия)
Заболевание характеризуется понижением систолического давления ниже 100 мм рт. ст., диастолического — ниже 60 мм рт. ст.Различают физиологическую гипотензию, без признаков патологии (жалоб нет, трудоспособность
Оглавление темы «Сосудистые реакции при воспалении.»:
1. Ацетилхолин. Нейропептиды. Цитокины. Интерлейкины.
2. Интерфероны. Хемокины. Лейкокины. Фибронектины.
3. Ферменты в очаге воспаления. Липидные медиаторы воспаления.
4. Образование и эффекты простагландинов и лейкотриенов.
5. Нуклеотиды. Нуклеозиды. Плазменные медиаторы воспаления. Кинины.
6. Факторы системы комплемента. Факторы гемостаза.
7. Изменения функций органов и тканей при воспалении.
8. Ишемия при воспалении. Артериальная гиперемия при воспалении.
9. Венозная гиперемия при воспалении. Стаз при воспалении.
10. Экссудация. Виды эксудата. Причины эксудации.
При воздействии на ткань флогогенного агента, как правило, развивается кратковременное (на несколько секунд) повышение тонуса ГМК стенок артериол и прекапилляров, т.е. локальная вазоконстрикция. Эта первая стадия сосудистых реакций в виде местной вазоконстрикции приводит к нарушению кровотока — ишемии.
Причины ишемии
Причина вазоконстрикции — высвобождение под влиянием альтерирующего фактора БАВ с сосудосуживающим эффектом: катехоламинов, тромбоксана А2, Пг, лейкотриенов. Преходящий характер вазоконстрикции и ишемии объясняется быстрой инактивацией катехоламинов ферментами (главным образом моноаминоксидазой), разрушением Пг и лейкотриенов в реакциях окисления.
Значение ишемии
Значение ишемии состоит в локализации повреждающего влияния флогогенного агента и в препятствии его распространению за пределы очага непосредственного контакта с тканью. Проницаемость стенок микрососудов на этом этапе сосудистых реакций ещё не увеличена.
Ишемия рассмотрена в нашей статье «Нарушения регионарного кровотока».

Артериальная гиперемия при воспалении
Вторая стадия сосудистых реакций в виде расширения просвета артериол и прекапилляров приводит к артериальной гиперемии — увеличению притока артериальной крови и кровенаполнения ткани.
Механизмы артериальной гиперемии
Из механизмов, приводящих к развитию артериальной гиперемии, важное значение имеют нейрогенный, гуморальный и миопаралитический.
Нейрогенный механизм артериальной гиперемии
Нейрогенный механизм (холинергический по своему существу) развития артериальной гиперемии характеризуется:
• увеличением высвобождения парасимпатическими нервными окончаниями ацетилхолина;
• повышением чувствительности холинорецепторов к ацетилхолину, что, как правило, наблюдается в условиях избытка внеклеточного содержания К+ и Н+ (характерно для очага воспаления).
Гуморальный механизм артериальной гиперемии
Гуморальный компонент механизма развития артериальной гиперемии заключается в местном увеличении образования медиаторов с сосудорасширяющим действием: кининов, ПгЕ, Пг1, аденозина, оксида азота, гистамина.
Миопаралитический механизм артериальной гиперемии заключается в уменьшении базального тонуса артериол.
Пролонгированный характер артериальной гиперемии, нередко наблюдающийся при воспалении, обусловлен избыточным синтезом указанных веществ, повышением чувствительности тканей в очаге воспаления к ним, замедленной инактивацией БАВ при воспалении, снижением базального тонуса артериол (так называемый миопаралитический эффект).
Значение и последствия артериальной гиперемии
При артериальной гиперемии к тканям увеличивается приток кислорода, субстратов метаболизма и в связи с этим возрастает фильтрационное давление. Последнее в регионе артериальной гиперемии ведёт к некоторому повышению объёма межклеточной жидкости с низким содержанием белка (транссудата). Одновременно происходят активация обмена веществ и синтеза новых клеточных и неклеточных структур взамен повреждённых или погибших.
В то же время чрезмерная и/или затянувшаяся артериальная гиперемия может создать условия для оттока из очага воспаления токсичных соединений, микроорганизмов, БАВ и попаданию их в общий кровоток. Длительное расширение артериол и прекапилляров может сочетаться также с постепенно нарастающим повышением проницаемости стенок микрососудов под влиянием медиаторов воспаления, образующихся в очаге воспаления. Жидкость и содержащиеся в ней белки из просвета микрососудов выходят во внесосудистое пространство — начинает образовываться экссудат.
— Читать далее «Венозная гиперемия при воспалении. Стаз при воспалении.»
При воспалении реакция сосудов стереотипна и развивается в 4 стадии:
1.Кратковременный преходящий спазм артериол и прекапилляров, сопровождающиеся развитием ишемии.
2.Расширение артериол, сопровождающееся ускорением кровотока и развитием артериальной гиперемии.
3.Дальнейшее расширение сосудов и замедление кровотока с развитием венозной гиперемии.
4.Развитие стаза и остановка кровотока.
Начальный спазм сосудов отчетливо выражен при быстро развивающемся повреждении (ожог, травма) и менее заметен при постепенном развитии повреждения (инфекционный процесс). Причиной вазоконстрикции является выделение под влиянием повреждающего фактора сосудосуживающих БАВ: катехоламинов из симпатических нервных окончаний, тромбоксана А2 из тромбоцитов, эндотелина-1 из поврежденных эндотелиоцитов. Кратковременность ишемии обусловлена быстрой инактивацией этих эффекторов и накоплением вазодилататоров.
Расширение артериол, метартериол и прекапиллярных сфинктеров возникает в результате воздействия вазодилататоров: гистамина, кининов, оксида азота и PgI2 (простациклина). В результате скорость кровотока в микро-циркуляторном русле повышается, возрастает количество функционирующих капилляров, увеличивается кровенаполнение тканей, улучшается их оксиге-нация — развивается артериальная гиперемия (см. главу «Нарушение периферического кровотока»). Артериальная гиперемия сохраняется недолго (обычно 10-30 мин) и сменяется венозной гиперемией.
Развитие венозной гиперемии начинается с максимального расширения артериол и прекапиллярных сфинктеров, которые становятся резистентны к сосудосуживающим стимулам, а также с затруднения венозного оттока. Скорость кровотока в микроциркуляторных сосудах падает. Причинами этого состояния являются сдавление венул накапливающимся экссудатом, повышение тонуса их стенок под влиянием гистамина, действующего на Н1-рецепторы. Немаловажную роль в развитии венозной гиперемии имеет изменение реологических свойств крови — повышение ее вязкости в результате выхода жидкой части крови из сосудистого русла при экссудации и «сладжирования» форменных элементов.
Сладж эритроцитов — это прилипание их друг к другу вследствие адсорбции на их поверхности высокомолекулярных глобулинов (белков острой фазы воспаления), что снижает их поверхностный потенциал. Агрегаты эритроцитов формируют структуры напоминающие монетные столбики, которые значительно затрудняют кровоток. Накопление лейкоцитов у стенок посткапилляров и венул в процессе маргинации также способствует замедлению тока крови.
Закономерное развитие причин венозной гиперемии, приводит к стазу и прекращению кровотока в очаге воспаления.
Экстравазация жидкости ( экссудация )
Отличительной особенностью сосудистых изменений при воспалении является значительное повышение сосудистой проницаемости и выход богатой белками жидкости (экссудата) в ткани. Потеря белков плазмой крови приводит к снижению внутрисосудистого онкотического давления и повышению онкотического давления интерстициальной жидкости. Совместно с повышением гидростатического давления в расширенных сосудах, это приводит к значительному оттоку жидкости в ткани и формированию отека.
Повышение проницаемости сосудистой стенки при остром воспалении развивается в 3 фазы, каждая из которых обусловлена различными механизмами.
1. Ранняя преходящая фаза возникает вскоре после повреждения и продолжается 15-30 минут. Механизм повышения сосудистой проницаемости заключается в сокращении эндотелиоцитов и формировании промежутков между ними. Развивается эта реакция под действием гистамина, лейкотриенов, простагландинов и кининов в венулах и не затрагивает капилляры и артериолы.
2. Поздняя продленная фаза начинается через 2 часа после повреждения и продолжается 24 часа и более. Повышается проницаемость капилляров и венул. Изменения в микрососудах являются следствием активации эндоте-лиоцитов и обеспечивается цитокинами (ИЛ-1, ФНО, ИФН-γ). Происходит перестройка цитоскелета эндотелиоцитов, что приводит к разрушению межклеточных контактов и втягиванию цитоплазматических отростков с образованием щелей между соседними эндотелиоцитами. Важное значение имеет усиление транспорта через эндотелиоциты — трансцитоза за счет увеличения количества специфических транспортных органелл.
3.Раннее стойкое повышение проницаемости возникает вследствие прямого повреждения эндотелия, некроза эндотелиоцитов и их отделения от базальной мембраны. Подобная ситуация часто встречается при значительной альтерации в результате ожогов или инфекции экзотоксинпродуцирующими возбудителями (например, Corynebacterium diphteriae, Str pyogenes). Повышение сосудистой проницаемости развивается сразу после повреждения, продолжается несколько часов и наблюдается в артериолах, капиллярах и венулах.
Жидкость, выходящая из микрососудов при повышении их проницаемости, содержащая большое количество белка и форменные элементы крови формирует экссудат, который накапливается в тканях и/или полостях тела при воспалении. Экссудат следует отличать от транссудата, формирующегося, в основном, в результате повышения гидростатического давления в сосудах без повышения их проницаемости (например, при сердечной недостаточности). Для транссудата характерны удельная плотность < 1.012, отсутствие клеток и содержание белка < 2%; для экссудата — удельная плотность > 1.015, наличие клеток-участников воспаления и содержание белка > 2%.
Клеточный и химический состав экссудата имеет диагностическое значение и зависит от причины воспаления, ткани, в которой развивается воспаление, реактивности организма и ряда других факторов.
Различают следующие типы экссудатов:
Серозный — содержит преимущественно альбумины в умеренной концентрации (3-5%) небольшое количество клеток, образуется на ранних стадиях воспаления.
Катаральный (слизистый) — образуется при воспалении слизистых оболочек воздухоносных путей, ЖКТ. Отличается высоким содержанием муко-полисахаридов и секреторных антител (IgA), содержит лизоцим.
Фибринозный экссудат отличается высоким содержанием фибриногена, что является результатом значительного повышения проницаемости сосудов. При контакте с поврежденными тканями фибриноген превращается в фибрин и выпадает в виде ворсинчатых масс (на серозных оболочках) или пленки (на слизистых), вследствие чего экссудат уплотняется. Если фибринозная пленка расположена рыхло, поверхностно, легко отделяется без нарушения целостности слизистой, такое воспаление называется крупозным. Оно наблюдается в желудке, кишечнике, трахее, бронхах. В том случае, когда пленка плотно спаяна с подлежащей тканью и ее удаление обнажает язвенную поверхность, речь идет о дифтеритическом воспалении. Оно характерно для миндалин, полости рта, пищевода. Такое различие обусловлено характером эпителия слизистой оболочки и глубиной повреждения. Фибринозные пленки могут самопроизвольно отторгаться благодаря аутолизу, развертывающемуся вокруг очага, и демаркационному воспалению и выходить наружу; подвергаться ферментативному расплавлению или организации, т. е. прорастанию соединительной тканью с образованием соединительно-тканных сращений, или спаек. Фибринозный экссудат может наблюдаться при дифтерии, дизентерии, туберкулезе.
Гнойный — содержит большое количество лейкоцитов, фрагменты нек-ротизированных тканей. Образуется чаще всего при инфекциях, вызываемыхпиогенными бактериями (стафилококками, стрептококками, пневмококками
и др.).
Геморрагический — содержит большое количество белка и эритроцитов. Образуется при повреждениях сосудов с разрушением базальной мембраны, характерен для сибирской язвы, гриппозной пневмонии и др.
Смешанные формы экссудата могут быть самыми разнообразными (се-розно-фибринозный, гнойно-фибринозный и др.)
Биологическое значение экссудации состоит в том, что, являясь одним из основных компонентов воспаления как, патологического процесса, она выполняет вместе с тем важную защитную роль, которая заключается прежде всего в локализации воспалительного процесса.
Положительные последствия:
1. Экссудат разбавляет, снижает концентрацию повреждающих агентов и тем самым ослабляет их вредное воздействие.
У новорожденных и эмбрионов, у которых экссудация практически не развивается, воспаление принимает характер альтеративного, проявляется тканевыми дистрофиями и некрозом.
2. С экссудатом в очаг воспаления поступают защитные факторы — иммуноглобулины, факторы свертывания крови и др.
3. Экссудат обладает бактерицидными свойствами.
4. Если в экссудате содержится фибрин, он блокирует лимфатические сосуды и препятствует резорбции и генерализации повреждающих факторов.
Отрицательные последствия:
1. Экссудат может механически смещать органы и ткани, тем самым нарушая их работу (экссудат в плевральной полости, перикарде).
2. Экссудат может сдавливать ткани, обусловливая боль и повреждения (особенно в замкнутых полостях — при артритах, гайморитах, пульпитах и др.).
3. Если происходит потеря экссудата или его удаление при медицинских манипуляциях — это может привести к обезвоживанию и белковому дефициту (при диарее, потере «плазмы» с обожженной кожи, нерациональном пункгировании при плевритах).
4. Резорбция экссудата может сопровождаться интоксикацией.
Скопление в ткани экссудата обусловливает такой внешний местный признак воспаления, как припухлость. Кроме того, наряду с действием брадикинина, гистамина, простагландинов, нейропептидов давление экссудата на окончания чувствительных нервов имеет некоторое значение в возникновении воспалительной боли.
Эмиграция лейкоцитов
Наряду с микроциркуляторными изменениями в очаге воспаления происходят характерные изменения функций ряда клеточных элементов, обусловленные их активацией. Активируются эндотелиоциты, различные популяции лейкоцитов, тромбоциты, клетки соединительной ткани и др. Эти клеточные процессы определяют защитную функцию воспаления.
Для обобщающей характеристики этих процессов приняты термины: эмиграция клеточных элементов, то есть их выход за пределы микрососудов в ткани и пролиферация.
В ходе воспалительной реакции в результате внедрения патогенных возбудителей или повреждения какой-либо другой природы имеет место активация макрофагов.
Это проявляется фагоцитозом и выделением большого количества регуляторных молекул главным образом пептидной природы — цитокинов. Цитокины в свою очередь активируют множество других клеток-мишеней. Цитокины — интерлейкины (ИЛ-1, ИЛ-3, ИЛ-8) и фактор некроза опухолей (ФНО) и др. в очаге воспаления активируют эндотелиоциты и нейтрофилы.
Активация эндотелиоцитов и нейтрофилов под влиянием ИЛ-1 и ФНО проявляется во-первых в появлении на их мембранах особых адгезивных молекул (адгезинов), относящихся к классам селектинов и интегринов. В результате нейтрофилы выходят из кровотока к сосудистой стенке и «прокатывается» по эндотелию, а затем «прилипают» — фиксируются к эндотелиоцитам в местах межэндотелиальных контактов. Потом нейтрофилы формируют псевдоподии, проникающие между эндотелиальными клетками и как бы «переливаясь» в псевдоподии в конце концов выходят за пределы сосудов. «Прокатывание» осуществляется с помощью адгезинов типа селектинов, «прилипание» и прохождение в межэндотелиальные пространства с помощью интегринов.
Неактивированные нейтрофилы и эндотелиоциты взаимодействовать не могут и эмиграция нейтрофилов не происходит.
Наследственный дефект по одному из адгезинов эндотелиоцитов (болезнь неадгезивных лейкоцитов) снижает сопротивляемость организма к инфекционным заболеваниям.
Активация эндотелиоцитов проявляется выделением в кровь нескольких прокоагулянтных факторов и их пролиферацией и при формировании грануляционной ткани.
Состояние активации эндотелиоцитов достигает пика за 4-6 часов после воздействия ИЛ-1 и других активаторов. Исходный уровень активности, в том числе освобождение мембраны от адгезинов, восстанавливается за 24-36 часов, если нет повторных активирующих воздействий.
Мембрана нейтрофила быстро теряет адгезивные молекулы после прохождения нейтрофила через стенку капилляра.
Наряду с адгезивностью, активация нейтрофилов в очаге воспаления проявляется хемотаксисом, фагоцитозом, бактерицидностью и апоптозом — запрограмированной гибелью нейтрофила после его выхода в ткани.
Хемотаксис обусловлен рядом факторов. Это моноцитарный цитокин йнтерлейкин-8 (ИЛ-8), метаболиты арахидоновой кислоты — лейкотриены, активированные компоненты системы комплемента, факторы, продуцируемые базофилами, нейтрофилами, Т-лимфоцитами-эффекторами ГЗТ и мн. др.
Фагоцитоз — важнейший механизм защитного действия воспалительной реакции впервые описанный И.И. Мечниковым.
Бактерицидные механизмы нейтрофила разнообразны. Одним из важнейших является так называемый «респираторный взрыв» — резкое увеличение потребления О2 (в 10-15 раз) и внемитохондриального окисления. Образующиеся при этом свободные радикалы перекиси водорода, супероксидного аниона, гидроксильного радикала, синглетного кислорода повреждают микробы. Особо мощным повреждающим действием обладает система: миелопероксидаза + перекись водорода + галогены.
По современным представлениям, возможно, наиболее важным бактерицидным фактором является радикал NO -.
Хорошо известно бактерицидное действие таких факторов, как лизоцим, катионные белки, лактоферрин. Недавно были изучены пептиды с «антибиотическим» действием, так называемые дефензины.
Экзоцитоз нейтрофилов способствует проявлению их внеклеточной бактерицидности. В результате экзоцитоза, апоптоза выходят также гидролитические лизосомальные ферменты. Это приводит к активации систем ограниченного протеслиза, а также простагландин-тромбоксановой системы и накоплению БАВ . Если ферментов очень много, может происходить расплавление тканевых структур и формирование таких форм гнойного воспаления, как абсцессы и флегмоны.
Преимущественная эмиграция нейтрофилов характерна для начального периода воспаления, они выполняют исключительно важную работу по очистке тканей от патогенных возбудителей и необратимо поврежденных фрагментов самих тканевых структур.
Постепенно начинает преобладать эмиграция моноцитов.Моноцит, покидая сосуд, превращается в экссудативный моноцит-макрофаг, затем в незрелый и зрелый макрофаг. Зрелые макрофаги по структурно-функциональным характеристикам разделяются на фагоцитарные и секреторные макрофаги.
В отличие от нейтрофилов, которые располагаются преимущественно в центре очага воспаления, макрофаги размещаются по периферии, образуя своеобразный вал (предшественник грануляционного вала), отграничивающий очаг воспаления от неповрежденной ткани. Сначала формируется нейтрофильно-макрофагальный вал, затем макрофагальный и наконец, макрофагально-фибробластный вал, который непосредственно трансформируется в грануляционную ткань.
Фагоцитарная активность макрофагов значительно ниже активности нейтрофилов, хотя они, так же как нейтрофилы, осуществляют «респираторный взрыв» и неокислительную бактерицидную активность.
Главной их функцией является отграничение очага воспаления, предотвращение дальнейшей агрессии и создание условий для антигенной стимуляции для Т- иВ-лимфоцитов, тем самым макрофаги участвуют в формировании специфического иммунного ответа на системном уровне.
Выделяя цитокины (ИЛ-1, ФНО, ИЛ-6, ИЛ-8), колониестимулирующие факторы — КСФ и многие другие, макрофаги осуществляют аутокринную (в отношении других макрофагов), паракринную (в отношении других клеток, находящихся в непосредственной близости: эндотелиоцитов, нейтрофилов, лимфоцитов, тромбоцитов и др.) и эндокринную (системную на уровне всего организма) регуляторные функции. Например, ИЛ-1 и ФНО (в несколько меньшей степени) стимулируют тепловой центр — вызывая лихорадку, ИЛ-1 — костный мозг, мобилизуя из костного мозга уже созревшие нейтрофилы в периферическую кровь — эффект в течение 24 часов, ИЛ-1, ИЛ-3, колониестимулирущие факторы усиливают миелопоэз и появление незрелых форм нейтрофилов в крови, ИЛ-1 стимулируют поступление в кровь стрессовых гормонов: кортикотропина и глюкокортикоидов
ПРОЛИФЕРАЦИЯ
Пролиферация — завершающая стадия воспаления — характеризуется увеличением числа стромальных и, как правило, паренхиматозных клеток ,
также образованием межклеточного вещества в очаге воспаления. Эти процессы направлены на регенерацию альтерированных и замещение разрушенных тканевых элементов. Существенное значение на этом этапе воспаления имеют различные БАВ, стимулирующие пролиферацию клеток (митогены).
Пролиферативные процессы при остром воспалении начинаются вскоре после воздействия флогогенного агента на ткань и более выражены по периферии зоны воспаления. Одним из условий оптимального течения пролиферации является затухание процессов альтерации и экссудации.
Размножение соединительнотканных элементов сопровождается активным биосинтезом коллагена. Молодая грануляционная ткань постепенно заменяется зрелой фиброзной, а затем рубцовой тканью.
Таким образом, воспалительная пролиферация постепенно переходит в процесс регенерации, репарации, восстановления ткани, поврежденной или даже разрушенной воспалительной альтерацией.
Однако процесс рубцевания носит обратный, управляемый характер. Дело в том, что при контактном взаимодействии коллагеновые волокна тормозят деление фибробластов и коллагеногенез в них, и даже способствуют деградации и гибели фибробластов.
Коллагенокластические фибробласты, напротив, при контакте с коллагеном стимулируются.
Таким образом, осуществляется обратная связь, приостанавливающая разрастание рубцовой ткани в очаге воспаления и приводящая к обратному развитию грубого фиброзного рубца. Нарушения равновесия в этой системе могут проявиться в недостаточно активном размножении клеток и сниженном биосинтезе коллагена, что клинически проявляется в форме вялотекущих нагноительных процессов и незаживающих трофических язв. Избыточная неконтролируемая активность приводит к грубым деформирующим и нарушающим функции рубцам и склерозированию паренхиматозных органов, например, при хронических инфекционных поражениях (пневмония и склероз легких) или интоксикациях (хронический гепатит и цирроз печени при алкоголизме).
Размножение эндотелиоцитов играет решающую роль в формировании сети грануляционной ткани.
Пролиферация макрофагов наблюдается при ГЗТ и хроническом специфическом инфекционном воспалении, протекающем в форме инфекционных гранулем. Происходит не только деление макрофагов, но и их дифференцировка: они превращаются в эпителиоидные игигантские многоядерные клетки Лангганса.
Пролиферация и дифференцировка фибробластов и эндотелиоцитов стимулируется многочисленными факторами роста, которые продуцируются многими клеточными элементами: макрофагами (ИЛ-1, фактор некроза опухолей, макрофагальный фактор роста и пр.), тромбоцитами (тромбоцитарный фактор роста и др.), эндотелиоцитами, Т-лимфоцитами-эффекторами, а также ростовыми факторами плазмы.
