Модели воспаления на животных
РЕФЕРАТ
На тему: «Экспериментальное моделирование воспаления.»
Выполнили студентки 3 курса
лечебного факультета 7-8 группы
Якимова Анастасия Анатольевна и Кравчук Дарья Александровна
Проверила: Маслова М.В.
г.Рязань, 2016
План:
Цель работы
Задачи работы
Введение
1.Экспериментальные модели воспаления
2. Экспериментальное моделирование периодонтита у
животных
Заключение
Библиографический список
Введение
Воспаление есть патологический процесс, который возникает при повреждении тканей и проявляется нарушением кровообращения, изменением крови и соединительной ткани в виде альтерации, экссудации и пролиферации. В этот, по преимуществу местный процесс, в той или иной степени вовлекается весь организм и прежде всего такие системы как иммунная, эндокринная и нервная. Внешние признаки воспаления известны очень давно. Они сформулированы в знаменитой пентаде Цельса — Галена. Это припухлость (tumor), краснота (rubor), жар (calor), боль (dolor) и нарушение функции (functio laesa). Хотя эти симптомы известны уже более 2000 лет, они не утратили своего значения и сегодня; со временем менялось только их объяснение.
Воспаление является важной проблемой и предметом изучения всех отраслей медицины. Отличие заключается лишь в методах исследования. Например, врач- терапевт наблюдает течение воспаления легких (пневмонии) у постели больного, патологоанатом — при вскрытии трупа, а патофизиолог — в эксперименте на животном. Ученик Вирхова Конгейм (1867 г.) впервые изучил в эксперименте на лягушке кровообращение в брыжейке при воспалении, установив при этом все стадии его от гиперемии до стаза. Конгейм также описал процесс эмиграции лейкоцитов через сосудистую стенку. Экспериментальная модель его широко используется ив настоящее время на практических занятиях со студентами (опыт Конгейма) и в научных исследованиях. В 1920 г. Е. Л. Кларк и Е. Р. Кларк применили следующую методику. На двух противоположных участках кожи уха кролика удалили эпидермис и на его место вставили диски из слюды. Между дисками находился тонкий слой ткани. В таком прозрачном окошке можно было непрерывно наблюдать кровообращение, в том числе и при действии флогогенных (воспалительных) агентов. По этой же методике изучают кровообращение в мозговых оболочках. Позже Селье предложил изучать кровообращение в сосудах защечных мешков хомяка. Раздувая мешки воздухом, можно изучать микроциркуляцию крови в них с помощью микроскопа. Данная методика позволяет изучать этот процесс и в динамике. Сегодня для этого сконструированы совершенные икрокинематографические приспособления.
Важнейшим этапом в изучении воспаления было применение биохимических методик. Одним из первых исследователей, применивших эти методики, был Менкин (1948). В настоящее время выделены многие биологически активные вещества-медиаторы воспаления и детально изучено их действие. С помощью электронной микроскопии, ультрацентрифугирования и других методов получены сведения о биологических мембранах, способствующие раскрытию механизма воспалительного отека, прохождения лейкоцитов через сосудистую стенку, скопления их в очаге воспаления и т. д. Эксперимент важен еще и тем, что с его помощью были детально изучены и внедрены в клинику многие противовоспалительные средства. В изучении воспаления особую роль сыграли эксперименты И. И. Мечникова. Особенность его исследований заключалась в том, что воспаление он рассматривал с эволюционных позиций. И. И. Мечников был первым, кто изучил воспаление в филогенезе, т. е. у животных, стоящих на различных ступенях эволюционного развития. На прозрачной личинке морской звезды, представителе беспозвоночных, он открыл явление фагоцитоза и отвел ему основную роль в динамике воспаления. На основании этих наблюдений была построена теория воспаления, которая вошла в науку под названием сравнительно-патологической или эволюционной. В дальнейшем патологи стали широко использовать эволюционный принцип в экспериментальном моделировании, исходя из того, что патологические явления у низших животных, «представляя условия наиболее простые и первобытные, дают ключ к пониманию сложных патологических явлений, входящих в область медицины» (И. И. Мечников, 1892).
Цель работы: изучить особенности экспериментального моделирования воспаления
Задачи:
1.Моделирование воспаления, исследование этого процесса в динамике (от начала до конца);
2.Разработка принципов экспериментальной терапии с дальнейшим использованием данных эксперимента в клинике.
Экспериментальное моделирование воспаления. История.
Воспаление является важной проблемой и предметом изучения всех отраслей медицины. Отличие заключается лишь в методах исследования. Например, врач-терапевт наблюдает течение воспаления легких (пневмонии) у постели больного, патологоанатом — при вскрытии трупа, а патофизиолог — в эксперименте на животном.
Ученик Вирхова Конгейм (1867 г.) впервые изучил в эксперименте на лягушке кровообращение в брыжейке при воспалении, установив при этом все стадии его от гиперемии до стаза. Конгейм также описал процесс эмиграции лейкоцитов через сосудистую стенку. Экспериментальная модель его широко используется и в настоящее время на практических занятиях со студентами (опыт Конгейма) и в научных исследованиях.
В 1920 г. Е. Л. Кларк и Е. Р. Кларк применили следующую методику. На двух противоположных участках кожи уха кролика удалили эпидермис и на его место вставили диски из слюды. Между дисками находился тонкий слой ткани. В таком прозрачном окошке можно было непрерывно наблюдать кровообращение, в том числе и при действии флогогенных (воспалительных) агентов. По этой же методике изучают кровообращение в мозговых оболочках.
Позже Селье предложил изучать кровообращение в сосудах защечных мешков хомяка. Раздувая мешки воздухом, можно изучать микроциркуляцию крови в них с помощью микроскопа. Данная методика позволяет изучать этот процесс и в динамике. Сегодня для этого сконструированы совершенные микрокинематографические приспособления.
Важнейшим этапом в изучении воспаления было применение биохимических методик. Одним из первых исследователей, применивших эти методики, был Менкин (1948). В настоящее время выделены многие биологически активные вещества-медиаторы воспаления и детально изучено их действие.
С помощью электронной микроскопии, ультрацентрифугирования и других методов получены сведения о биологических мембранах, способствующие раскрытию механизма воспалительного отека, прохождения лейкоцитов через сосудистую стенку, скопления их в очаге воспаления и т. д.
Эксперимент важен еще и тем, что с его помощью были детально изучены и внедрены в клинику многие противовоспалительные средства.
В изучении воспаления особую роль сыграли эксперименты И. И. Мечникова. Особенность его исследований заключалась в том, что воспаление он рассматривал с эволюционных позиций. И. И. Мечников был первым, кто изучил воспаление в филогенезе, т. е. у животных, стоящих на различных ступенях эволюционного развития. На прозрачной личинке морской звезды, представителе беспозвоночных, он открыл явление фагоцитоза и отвел ему основную роль в динамике воспаления. На основании этих наблюдений была построена теория воспаления, которая вошла в науку под названием сравнительно-патологической или эволюционной. В дальнейшем патологи стали широко использовать эволюционный принцип в экспериментальном моделировании, исходя из того, что патологические явления у низших животных, «представляя условия наиболее простые и первобытные, дают ключ к пониманию сложных патологических явлений, входящих в область медицины» (И. И. Мечников, 1892).
ЭТИОЛОГИЯ
Любой повреждающий агент, который по силе и длительности превосходит адаптационные возможности ткани, может вызвать воспаление. Все флогогенные факторы принято делить на внешние и внутренние (эндогенные). К внешним относятся микроорганизмы (бактерии, вирусы, грибы); животные организмы (простейшие, черви, насекомые); химические вещества (кислоты, щелочи); механические (инородное тело, давление, разрыв) и термические воздействия (холод, тепло); лучевая энергия (рентгеновские, радиоактивные, ультрафиолетовые лучи).
К эндогенным факторам относят те, которые возникают в самом организме в результате другого заболевания. Например, воспаление может возникнуть как реакция на опухоль, желчные или мочевые камни, образовавшийся в сосудах тромб. Причиной воспаления могут стать комплексы антиген — антитело, если они фиксируются в каком-либо органе.
ПАТОГЕНЕЗ
Среди множества патогенетических факторов воспаления можно выделить несколько, которые имеют решающее значение, определяют начало процесса, его развитие и исход: повреждение от действия флогогенного агента (первичная альтерация); выброс из клеток биологически активных веществ — медиаторов воспаления; освобождение и активация лизосомальных ферментов, действие ^х на биологические макромолекулы (вторичная альтерация); нарушение микроциркуляции, повышение проницаемости стенки сосудов, экссудация; размножение клеток (пролиферация), восстановление дефекта.
Воспаление всегда начинается с повреждения ткани(первичная альтерация). После воздействия этиологического фактора клетки претерпевают ряд структурных и метаболических изменений. Отмечено набухание митохондрий, просветление их матрикса, дезоргани
зация крист, изменение мембраны эндоплазматической сети, уменьшение числа рибосом, появление в цитоплазме различных включений. В поврежденной ткани повышается осмотическое давление, возникает ацидоз, увеличивается содержание воды. Альтерация касается не только тканевых элементов, но и крови; изменяются ее реологические свойства.
Вслед за первичной наступаетвторичная альтерация. Если первичная альтерация является результатом непосредственного действия воспалительного агента, то вторичная не зависит от этого. Причина состоит в том, что повреждение клеток касается прежде всего их цитолеммы, а также мембраны лизосом. При повреждении лизосом освобождаются заключенные в них ферменты (кислые гидролазы), способные расщеплять все вещества, входящие в состав клетки (белки, нуклеиновые кислоты, углеводы, липиды). Далее эти ферменты, при наличии этиологического фактора или уже без него, продолжают процесс альтерации, а также деструкции, в результате чего образуются биологически активные вещества— медиаторы воспаления.По этой причине лизосомы называют еще «стартовой площадкой» воспаления.
В последнее время изучено свыше 10 биологически активных веществ, участвующих в воспалительной реакции. Их можно разделить на две группы: медиаторы, образующиеся в клетках (клеточные), и медиаторы, образующиеся в жидких средах организма
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
Е.Н. Парийская, кандидат биологических наук, доцент, Л.Б. Захарова, кандидат биологических наук, доцент, О.Г. Орлова, кандидат биологических наук, доцент, О.В. Рыбальченко, доктор биологических наук, профессор, Н.Э. Голованова, кандидат биологических наук, доцент, И.В. Астратенкова, кандидат биологических наук, доцент 188663, Санкт-Петербургский государственный университет, 199034, Российская Федерация, Санкт-Петербург, Университетская наб., д. 7–9 Е-mail: nesh1764@mail.ru
Резюме. В настоящее время лечение гнойных осложнений мягких тканей является одной из самых распространенных проблем в медицинской практике. Постоянно совершенствуются методы воздействия и анализа влияния лекарственных средств на различных моделях гнойных ран животных. Модели, описанные в литературе, не всегда могут успешно воспроизводиться на практике. Рассмотрены несколько вариантов моделирования развития гнойно-воспалительного процесса в кожных ранах у крыс. На 1-м этапе для выбора наиболее эффективного иммуносупрессора проводили сравнительный анализ выживания крыс при воздействии гидрокортизона и метотрексата. Затем в качестве инфицирующих раны микроорганизмов апробировали бактерии 2 видов: Staphylococcus aureus 6 – представитель нормальной микробиоты кожи и Pseudomonas indica 23 – аналог наиболее распространенного вида псевдомонад – возбудителей внутрибольничных инфекций. Инфицирование ран проводили, используя однородную и смешанную суспензию 2 указанных выше бактериальных культур, а также монокультуры в виде биопленок. По результатам проведенных исследований определили наиболее оптимальную модель получения гнойных ран, а именно вариант с применением иммуносупрессии гидрокортизоном. Воздействие гидрокортизона в течение 7 сут (25 мг/кг), в отличие от метотрексата, не приводило к летальности животных. При этом однократное введение суспензионной смешанной бактериальной культуры S. aureus 6 и P. indica 23 вызывало развитие гнойно-воспалительного процесса в течение 48 ч. Увеличение диаметра внутреннего отверстия силиконового фиксатора, в котором располагается рана, позволило более точно проводить планиметрическую оценку повреждений и визуально наблюдать за скоростью краевой эпителизации.
Введение
Гнойная патология мягких тканей остается одной из самых распространенных и актуальных групп заболеваний
человека. Как известно, широкий круг факторов влияет на все фазы заживления ран.
У здоровых людей гнойно-воспалительные раны встречаются редко. Они обычно возникают у пациентов
с хроническими заболеваниями или получающих иммуносупрессивную терапию, например глюкокортикоиды.
В настоящее время пациенты с гнойно-воспалительными заболеваниями составляют около 40% больных
хирургического профиля, а послеоперационные гнойные осложнения развиваются в среднем у 30% больных
[1]. Такие осложнения сопровождаются снижением показателей иммунитета (количества и функций иммунокомпетентных
клеток); ингибированием ангиогенеза, пролиферации фибробластов и синтеза компонентов внеклеточного матрикса
[2].
В опубликованных научных статьях для проведения экспериментов предлагаются разнообразные модели гнойных ран, что
ставит исследователей перед сложным выбором, так как неотъемлемой частью изучения новых направлений в лечении
ран является использование адекватной модели гнойно-воспалительного процесса мягких тканей in vivo.
Цель данной работы – получение модели гнойно-воспалительного процесса в кожных ранах крыс для
последующего исследования лечебного воздействия на раневую поверхность холодной плазмы атмосферного давления,
а также различных лекарственных препаратов.
Материал и методы
Эксперимент был выполнен на 44 белых беспородных крысах-самцах массой 180–190 г (питомник РАН
«Рапполово», Россия). Условия содержания животных соответствовали стандартным условиям вивария.
Температуру воздуха поддерживали на уровне 20–24°С, влажность – 45–65%, световой
режим – 12 ч свет/12 ч темнота. Акклиматизацию животных осуществляли в течение 14 сут.
Крыс содержали в индивидуальных клетках со свободным доступом к пище и воде. Эксперименты на животных
проводили в полном соответствии с Директивой Европейского Совета по соблюдению этических принципов
в работе с лабораторными животными (The European Council Directive (86/609/EEC)) и Директивой
2010/63/EU Европейского Парламента и Совета Европейского Союза.
Индукцию патологии (оперативное вмешательство по нанесению кожных ран) осуществляли под наркозом. В качестве
наркоза и анестезирующего вещества использовали «Золетил 100» (Virbac, Франция) (30 мг/кг массы
тела, внутримышечно) – диссоциативный анестетик, разрешенный к применению на территории Российской
Федерации. Перед нанесением полнокожных ран у животного в области операционного поля на спине между
лопатками ножницами состригали шерсть. Остатки шерсти удаляли с помощью крема для депиляции (Eveline Cosmetics,
Польша), который наносили на 3 мин. Затем операционное поле последовательно обрабатывали однократно 5%-ым спиртовым
раствором йода и 70º этиловым спиртом. С помощью стерильного стилета для биопсии кожи Dermo-punch
диаметром 5 мм (Sterylab, Италия) крысам через оттянутую кожную складку на спине между лопатками, наносили 2
полнослойные кожные раны глубиной до поверхностной фасции мышц [3]. Вырезанный участок кожи удаляли с помощью
пинцета и ножниц, затем пришивали (шовный материал лавсан 4-0) силиконовое кольцо толщиной 1 мм
с диаметром внутреннего отверстия
5 мм [4, 5] или 8 мм. Наличие раны не доставляло животным дискомфорта,
не влияло на их двигательную активность и аппетит.
Для иммуносупрессии использовали введение метотрексата-эбеве (раствор для инъекций 10 мг/мл, шприц – 2 мл,
«Ebeve», Австрия). Метотрексат вводили по 2 схемам: однократное введение – в дозе 10
мг/кг внутримышечно (6 животных) [6] и ежедневное введение – в течение 4 сут в дозе 150
мкг/кг внутримышечно (8 животных). Для получения желаемой концентрации метотрексат разводили стерильным
физиологическим раствором. В качестве 2-го варианта иммуносупрессии применяли гидрокортизон (125 мг)
(«Гедеон Рихтер», Венгрия) в дозе 25 мг/кг (внутримышечно) в течение 7 сут (1-й
укол – за 1 сут до нанесения раны) [2].
Для инфицирования ран, с целью получения локального воспалительного процесса использовали 2 вида бактерий S.
aureus 6 и P. indica 23. Суточную культуру микроорганизмов выращивали до концентрации
108-9 КОЕ/мл на жидкой питательной среде сердечно-мозговой бульон (Brain Heart Infusion Broth, HiMedia,
Индия). Биопленку S. aureus 6 и P. indica 23 (1011-12 КОЕ/см2)
формировали предварительно на поверхности плотной питательной среды (агар Мюллера–Хинтона, HiMedia, Индия)
в течение 24 ч при температуре 37ºС. В экспериментах использовали культуры микроорганизмов из
коллекции ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России.
Раны однократно инфицировали разными способами. В область дна раны вносили суспензию бактерий 109
КОЕ/мл в количестве 0,1 мл S. aureus 6 или P. indica 23 на рану. 2-й способ –
внесение суспензии смешанной бактериальной культуры S. aureus 6 и P. indica 23
в концентрации 108-9 КОЕ/мл в количестве 0,1 мл на рану. В 3-м случае на рану наносили
фрагменты плотной питательной среды со сформированной биопленкой (1011-12 КОЕ/см2)
S. aureus 6 или P. indica 23. Для этого, вырезанные из плотной питательной среды фрагменты
с биопленкой, равные по размеру диаметру раны (5 мм), помещали на дно раны. После внесения микроорганизмов
раневую поверхность изолировали от внешней среды стерильной прозрачной пищевой пленкой на 2 сут. Пленка крепилась
к поверхности силиконового круга благодаря своим свойствам, без постороннего клеящего средства.
Эвтаназия животных не осуществлялась.
В течение всего эксперимента раны ежедневно фотографировали. Полученные изображения переносили в компьютер,
калибровали и измеряли площадь раневого поражения с помощью программы Scion Image (NIH, США). После чего
рассчитывали площадь раневой поверхности на 3-и, 5-е и 7-е сутки. Результаты выражали в % от исходной
площади. Количество микроорганизмов в инфицированных ранах определяли с помощью высевов. Для этого
ежедневно отделяемое раны отбирали с помощью стерильного тампона и распределяли по поверхности плотной
питательной среды (агар Мюллера–Хинтона). Посевы помещали в термостат и выдерживали в течение
24 ч при температуре 37ºС. Результаты посевов, т.е. количество колониеобразующих единиц, подсчитывали
и выражали в КОЕ/см2.
Каждое животное взвешивали до начала эксперимента и в последующие дни.
Статистическую обработку полученных данных выполняли с помощью программы Statistics 19.
Результаты и обсуждение
Заживление раны начиналось с пролиферативной стадии и выражалось в появлении краевой эпителизации,
приводящей к уменьшению площади раны путем сокращения и фиброплазии (образование соединительной ткани).
Динамику течения воспалительного процесса в эксперименте оценивали по появлению краевой эпителизации.
Фиксация краев раны с помощью силиконового кольца позволяла предупредить преждевременное стягивание краев раны,
что давало возможность «стандартизировать» площадь раны, независимо от индивидуальных особенностей
процесса заживления у экспериментального животного, а также оценить воздействие изучаемого препарата.
Поскольку диаметр внутреннего отверстия силиконового кольца (5 мм) совпадал с диаметром наносимой раны [4], то
возникала трудность с оценкой появления краевой эпителизации при заживлении раны (рис. 1). В связи
с этим было решено применять силиконовое кольцо с диаметром внутреннего отверстия 8 мм, что на 3 мм больше
диаметра самой раны, что позволило с легкостью осуществлять визуальную оценку появления краевой эпителизации
(рис. 2).


м
Введение метотрексата однократно в дозе 10 мг/кг привело к гибели 2 из 6 животных (~30%) на 3-й день от
начала эксперимента. Введение препарата в дозе
0,15 мг/кг в течение 4 сут вызвало на
3-и сутки гибель 6 из 8 (75%) животных. Животные теряли примерно 20–30% массы тела. У выживших
животных отмечалось воспаление слизистой оболочки глаз (слизистое или гнойное отделение из глаз), жидкий стул,
снижение двигательной активности, потеря аппетита.
Метотрексат – антиметаболит группы структурных аналогов фолиевой кислоты. Препарат оказывает
противоопухолевое, цитостатическое и иммунодепрессивное действия. Подавляет синтез и репарацию ДНК,
клеточный митоз, в меньшей степени влияет на синтез РНК и белка. Наиболее чувствительны к препарату
активно делящиеся клетки [7]. Согласно полученным результатам, использовать этот препарат нерационально.
Гидрокортизон входит в группу глюкокортикостероидов (ГКС), которые, как известно, предотвращают активацию
фосфолипазы A2, стимулируя образование ее ингибитора – липокортина, нарушают синтез простагландинов
и выделение макрофагального хемотаксического фактора, ингибируют активацию тканевых кининов, уменьшают миграцию
макрофагов и лимфоцитов в очаг воспаления. Преимущество гидрокортизона в моделировании
гнойно-воспалительного процесса обусловлено тем, что ГКС подавляют различные стадии иммуногенеза, но не оказывают
митостатического действия [8]. Воздействуя на функции клеток, которые играют важную роль при заживлении ран, ГКС
вызывают значительное замедление процесса репарации тканей. Известно, что у пациентов, принимающих ГКС или
получающих другую иммуносупрессивную терапию, наблюдается значительное замедление заживления кожных ран [2].
В экспериментах с гидрокортизоном животные были разделены на 5 групп по 6 крыс в каждой
в зависимости от способа инфицирования раны (см. таблицу).

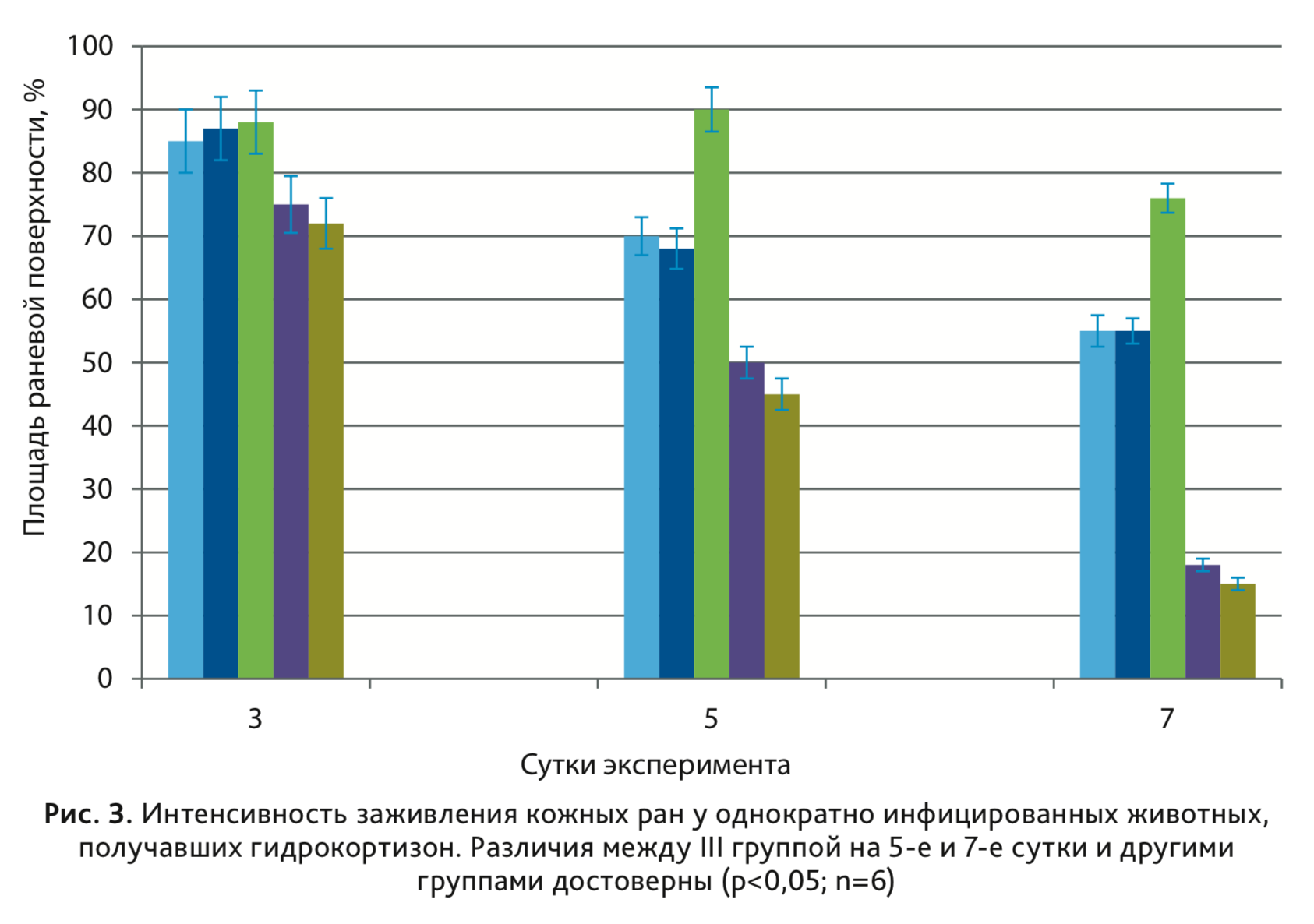
Результаты исследования показали, что на всем протяжении эксперимента значения степени заживления у крыс I
и II группы, практически не отличались, и на 5-е сутки эксперимента площадь раневой поверхности составила
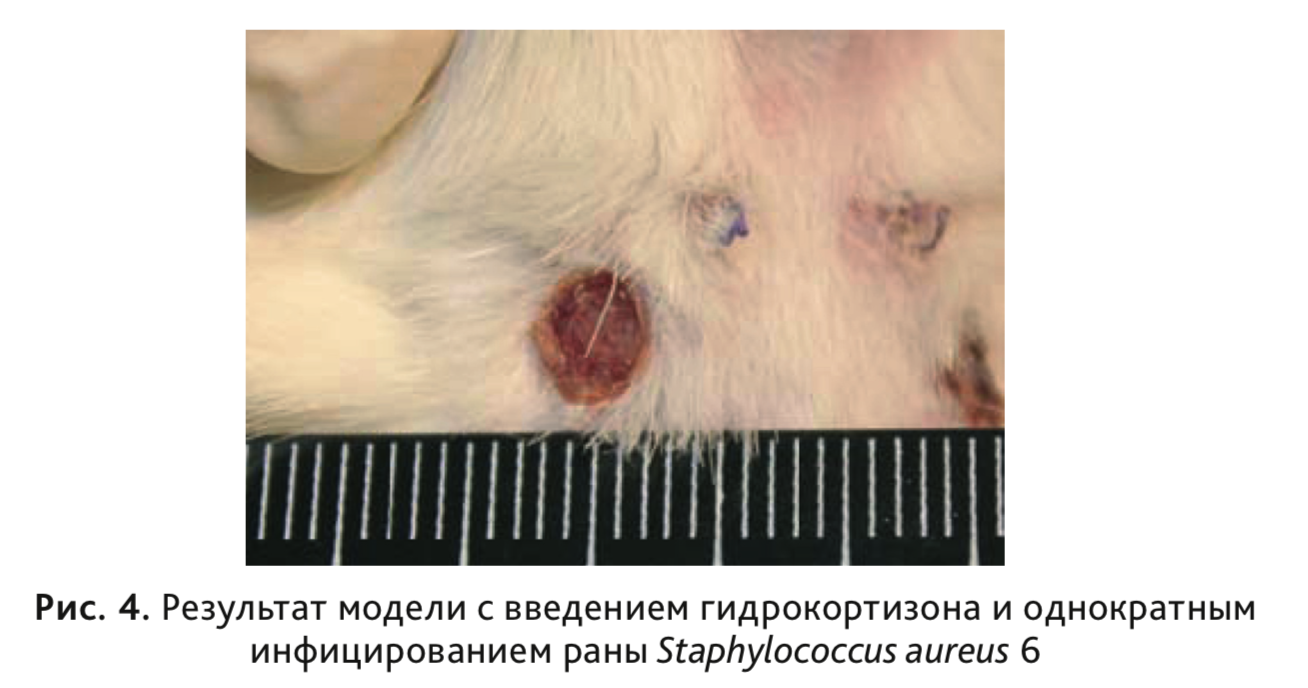
около 75%, на 7-е сутки – 55% от площади нанесенной раны (рис. 3). В этих группах не формировался
гнойно-воспалительный процесс (рис. 4), и на 3-и сутки роста микроорганизмов не обнаружено.

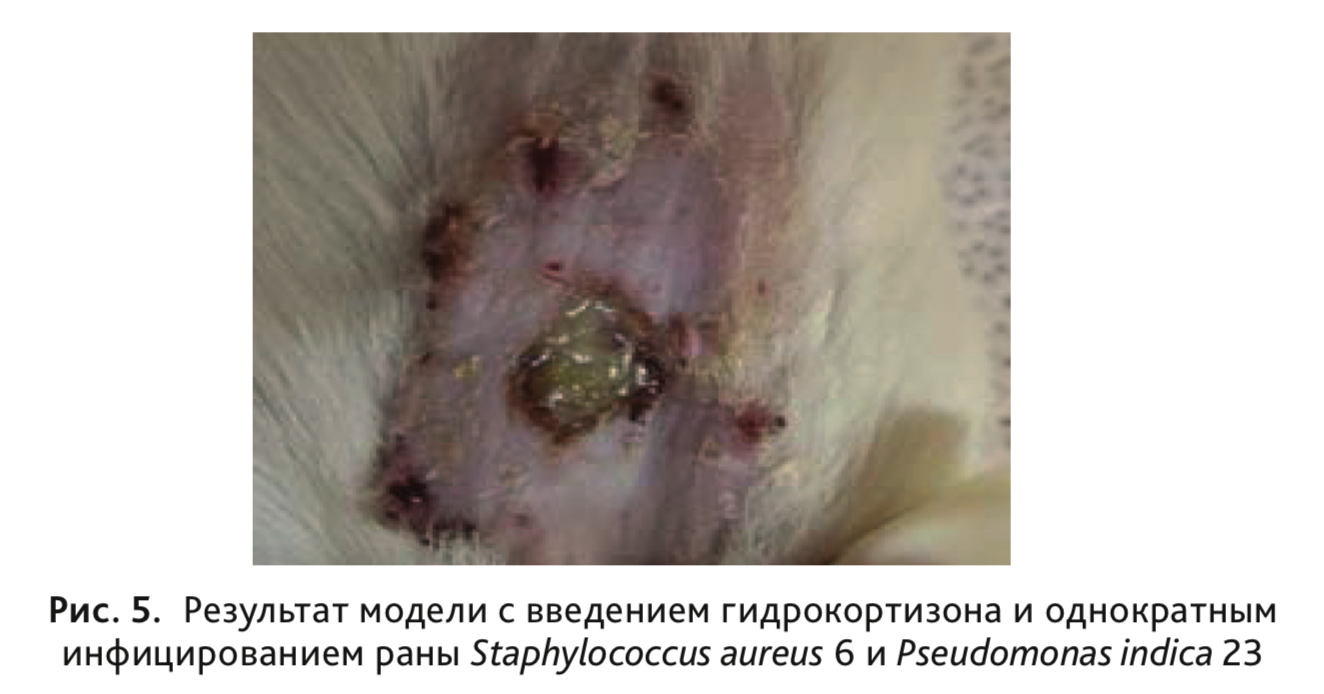
У животных III группы при использовании микробной суспензии в жидкой питательной среде, содержащей клетки
S. aureus 6 и P. indica 23 в концентрации 108 КОЕ/мл в количестве 0,1
мл, на 2-е сутки от начала эксперимента получили гнойную кожную рану с заданной бактериальной обсемененностью,
которая по своим характеристикам была максимально приближена к реальному клиническому течению раневого процесса
(рис. 5). На 3-и сутки микробная обсемененность раны составила 106 КОЕ/см2,
к 5-м суткам уровень обсемененности еще оставался высоким 105 КОЕ/см2,
а к 7-м суткам обсемененность снижалась до 102 КОЕ/см2. Площадь раневой поверхности
на 5-е сутки составляла 90%, а к 7-м суткам достигала 75% от площади исходной нанесенной раны (см. рис.
3).
В группах IV и V инфицирование осуществляли при помещении на рану кусочка плотной питательной среды со
сформированной биопленкой S. aureus 6 или P. indica 23 в концентрации 1011-12
КОЕ/мл. На сегодняшний день принято считать, что биопленка микроорганизмов – хорошо сформированное
сообщество физиологически активных клеток, погруженных в биополимерный матрикс, обладающий повышенной
устойчивостью к факторам окружающей среды. Развитие любого инфекционного процесса бактериальной природы
связано с развитием биопленки [9]. Помещение хорошо сформированной биопленки на раневую поверхность может
привести к развитию острого воспалительного процесса в ране. Однако результаты исследования показали, что
на протяжении эксперимента показатели заживления у крыс были высокими. Так, на 5-е сутки эксперимента площадь
раневой поверхности составила около 50%, на 7-е сутки – меньше 20% от площади нанесенной раны (см. рис.
3). В этих группах не отмечалось гнойно-воспалительного процесса, и на 3-и сутки обсемененность ран
отсутствовала.
Одной из более вероятных гипотез, объясняющих это явление, является наличие агаризованной питательной среды
в ране. Возможно, агар-агар проявляет сорбционные свойства и нейтрализует выделяемые микроорганизмами
факторы патогенности в ране, тем самым улучшая показатели заживления. По результатам исследования на 7-е сутки
инфицированные биопленками на агаре раны заживали лучше, чем при других условиях.
Заключение
В результате проведенных исследований была выбрана оптимальная модель получения гнойной раны на фоне
иммуносупрессии. Использование гидрокортизона (25 мг/кг в течение 7 сут), в отличие от метотрексата, не
приводило к летальности животных, а однократное введение суспензии смешанной культуры S. aureus 6
и P. indica 23 вызывало развитие гнойно-воспалительного процесса в течение 48 ч. Увеличение
диаметра внутреннего отверстия силиконового фиксатора краев раны позволило более точно проводить планиметрическую
оценку ран и визуально наблюдать за скоростью краевой эпителизации.
Работа выполнена при поддержке гранта Санкт-Петербургского государственного университета № 037.218.2016
