Нарушение кровообращения и расстройство микроциркуляции при воспалении
Стадии расстройства микроциркуляции:
1. Кратковременный спазм артериол:результат рефлекторного возбуждения
вазоконстрикторов на воздействие
флогогена (несколько сек–мин).
2. Артериальная гиперемия:увеличение
притока артериальной крови и кровенаполнения
ткани. Способствует усилению оксигенации
тканей, снижению степени ацидоза,
активации обмена веществ.
3. Венозная гиперемия:сопровождается
замедлением тока крови, расширением
просвета посткапилляров и венул. В
механизме выделяют 3 группы факторов:
нарушения реологических свойств крови;
изменения сосудистой стенки;
тканевые изменения.
4. Предстаз:периодические
маятникообразные движения крови «вперёд
↔ назад» в результате механического
препятствия оттоку крови по посткапиллярам,
венулам и венам агрегатами форменных
элементов крови в просвете сосуда и
пристеночными микротромбами.
5. Стаз:возникает в результате
закрытия просвета микрососудов агрегатами
клеток изнутри и сдавления экссудатом
снаружи. Является завершающей стадией
сосудистых изменений.
Экссудация
Экссудация (от лат.exsudatio— выпотевание) — компонент воспаления,
включающий в себя триаду: сосудистые
реакции и изменения кровообращения в
очаге воспаления; выход жидкой части
крови из сосуда (собственно экссудацию);
эмиграцию (выход лейкоцитов в очаг
воспаления и развитие фагоцитарной
реакции).
Основная причинаэкссудации —
увеличение проницаемости стенок
микрососудов вследствие множества
процессов, повреждающих их стенку.
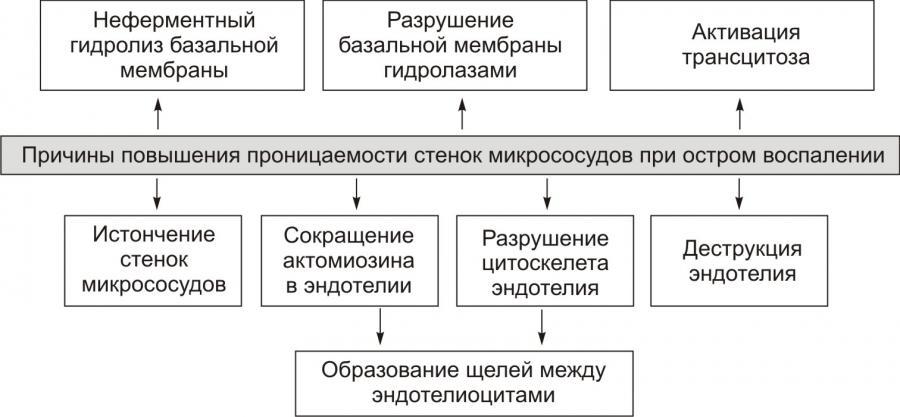
Рис. 9. —
Причины повышения проницаемости стенок
микрососудов
при остром воспалении (по
П.Ф. Литвицкому, 2002)
Основные факторы механизма экссудации:
1) повышение проницаемости сосудов
(венул и капилляров) в результате
воздействия медиаторов воспаления и в
ряде случаев самого воспалительного
агента — ведущий фактор;
2) увеличение кровяного (фильтрационного)
давления в сосудах очага воспаления
вследствие гиперемии;
3) возрастание осмотического и онкотического
давления в воспаленной ткани в результате
альтерации и начавшейся экссудации и,
возможно, снижение онкотического
давления крови из-за потери белков при
обильной экссудации.
Виды экссудата
1. Серозный экссудат: состоит из
полупрозрачной жидкости, богатой белком
(до 2–3%), и немногочисленных клеток, в
том числе форменных элементов крови
(ФЭК).
2. Фибринозный экссудат: содержит
большое количество фибриногена и
фибрина.
3. Гнойный экссудат:мутная густая
жидкость, содержащая до 6–8% белка и
большое количество различных форм
лейкоцитов, микроорганизмов, погибших
клеток повреждённой ткани.
4. Геморрагический экссудат:содержит
большое количество белка и эритроцитов,
а также другие ФЭК.
5. Гнилостный (ихорозный) экссудат:
любой вид экссудата может приобрести
гнилостный (ихорозный) характер при
внедрении в очаг воспаления гнилостной
микрофлоры (анаэробы).
6. Смешанные формыэкссудата могут
быть самыми разнообразными (например,
серозно-фибринозный, гнойно-фибринозный,
гнойно-геморрагический и др.).
Значение процесса экссудации в очаге воспаления
Адаптивное:
транспорт медиаторов воспаления
доставка иммуноглобулинов в очаг
воспаленияудаление из крови метаболитов и токсинов
задержка и/или фиксация в очаге воспаления
флогогена и продуктов его действия на
ткань
Патогенное:
сдавление, смещение органов и тканей
экссудатомвозможность излияния экссудата в
полости тела и сосудыформирование абсцессов, развитие
флегмон
Эмиграция (emigratio, от лат.emigrare
— выселяться, переселяться) — выход
лейкоцитов из сосудов в ткань.Осуществляется путем диапедеза через
стенку венул и является ключевым событием
патогенеза воспаления.
Стадии процесса эмиграции лейкоцитов
в очаге воспаления:
1. краевое стояние лейкоцитов;
2. адгезия к эндотелию и проникновения
через сосудистую стенку;
3. направленное движение лейкоцитов в
очаге воспаления.
На стадии краевого стояния(маргинации)
условно выделено четыре последовательных
этапа.

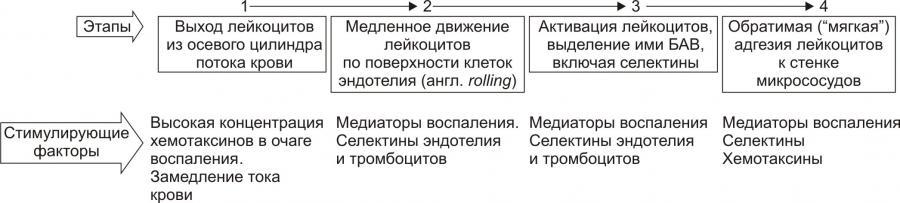
Рис. 10. —Этапы стадии краевого
стояния лейкоцитов и факторы, стимулирующие
краевое стояние (по П.Ф. Литвицкому,
2002)
В стадии адгезии и выхода лейкоцитов
выделяют 2 этапа: устойчивой («плотной»)
адгезии (1) и прохождения лейкоцитов
через стенку микрососуда (2).

Рис. 11. —Этапы стадии устойчивой
адгезии и прохождения лейкоцитов через
стенку микрососуда; факторы, стимулирующие
адгезию (по П.Ф. Литвицкому, 2002)
Значение эмиграции лейкоцитов
в очаг воспаления:
поглощение и деструкция
флогогенного фактора;поглощение и деструкция
поврежденных клеток и неклеточных
структур;синтез и выделение медиаторов воспаления;
поглощение и «процессинг» антигенов
и презентация последних лимфоцитам;развитие иммунных и/или аллергических
реакций.
Нарушение микроциркуляции в очаге воспаления характеризуется изменением тонуса микроциркуляторных сосудов, усиленным током жидкой части крови за пределы сосуда (т.е. экссудацией) и выходом форменных элементов крови (т.е. эмиграцией).
Для сосудистой реакции характерны 4 стадии:
1) кратковременный спазм сосудов,
2) артериальная гиперемия,
3) венозная гиперемия,
4) стаз.
Спазм сосудов возникает при действии повреждающего агента на ткани и связан с тем, что вазоконстрикторы возбуждаются первыми, поскольку они чувствительнее вазодилятаторов. Спазм длится до 40 секунд и быстро сменяется артериальной гиперемией. Артериальная гиперемия формируется следующими тремя путями: а) как результат паралича вазоконстрикторов; б) как результат воздействия медиаторов с сосудорасширяющей активностью; в) как результат реализации аксон-рефлекса.
Расслабляются прекапиллярные сфинктеры, увеличивается число функционирующих капилляров и кровоток через сосуды поврежденного участка может в десятки раз превышать таковой неповрежденной ткани.
Расширение микроциркуляторных сосудов, увеличение количества функционирующих капилляров и повышенное кровенаполнение органа определяет первый макроскопический признак воспаления — покраснение. Если воспаление развивается в коже, температура которой ниже температуры притекающей крови, то температура воспаленного участка повышается — возникает жар. Поскольку в первое время после повреждения линейная и объемная скорость кровотока в участке воспаления достаточно велики, то оттекающая из очага воспаления кровь содержит большее количество кислорода и меньшее количество восстановленного гемоглобина и поэтому имеет яркокрасную окраску. Артериальная гиперемия при воспалении сохраняется недолго (от 15 минут до часа) и всегда переходит в венозную гиперемию, при которой увеличенное кровенаполнение органа сочетается с замедлением и даже полным прекращением капиллярного кровотока.
Венозная гиперемия начинается с максимального расширения прекапиллярных сфинктеров, которые становятся нечувствительными к вазоконстрикторным стимулам и венозный отток затрудняется. После этого замедляется ток крови в капиллярах и приносящих артериолах. Главной причиной развития венозной гиперемии является экссудация — выход жидкой части крови из микроциркуляторного русла в окружающую ткань. Экссудация сопровождается повышением вязкости крови, периферическое сопротивление кровотоку возрастает, скорость тока крови падает. Кроме того, экссудат сдавливает венозные сосуды, что затрудняет венозный отток и также усиливает венозную гиперемию. Развитию венозной гиперемии способствует набухание в кислой среде форменных элементов крови, сгущение крови, нарушение десмосом, краевое стояние лейкоцитов, образование микротромбов. Кровоток постепенно замедляется и приобретает новые качественные особенности из-за повышения гидростатического давления в сосудах: кровь начинает двигаться толчкообразно, когда в момент систолы сердца кровь продвигается вперед, а в момент диастолы кровь останавливается. При дальнейшем повышении гидростатического давления кровь в систолу продвигается вперед, а в момент диастолы возвращается обратно — т.е.возникает маятникообразное движение. Толчкообразное и маятникообразное движение крови определяет возникновение пульсирующей боли. Постепенно экссудация вызывает развитие стаза — обычное явление при воспалении. Как правило, стаз возникает в отдельных сосудах венозной части микроциркуляторного русла из-за резкого повышения ее проницаемости. При этом жидкая часть крови быстро переходит во внесосудистое пространство и сосуд остается заполненным массой плотноприлежащих друг к другу форменных элементов крови. Высокая вязкость такой массы делает невозможным продвижение ее по сосудам и возникает стаз. Эритроциты образуют «монетные столбики», границы между ними постепенно стираются и образуется сплошная масса в просвете сосуда — сладж (от англ. sludge — тина, грязь).
1. Кратковременный спазм артериол, сопровождающийся побледнением ткани.
2. Артериальная гиперемия, обусловленная расширением артериол, механизм которой, с одной стороны, связан аксонрефлекторным возбуждением вазодилататоров, а с другой — с непосредственными сосудорасширяющими эффектами медиаторов воспаления.
3. Венозная гиперемия. Она может развиться уже через несколько минут после воздействия флогогена и характеризуется значительной продолжительностью — сопровождает весь ход воспалительного процесса. Одновременно, поскольку при ее участии осуществляются основные воспалительные явления, она считается истинной воспалительной гиперемией. Воспалительная гиперемия отличается от других видов гиперемии (вызываемой, например, механическим фактором) значительным ослаблением или даже извращением реакции сосудов воспаленной ткани на действие сосудосуживающих агентов (адреналин, кофеин) и на раздражение симпатических нервов. Это явление может быть связано с «десенсибилизацией» сосудов, т.е. сниженной или качественно измененной их чувствительностью к действию вазоконстрикторных стимулов, что обусловлено блокадой рецепторов.
4. Стаз. Он может развиться в некоторых разветвлениях сосудов воспаленной ткани. Распространенный стаз характерен для острого, быстро развивающегося, например гиперергического, воспаления.
Экссудация и экссудаты. Экссудация (exsudatio, от лат. exsudare — потеть) — выпотевание белоксодержащей жидкой части крови через сосудистую стенку в воспаленную ткань. Термины «экссудат» и «экссудация» употребляются только по отношению к воспалению. Они призваны подчеркнуть отличие воспалительной жидкости (и механизма ее образования) от межклеточной жидкости и транссудата — невоспалительного выпота, выходящего при других, невоспалительных, отеках. Если транссудат содержит до 2% белка, то экссудат — более 3 (до 8%).
Механизм экссудации включает 3 основных фактора:
1) повышение проницаемости сосудов (венул и капилляров) в результате воздействия медиаторов воспаления и в ряде случаев самого воспалительного агента;
2) увеличение кровяного (фильтрационного) давления в сосудах очага воспаления вследствие гиперемии;
3) возрастание осмотического и онкотического давления в воспаленной ткани в результате альтерации и начавшейся экссудации и, возможно, снижение онкотического давления крови из-за потери белков при обильной экссудации. Ведущим фактором экссудации является повышение проницаемости сосудов, которое, как правило, имеет две фазы — немедленную и замедленную. Немедленная фаза возникает вслед за действием воспалительного агента, достигает максимума на протяжении нескольких минут и завершается в среднем в течение 15-30 мин, когда проницаемость может возвращаться к норме (в том случае, если сам флогоген не оказывает прямого повреждающего влияния на сосуды). В результате взаимодействия медиаторов со специфическими рецепторами на мембранах эндотелиальных клеток происходит сокращение актиновых и миозиновых микрофиламентов цитоплазмы клеток, и эндотелиоциты округляются; две соседние клетки отодвигаются друг от друга, и между ними появляется межэндотелиальная щель, через которую и осуществляется экссудация. Замедленная фаза развивается постепенно, достигает максимума через 4-6 ч и длится иногда до 100 ч в зависимости от вида и интенсивности воспаления. Следовательно, экссудативная фаза воспаления начинается немедленно после воздействия флогогена и продолжается более 4 суток. Степенью повышения проницаемости сосудов определяется и белковый состав экссудата. При сравнительно небольшом увеличении проницаемости могут выйти только мелкодисперсные альбумины, по мере дальнейшего повышения — глобулины и, наконец, фибриноген. В зависимости от качественного состава различают следующие виды экссудатов: серозный, фибринозный, гнойный, гнилостный, геморрагический, смешанные.
Биологическое значение экссудации двояко. Она выполняет важную защитную роль: обеспечивает поставку в ткань плазменных медиаторов — активных компонентов комплемента, кининов, факторов свертывающей системы, ферментов плазмы, биологически активных веществ, высвобождаемых активированными клетками крови. Совместно с тканевыми медиаторами они участвуют в умерщвлении и лизисе микроорганизмов, привлечении лейкоцитов крови, опсонизации патогенного агента, стимуляции фагоцитоза, раневом очищении, репаративных явлениях. С экссудатом из тока крови в очаг выходят продукты обмена, токсины, т.е. очаг воспаления выполняет дренажную элиминативную функцию. С другой стороны, вследствие свертывания лимфы в очаге, выпадения фибрина, усугубления венозного застоя и тромбирования венозных и лимфатических сосудов экссудат участвует в задержке в очаге микробов, токсинов, продуктов обмена. Будучи компонентом патологического процесса, экссудация может приводить к осложнениям — поступлению экссудата в полости тела с развитием плеврита, перикардита, перитонита; сдавлению близлежащих органов; гноеобразованию с развитием абсцесса, эмпиемы, флегмоны, пиемии. Образование спаек может вызвать смещение и нарушение функций органов. Большое значение имеет локализация воспалительного процесса. Так, например, образование на слизистой оболочке гортани при дифтерии фибринозного экссудата может привести к асфиксии. Скопление в ткани экссудата обусловливает такой внешний местный признак воспаления, как припухлость. Кроме того, наряду с действием брадикинина, гистамина, простагландинов, нейропептидов давление экссудата на окончания чувствительных нервов имеет некоторое значение в возникновении воспалительной боли.
Лекция №8.
Эмиграция (emigratio, от лат. emigrare — выселяться, переселяться) — выход лейкоцитов из сосудов в ткань. Осуществляется путем диапедеза главным образом через стенку венул. Эмиграция лейкоцитов в очаг является ключевым событием патогенеза воспаления. Лейкоциты служат основными эффекторами воспаления. Внеклеточные бактерицидный и литический эффекты лейкоцитарных продуктов и фагоцитоз играют решающую роль в борьбе с флогогеном. Одновременно, оказывая влияние на клетки, сосуды и кровь, компоненты лейкоцитов выступают как важные медиаторы и модуляторы воспаления, в том числе повреждения собственных тканей. Осуществляя раневое очищение, фагоциты создают предпосылки для репаративных явлений, где они стимулируют пролиферацию, дифференцировку и функциональную активность фибробластов и других клеток. Пусковым моментом активации лейкоцитов является воздействие на рецепторы (часто специфические) клеточных мембран разнообразных хемотаксических агентов (хематтрактантов), высвобождаемых микроорганизмами или фагоцитами, а также образующихся в ткани в результате действия воспалительного агента или под влиянием самих фагоцитов. Наиболее важными хематтрактантами являются: фрагменты комплемента, фибринопептиды и продукты деградации фибрина, калликреин, проактиватор плазминогена, фрагменты коллагена, фибронектин, метаболиты арахидоновой кислоты, цитокины, лимфокины, бактериальные пептиды, продукты распада гранулоцитов. В результате связывания хематтрактантов с рецепторами и активации ферментов плазматической мембраны в фагоците развивается респираторный взрыв — резкое повышение потребле- ния кислорода и образование активных его метаболитов. Этот процесс не имеет отношения к обеспечению фагоцита энергией. Он направлен на дополнительное вооружение фагоцита высокореактивными токсическими веществами для более эффективного уничтожения микроорганизмов. Наряду с дыхательным взрывом в фагоците происходят другие изменения: повышенная выработка особых мембранных гликопротеинов, определяющих адгезивность фагоцита; понижение поверхностного натяжения мембраны и изменение коллоидного состояния участков цитоплазмы (обратимый переход из геля в золь), что необходимо для образования псевдоподий; активация актиновых и миозиновых микрофиламентов, являющаяся основой миграции; усиленная секреция и выделение веществ, облегчающих прикрепление лейкоцита к эндотелию (лактоферрин, катионные белки, фибронектин, интерлейкины). Лейкоциты выходят из осевого тока крови в плазматический. Этому способствуют нарушение реологических свойств крови, замедление кровотока, изменение его характера, в частности уменьшение краевой плазматической зоны. Вследствие возрастания адгезивных свойств лейкоцитов и эндотелиальных клеток происходит приклеивание лейкоцитов к эндотелию — развивается феномен краевого стояния лейкоцитов.
Повышение адгезивности эндотелия может быть обусловлено: усиленной продукцией им адгезивных гликопротеинов (лектинов) и других веществ, которые включаются в состав фибриновой пленки, в норме покрывающей эндотелий со стороны просвета сосуда, фиксацией на эндотелиальных клетках хематтрактантов, впоследствии взаимодействующих со специфическими рецепторами на лейкоцитах, усилением экспрессии на эндотелиоцитах рецепторов к иммуноглобулину G и фрагменту комплемента С3Ь, что способствует фиксации иммунных комплексов, а через них — лейкоцитов, несущих рецепторы к иммуноглобулину (Ig) G и С3Ь.
Прилипание лейкоцитов к эндотелию опосредовано следующими факторами:
• лейкоциты в фазе инициации воспаления активируются и образуют агрегаты; в результате активации лейкоцита его отрицательный заряд снижается, что уменьшает силы взаимного отталкивания между ним и отрицательно заряженным эндотелием;
• между лейкоцитами и эндотелием образуются кальциевые мостики (Са2+ и другие двухвалентные ионы играют ключевую роль в прилипании лейкоцитов);
• в ходе активации в лейкоцитах усиливается синтез специфических гранул, некоторые компоненты которых, например лактоферрин, усиливают адгезивные свойства клеток;
• на мембране лейкоцитов возрастает экспрессия адгезивных гликопротеинов классов Мас-1 и LAF-1. Первоначальный контакт лейкоцитов с эндотелием является весьма непрочным, и под влиянием кровотока они могут перекатываться по поверхности фибриновой пленки, однако контакт быстро стабилизируется, поскольку лейкоциты выделяют в зону слипания протеазы, обнажающие лектиноподобные участки мембраны эндотелиоцитов и придающие им повышенную адгезивность. Прямое отношение к прилипанию фагоцитов к эндотелию имеет выделяемый ими фибронектин. Занявшие краевое положение лейкоциты выпускают псевдоподии, которые проникают в межэндотелиальные щели и таким образом «переливаются» через эндотелиальный слой. Эмиграции способствуют повышение сосудистой проницаемости и усиление тока жидкости из сосуда в ткань, существенно облегчающие прохождение сосудистой стенки для лейкоцита. Оказавшись между эндотелиальным слоем и базальной мембраной, лейкоцит выделяет лизосомальные протеиназы, растворяющие ее, а также катионные белки, изменяющие коллоидное состояние базальной мембраны (обратимый переход из геля в золь), что обеспечивает повышенную проходимость ее для лейкоцита. Иммигрировавшие лейкоциты отделяются от наружной поверхности сосудистой стенки и амебоидными движениями направляются к центру очага воспаления (рис. 10-15), что определяется градиентом концентрации хемотаксических веществ в очаге. Некоторую роль могут играть электрокинетические явления, обусловленные разностью потенциалов между отрицательно заряженным лейкоцитом и положительным зарядом ткани, характеризующейся Н+- гиперионией. Первоначально среди лейкоцитов экссудата в очаге острого воспаления преобладают гранулоциты, в основном нейтрофилы, а затем — моноциты/макрофаги. Позже в очаге накапливаются лимфоциты. Поскольку замедление кровотока в отдельных разветвлениях микроциркуляторного русла и краевое стояние лейкоцитов могут развиваться весьма быстро, а мигрирующему нейтрофилу достаточно 3-12 мин, чтобы пройти эндотелий, появление гранулоцитов в очаге может наблюдаться уже к 10-й мин от начала воспаления. Скорость аккумуляции нейтрофилов в очаге является наивысшей в первые 2 ч, постепенно снижаясь в последующие. Количество их достигает максимума через 4-6 ч. В этот период лейкоциты очага представлены нейтрофилами более чем на 90%. Гранулоциты фагоцитируют бактерии или иные инородные тела и частицы отмирающих клеточных элементов, параллельно осуществляя внеклеточную поставку ферментов, катионных белков, активных метаболитов кислорода. Одновременно происходит массивное разрушение нейтрофилов, останки которых являются важным стимулом расширения инфильтрации — как нейтрофильной, так и моноцитарной. Как и в норме, большинство гранулоцитов, вышедших в ткань, никогда не возвращается в кровоток. Клеточный состав экссудата в большой мере зависит от характера и течения воспалительного процесса, в свою очередь определяемых воспалительным агентом и состоянием реактивности организма. Так, экссудат особенно богат нейтрофилами, если воспаление вызвано гноеродными микробами; при аллергическом воспалении в очаге содержится много эозинофилов. Хронические воспалительные процессы характеризуются незначительным содержанием нейтрофилов, преобладанием моноцитов и лимфоцитов. Иммигрировавшие лейкоциты совместно с пролиферирующими клетками местного происхождения образуют воспалительный инфильтрат. При этом экссудат с содержащимися в нем клетками пропитывает ткань, распределяясь между элементами воспалительного участка и делая его напряженным и плотным. Инфильтрат наряду с экссудатом обусловливает припухлость и имеет значение в возникновении воспалительной боли.
Под воспалительной пролиферацией (proliferate, от лат. proles — потомство, ferre — создавать) понимают размножение местных клеточных элементов в очаге воспаления. Пролиферация развивается с самого начала воспаления наряду с явлениями альтерации и экссудации, но становится преобладающей в более поздний период процесса, по мере стихания экссудативно-инфильтративных явлений. Первоначально она в большей мере выражена на периферии очага. Важнейшим условием прогрессирования пролиферации является эффективность очищения очага воспаления от микроорганизмов или другого вредного агента, продуктов альтерации тканей, погибших лейкоцитов (раневое очищение). Ведущая роль в этом отводится макрофагам — гематогенного (моноциты) и тканевого (гистиоциты) происхождения. Пролиферация осуществляется главным образом за счет мезенхимальных элементов стромы, а также элементов паренхимы органов. В ней участвуют камбиальные, адвентициальные, эндотелиальные клетки. В результате дифференцировки стволовых клеток соединительной ткани — полибластов — в очаге появляются эпителиоидные клетки, фибробласты и фиброциты. Основными клеточными элементами, ответственными за репаративные процессы в очаге воспаления, являются фибробласты. Они продуцируют основное межклеточное вещество — гликозаминогликаны, а также синтезируют и секретируют волокнистые структуры — коллаген, эластин, ретикулин. В свою очередь, коллаген является главным компонентом рубцовой ткани.
Пролиферация сменяется регенерацией. Последняя не входит в комплекс собственно воспалительных явлений, однако непременно следует им и трудно от них отделима. Она состоит в разрастании соединительной ткани, новообразовании кровеносных сосудов, в меньшей степени — в размножении специфических элементов ткани. При незначительном повреждении ткани происходит относительно полная ее регенерация. При образовании дефекта он заполняется вначале грануляционной тканью — молодой, богатой сосудами, которая впоследствии замещается соединительной тканью с образованием рубца.
ОБЩИЕ ПРОЯВЛЕНИЯ ВОСПАЛЕНИЯ.
Общие проявления воспаления обусловлены влияниями из очага процесса, главным образом медиаторами воспаления.
Лихорадка является результатом воздействия эндогенных пирогенов, в частности IL-1, высвобождаемых активированными лейкоцитами очага воспаления и периферической крови, на центр терморегуляции.
Ускоренный обмен веществ является следствием усиленной секреции катаболических гормонов, в частности под влиянием монокинов, а также может быть вторичным по отношению к лихорадке. При этом в крови отмечается повышенное содержание глюкозы, глобулинов, остаточного азота.
Повышение СОЭ отражает абсолютное или относительное преобладание в плазме глобулинов над альбуминами, что происходит вследствие усиленной продукции гепатоцитами под воздействием монокинов «белков острой фазы» или же опережающей потери альбуминов при экссудации. Преобладание в плазме крупнодисперсных белков уменьшает отрицательный заряд эритроцитов и, соответственно, их взаимное отталкивание. Это повышает агглютинацию эритроцитов и, следовательно, их оседание.
Изменения иммунных свойств организма, проявляющиеся, в частности, повышенной устойчивостью к повторному воздействию флогогена, особенно инфекционного, обусловлены формированием в ходе воспаления клеточного и гуморального иммунитета. В этом большую роль играют лимфоидные клетки очага воспаления, например В-лимфоциты, превращающиеся в плазматические клетки — продуценты антител. Воспаление формирует иммунологическую реактивность организма («иммунитет через болезнь»).
Реакции системы крови при воспалении включают эмиграцию лейкоцитов в очаг и ряд изменений со стороны кроветворной ткани и периферической крови.
Активация кроветворения при воспалении обусловлена усиленной выработкой стимулированными лейкоцитами очага воспаления и крови гемопоэтических веществ — колониестимулирующих факторов, интерлейкинов и др., которые являются инициирующим звеном механизма самоподдержания лейкоцитарной инфильтрации очага воспаления. В саморегуляции инфильтрации существенное значение имеют лизосомальные ферменты, активные формы кислорода, эйкозаноиды.
Для острого воспаления характерен нейтрофильный лейкоцитоз со сдвигом влево (увеличение количества более молодых, палочкоядерных и юных нейтрофилов в результате вовлечения костно-мозгового резерва и активации кроветворения), а также моноцитоз, для хронического воспаления — моноцит арный лейкоцитоз и лимфоцитоз.
