Нейрогенное воспаление кожи это

Нейрогенное воспаление. Причины развития и лечение нейрогенного воспаления.Что касается причин развития патологического функционирования нервной системы, приводящих к воспалению бронхов и легких, то их условно можно разделить на несколько групп: I. Дефект ингибиторных систем: II. Дефект рецепторного аппарата:
III. Дефекты продукции медиаторов и БАВ: IV. Дефекты взаимного функционирования различных частей нервной системы: V. Дефекты взаимного функционирования нервной системы с другими системами организма: Часть из перечисленных выше дефектов требуют дополнительных подтверждений, но можно с уверенностью утверждать, что имеется большое количество нарушений, которые могут приводить к «нейрогенному» воспалению. Наиболее вероятна вторичность нейрогенного механизма в развитии воспаления бронхов и легких. Однако при любом воспалении бронхов присутствует нейрогенный компонент, который занимает одно из ведущих мест в поддержании и прогрессировании патологического процесса. Следует отметить, что оценить вклад нарушений нервной регуляции в патогенезе воспаления у каждого больного достаточно сложно ввиду многофакторности причин воспаления. Наряду с общеклиническими методами диагностики воспаления необходимо комплексное исследование нервной системы, включающее как оценку состояния ЦНС (электроэнцефалография и др.), так и оценку вегетативного баланса (вариационная пульсометрия, психологическое тестирование и др.) и другие. По данным, полученным на кафедре госпитальной терапии СПбГМУ им. акад. И.П. Павлова, нормальные показатели вегетативного баланса имелись только у 20% больных БА, у большинства отмечался тормозный фон, характерный для преобладания тонуса парасимпатического отдела ВНС, и извращенные реакции на адреналин. Причем наиболее резко выраженный дисбаланс ВНС был отмечен у больных с центральными нарушениями на диэнцефальном уровне. Оценке состояния ВНС способствует также определение уровней КА в крови и моче, активности нейропептидов ВНС (АХ, ВИП, НА, СР и других), а также ингибирующих их ферментов (МАО, КОМТ, АХЭ) в крови. Выявление дисбаланса между возбуждающими и тормозящими отделами может говорить о нарушении вегетативной нервной регуляции и в какой-то степени о возможном участии ее в формировании воспаления, его нейрогенного компонента. По данным, полученным на кафедре госпитальной терапии СПбГМУ им. акад. И.П. Павлова, у больных установлена гетерогенность патохимических изменений, позволившая говорить о многофакторности вегетативных нарушений у больных с заболеваниями легких; кроме этого, для них было характерно формирование жестко детерминированной структуры межсистемных связей, обеспечивавших регуляцию бронхиальной проходимости на нервном (симпатическом и парасимпатическом) и гуморальном уровнях, что затрудняет адаптацию органов к изменяющимся условиям функционирования. Следует отметить, что воспаление оказывает влияние на нервную систему. Классическим примером такого влияния является температурная реакция на воспаление, которая связана как с действием токсинов, так и с действием биологически активных веществ (БАВ) на центр терморегуляции. Показано, что простагландины обладают способностью вызывать лихорадку, действуя на иреоптическую зону переднего гипоталамуса, где находится центр терморегуляции. Особое влияние воспаления на состояние ЦНС отмечено при изучении нарушений функций легких и бронхов в результате воспаления. Так, динамическое наблюдение за состоянием нервной системы больных с заболеваниями легких, сопровождающимися обструкцией с дыхательной недостаточностью, позволило выявить постепенное развитие однотипных и однонаправленных изменений нервной системы: нейроциркуляторной дистонии по гипертоническому типу, неврастении гипостенического типа, нарушение обмена веществ с ожирением, деструктивные остеоартропатии, сопровождаемые поражением периферических нервов. Лечение «нейрогенного» воспаления проводится с использованием классических схем терапии воспаления с применением противовоспалительных и, в частности, глюкокортикоидных препаратов. Вместе с тем, обязательным в терапевтической коррекции является нормализация вегетативного баланса с учетом полученных при обследовании данных. В качестве одного из вариантов патогенетической терапии наиболее широкое распространение получила комбинация холинолитического препарата (Ипратропиум бромид, Окситропиум бромид) и В2 адреномиметического препарата (Беротек, Сальбутомол) или использование комбинированных препаратов (Беродуал, Беродуал форте). Вместе с тем, продолжается поиск новых подходов для нормализации вегетативного баланса. Одним из таких подходов является использование комбинации холинотропных препаратов разнонаправленного действия. Нами совместно с сотрудниками кафедры терапии стоматологического факультета СПбГМУ им. акад. И.П. Павлова начата терапия комбинацией метацина и прозерина, которая позволила значительно улучшить показатели вегетативного статуса больных и нормализовать показатели бронхиальной проходимости у 20% больных. Что касается самого «нейрогенного» воспаления, то в настоящее время не выработано каких-либо эффективных подходов к его терапии. В литературе имеются сообщения о том, что в ЦНС опиаты ингибируют выброс СР и энкефалины действуют как эндогенные модуляторы СР-ергических нейронов. Опиаты эффективны при ингибировании некоторых нейрогенных механизмов констрикции дыхательных путей. Это опосредуется и опиоидными рецепторами на сенсорных нервных окончаниях, которые подавляют секрецию тахикининов. Сходным образом опиаты ингибируют нейрогенное нарушение микроваскулярной проницаемости в дыхательных путях морской свинки и слизистую секрецию в бронхах человека, вызванную капсацином. Центральный нейротрансмиттер ингибирующего действия — гамма-аминобутировая кислота обладает в отношении НАНХ бронхоконстрикции сходным эффектом. Однако группы этих препаратов не нашли широкого распространения в терапии больных. Ряд пресинаптических рецепторов также ингибируют выброс нейропептидов в дыхательных путях, и это может послужить для открытия новых лекарств для лечения астмы. В заключение можно констатировать, что патологическое функционирование нервной системы является неотъемлемой частью патогенеза воспаления бронхолегочного аппарата, успешное лечение воспаления зависит от нормализации состояния нервной системы. — Вернуться в оглавление раздела «Пульмонология.» Оглавление темы «Нервная система и воспаление легких.»: |
Целый ряд заболеваний у человека (атопический дерматит, пруриго, зуд, псориаз, розацеа, крапивница, опоясывающий герпес, воспалительный артрит) характеризуется отчетливым нейрогенным компонентом. Периферическая нервная система также регулирует воспалительные реакции и в других органах (например, при блефарите, астме, колите). Более того, нейромедиаторы играют роль при репаративных процессах, регулируя рост, пролиферацию и ангиогенез.
Способность нейропептидов активировать тучные клетки человека и вызывать крапивницу описывалась неоднократно. Например, при хронической идиопатической крапивнице и в меньшей степени при компрессионной крапивнице отмечено легкое возникновение индуцированных SP и ПКГК кожных реакций по типу «цветения». Определенные ионные каналы с транзиторным рецепторным потенциалом экспрессируются сенсорными нервами, а также тучными клетками, и могут активироваться триггерными факторами крапивницы (теплом, холодом, давлением, компонентами пищи).
На основании клинических наблюдений высказывается предположение о неврогенном компоненте в патофизиологии псориаза (например, провокация под действием стресса), что подтверждается результатами экспериментальных исследований. Полученные данные указывают на роль ФРН (фактора роста нервов) как на медиатор воспалительных реакций при псориазе, хотя его значение еще предстоит установить.
При атопическом дерматите интенсивное окрашивание нервов кожи на нейропептиды или их повышенная концентрация зафиксированы как в области острых, так и лихенизированных высыпаний. Кроме того, типичный для нейрогенного воспаления тройной ответ (эритема, волдырь, гиперемия) и зуд наблюдаются при инъекционном введении пептидов в кожу человека. Более того, в высыпаниях при атопическом дерматите отмечено повышение концентрации триптазы мастоцитов (лиганда активируемого протеиназой рецептора 2 типа, который гиперактивирован при атопическом дерматите и является медиатором зуда, воспаления, а также опосредует снижение активности молекулы межклеточной адгезии 1 типа или ядерного фактора кВ).
Роль пептидов проопиомеланокортина в патогенезе атопического дерматита подтверждается опытами в условиях in vitro, согласно которым α-МСГ модулирует образование иммуноглобулина Е, а также in vivo — в коже больных атопическим дерматитом концентрация пептидов проопиомеланокортина повышена. По данным некоторых исследований, в патогенезе атопического дерматита также могут участвовать нейротрофилы.
Очевидно, что нейропептиды участвуют в представлении антигенов в эпидермисе. Кроме того, предварительное нанесение на кожу капсаицина облегчает в обработанной области возникновение реакции контактной гиперчувствительности (РКГ). Было выдвинуто предположение, что чувствительные к капсаицину нейроны модулируют эту реакцию за счет выброса нейропептидов. Также в исследованиях было обнаружено, что агонисты SP могут предотвращать возникновение РКГ и толерантность после УФ облучения.
ПКГК значительно ингибирует представление антигенов специфическим Т-клеткам. Влияние ПКГК на клетки Лангерганса мышей, вероятно, опосредовано специфическими ПКГК-рецепторами, которые вызывают повышение внутриклеточного циклического аденозинмонофосфата (цАМФ). Соответственно, под действием ПКГК может повышаться образование ИЛ-10. Одним из наиболее мощных (в отношении его способности влиять на РКГ) нейрогормонов является σ-МСГ. Блокировать РКГ также способен ГААП.
Нервная система кожи также играет ключевую роль при репаративных процессах и при их патологических изменениях. Высвобождаемые при этом нейропептиды участвуют в воспалении, пролиферации клеток, образовании цитокинов и факторов роста, а также ангионе-огенезе. Необходимо подчеркнуть, что у животных при хирургическом пересечении кожных нервов отмечалась задержка репаративных процессов. Например, в ранах у крыс регистрировалось пониженное содержание SP, ССТ и ПКГК (на других моделях отмечалось повышение уровня этих веществ).У человека ПКГК способствует пролиферации и миграции кератиноцитов, а также стимулирует пролиферацию эндотелиальных клеток кожи. ВИП обладает способностью как ингибировать, так и стимулировать пролиферацию кератиноцитов.
Ангиотензин II, по-видимому, влияет на репарацию тканей за счет активации рецепторов к ангиотензину I в фибробластах, что в условиях in vitro приводит к ремоделированию коллагена, сокращению коллагенового матрикса и усиленному образованию связывающих коллагеновые волокна интегринов. ФРН активирует миграцию фибробластов кожи и легких человека, но не влияет на их пролиферацию. В модели на мышах было обнаружено, что ФРН ускоряет заживление ран. Эти данные способствовали успешным испытаниям на человеке топического ФРН для лечения язв голеней. Экспрессия родственного паратгормону протеина на время усиливала миграционную активность кератиноцитов, миофибробластов и макрофагов в коже морских свинок, хотя местное нанесение агонистов родственного паратгормону протеина не меняла скорости репарации или морфологии этих ран.
Уровень экспрессии НЭП при заживлении не только повышается, но и перераспределяется по ране, что указывает на роль в этом процессе разрушающих нейропептиды ферментов. В неповрежденной нормальной коже иммунореактивность НЭП ограничивается базальным слоем, тогда как при заживлении НЭП также определяется и в поверхностных слоях кожи человека.
В будущих исследованиях с использованием трансгенных животных и моделей с выключением определенных генов («генный нокаут»), у которых компоненты нейрональной системы гиперэкспрессированы или удалены с помощью гомологической рекомбинации, будет показана роль нервной системы кожи при нормальной репарации и при ее задержке.
Одним из наиболее частых симптомов кожных болезней является зуд, который развивается в результате стимуляции сенсорных нервных окончаний, модуляции сигнала на уровне спинного мозга и дисфункции определенных областей головного мозга. Полимодальные С-волокна после химической или термической стимуляции передают сигнал в спинной и головной мозг, что приводит к возникновению ощущения зуда. Соответственно, как периферическая кожная, так и центральная нервная система координируют возникновение ощущения зуда, которое вызывает автономную реакцию в виде рефлекса расчесывания. Одним из наиболее изученных медиаторов зуда (но не единственным) является гистамин. Недавно были обнаружены новые гистаминовые рецепторы (Н3 и Н4), роль которых в развитии зуда у человека пока не установлена. Другим важным медиатором зуда у больных с атопическим дерматитом может быть ИЛ-31.
При парестетической ноталгии (нейропатия, характеризующаяся зудом, болью, гипералгезией) иммунное окрашивание на несколько нейропептидов показало, что в пораженных областях наблюдается значительное повышение количества нервных волокон и эпидермальных дендритных клеток, что позволяет выдвигать предположение о роли сенсорных нервных волокон в патогенезе этой болезни. При заболеваниях, сопровождающихся зудом и болью, был продемонстрирован эффект таких веществ, как капсаицин, который истощает содержание нейропептидов в сенсорных нейронах. Другие нейромедиаторы, например опиоиды, по-видимому, участвуют в патогенезе холестатического зуда. Холестатический зуд может подвергаться значительной редукции под действием антагонистов 5-гидрокситриптамина. Как и опиоиды, в процесс возникновения зуда вовлечены и эндогенные каннабиоды. При воспалительных процессах каннабиоиды вызывают активацию и сенситизацию ванилоидных рецепторов 1 типа с транзиторным рецепторным потенциалом.
Каннабиоидные рецепторы также индуцируют высвобождение аналгетического β-эндорфина из кератиноцитов мышей. Апрепитант, селективный антагонист рецепторов нейрокинина 1 (NK1R), благоприятное действие которого было недавно показано при лечении зуда и пруриго, может быть эффективен и в терапии других зудящих кожных болезней.
Резюме. Во многих отношениях нервная система модулирует функции кожи (и в итоге «манипулирует» этими функциями), что в нормальных физиологических условиях приводит к контролю над гомеостазом кожи. Однако при патофизиологических состояниях нейромедиаторы могут либо ухудшать (провоспалительным действием), либо улучшать (противовоспалительным действием) течение заболевания. Двухстороннее взаимодействие кожи с периферической и центральной нервной системой играет ключевую роль в гомеостазе кожи и ее патологических состояниях, таких как воспаление, боль или зуд. Недавние открытия расширили наши представления о молекулярных механизмах, регулирующих функцию нейромедиаторов, их рецепторов и контролирующих ферментов.
Развитие современных технологий, в том числе протеомики, геномики, метаболики и молекулярной визуализации нейрональных структур, открывает захватывающие возможности для понимания сложной сети взаимодействий кожи, нервов и иммунной системы во время воспаления, опухолевого генеза, зуда или хронической боли. В настоящее время на стадии клинических или доклинических испытаний находятся различные варианты применения, например, агонистов/антагонистов TRPV1-каналов или антагонистов нейропептидных рецепторов для лечения различных кожных заболеваний, в том числе атопического дерматита, розацеа, вирусной инфекции, зуда и боли. Применение инновационных подходов и изучение новых механизмов нейро-иммуно-эндокринной коммуникации даст возможность получить представление о том, как нейромедицина может способствовать лечению кожных болезней и симптомов, таких как воспаление, рак, нарушения пигментации, аллергические реакции, эндокринные дисфункции, болезненные или зудящие патологии кожи.
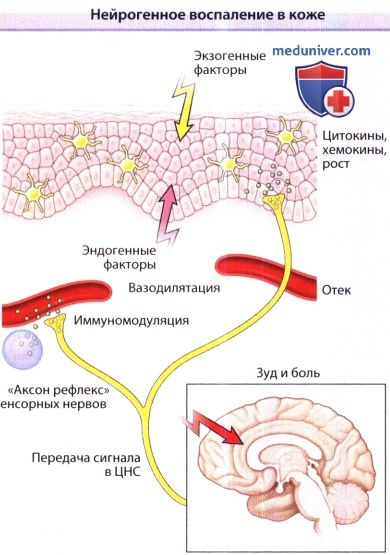
Нейрогенное воспаление в коже.
Экзогенные (тепло, расчесы, раздражение, аллергены, ультрафиолетовое излучение, микроорганизмы)
или эндогенные триггерные факторы (изменения pH, цитокины, кинины, гистамин, протеазы, нейротрансмиттеры, гормоны, стресс)
могут напрямую или опосредованно стимулировать нервные окончания первичных афферентных нейронов.
От них сигналы передаются в центральную нервную систему, интегрируясь в областях, задействованных в возникновении зуда,
боли, соматосенсерных реакций (расчесывание) и по всей видимости, эмоциональных реакций.
Кроме того, периферические нервные окончания стимулируют соседние афферентные нервные волокна дермы и эпидермиса в результате так называемого «аксонрефлекса».
Обусловленный возбуждением выброс нейропептидов приводит к сосудистым реакциям (триада Льюиса, эритема в результате вазодилятации, отек за счет экстравазации плазмы),
модулированию функции иммунных клеток (например, выбросу медиаторов из тучных клеток) и регуляции высвобождения медиаторов (цитокинов, хемокинов, факторов роста) из кератиноцитов и клеток Лангерганса.
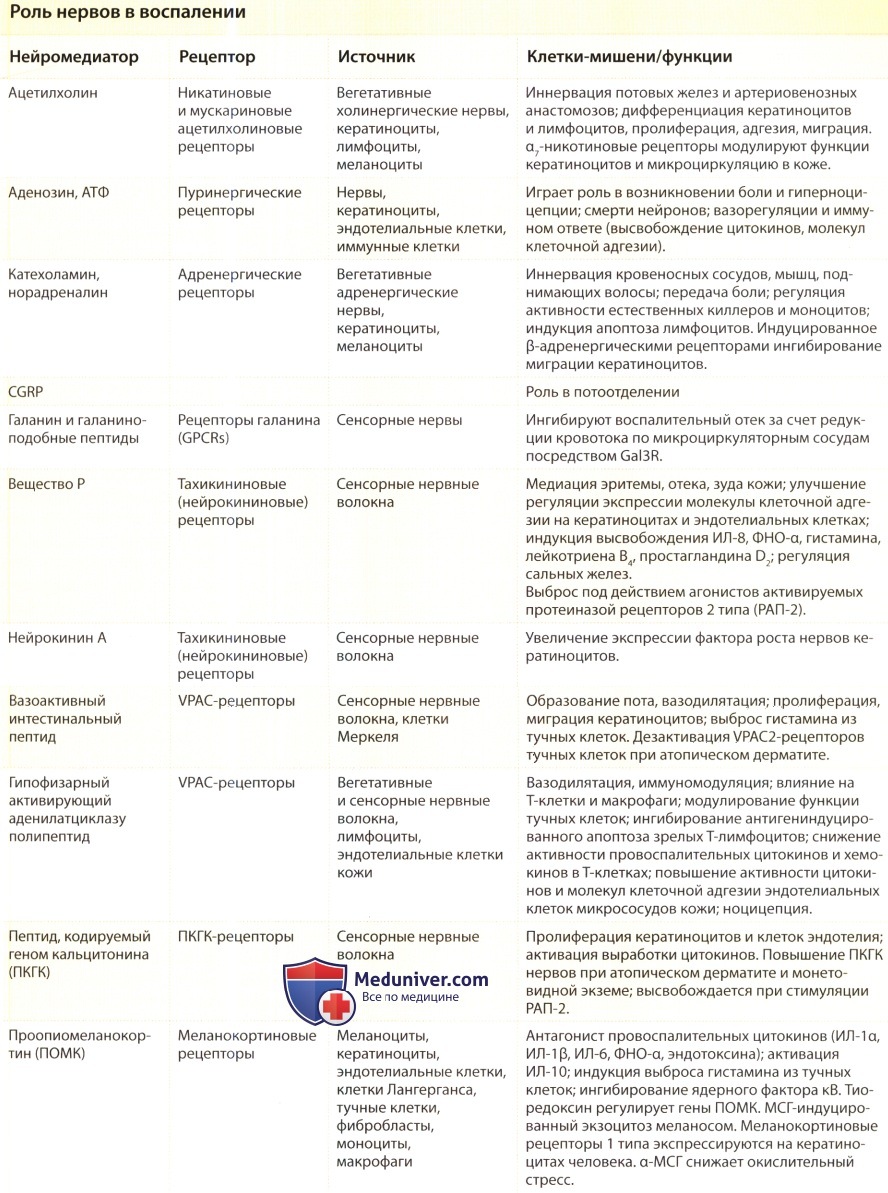
— Рекомендуем далее ознакомиться со статьей «Почему чешется кожа? Причины зуда кожи»
Оглавление темы «Нервная система кожи.»:
- Нейробиология кожи — нервная система и кожа
- Биохимия нервной системы кожи: нейромедиаторы, цитокины, хемокины, рецепторы кожи
- Роль нервной системы при патологии кожи
