Нет иммунного ответа на воспаление

Оглавление темы «Селезенка. Лимфатические узлы. Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Механизмы, контролирующие иммунную систему.»: Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Ранний защитный воспалительный ответ.Ранний защитный воспалительный ответ призван препятствовать внедрению и распространению возбудителя, по возможности быстро удалять его из организма. Ранний защитный воспалительный ответ разыгрывается в течение первых 4 сут после внедрения возбудителя. Ранний защитный ответ против внедрившихся в организм патогенных микроорганизмов обеспечивается факторами врожденного иммунитета, к которым относятся фагоцитирующие клетки крови и тканей, естественные киллеры, циркулирующие в крови белковые молекулы, обладающие защитными свойствами (компоненты системы комплемента и др.), а также межклеточные медиаторы — цитокины. Ранний воспалительный ответ стимулирует последующий специфический иммунный ответ, влияет на его форму, способствуя развитию наиболее эффективного против конкретного микроорганизма специфического иммунного ответа.
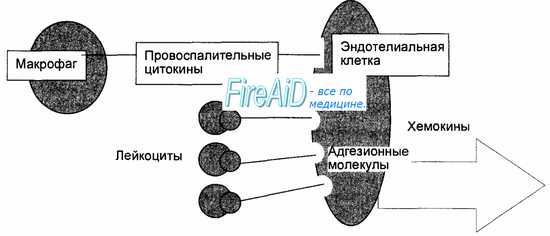
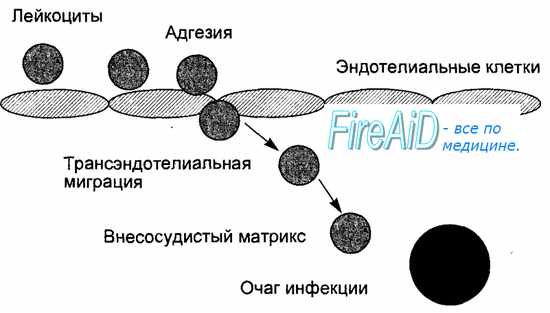
Ранний воспалительный ответ начинается с привлечения лейкоцитов из кровяного русла в очаг инфекции с последующей их активацией для удаления возбудителя (рис. 8.6). Мобилизация лейкоцитов в очаг инфекции стимулируется провоспалительными цитокинами, а опосредуется адгезионными молекулами на поверхности лейкоцитов и эндотелиальных клеток, а также молекулами хемокинов и их рецепторами. Провоспалительные цитокины (туморнекротизирующий фактор—ТНФ, интерлейкин-1 — ИЛ-1) продуцируются и секретируются макрофагами при фагоцитозе возбудителя. Под действием этих цитокинов на поверхности эндотелиальных клеток, появляются адгезионные молекулы вначале для нейтрофилов, а затем для моноцитов и лимфоцитов, ответственные за прилипание лейкоцитов к эндотелию сосудов. Кроме того, активированные цитокинами эндотелиальные клетки продуцируют хемокины, достигающие высокой концентрации на уровне очага инфекции (рис. 8.7). Этим обеспечивается прочная адгезия лейкоцитов к эндотелиальным клеткам с последующей их трансэндотелиальной миграцией и выходом в ткани в направлении очага инфекции (см. рис. 8.6). Таким образом, ранний воспалительный ответ проявляется инфильтрацией очага инфекции фагоцитирующими клетками, где эти клетки получают дополнительные сигналы активации от микробных продуктов и компонентов (липополисахарид клеточной стенки бактерий), от компонентов активированной системы комплемента и от провоспалительных цитокинов, в том числе, от гамма-интерферона, продуцируемого и секретируемого активированными естественными киллерами. Активированные фагоцитирующие клетки приобретают повышенную способность убивать захваченных микробов, что способствует удалению возбудителя. Активированные под влиянием провоспалительных цитокинов эндотелиальные клетки продуцируют молекулы вазодилататоров, под действием которых усиливается местный кровоток, повышается проницаемость сосудов для макромолекул фибриногена, который, покидая сосуды, превращается в фибрин, что способствует ограничению очага инфекции. В случае попадания в организм небольшого количества низковирулентных возбудителей ранний воспалительный ответ подавляет очаг инфекции.
Удаление из кровяного русла попавших в кровь единичных бактериальных клеток является функцией системы комплемента. Большая часть компонентов комплемента синтезируются гепатоцитами и мононуклеарными фагоцитами. Компоненты комплемента (С1, С2, СЗ, С4, С5, С6, С7, С8, С9, факторы В и D) содержатся в крови в неактивной форме. При попадании в кровяное русло бактерий на их поверхности каскад ферментативных реакций ведет к последовательной активации компонентов системы комплемента («альтернативный путь активации») с формированием мембран-атакующего комплекса (С5—С9), вызывающего лизис бактерий. В процессе активации системы комплемента накапливаются фрагменты, которые опосредуют разные биологические эффекты: привлечение лейкоцитов в очаг инфекции или воспаления (хемотаксис) — фрагмент С5а, усиление фагоцитоза (опсонизацию) — СЗb, индукцию синтеза и секреции медиаторов воспаления — С3а, С5а. (При развитии специфического иммунного ответа и появлении в кровяном русле комплексов антиген—антитело другой каскад ферментативных реакций ведет к активации системы комплемента — «классический путь активации») — Также рекомендуем «Представление антигена. Распознавание антигена. Взаимодействие Т-хелперов ( Тh1 ) с антигенпредставляющими клетками.» |
Эта форма иммунного ответа предназначена для защиты от внутриклеточных патогенов, локализующихся в цитоплазматических гранулах — микроорганизмов, фагоцитированных клетками, но не разрушенных из-за недостатка адекватных эффекторных механизмов или их блокады патогенами. Типичные представители таких патогенов — различные виды микобактерий, а также многие простейшие (например, лейшмании, хламидии), риккетсии, плазмодии, грибы (кандиды) и др.
Клеточный иммунный ответ воспалительного типа осуществляется в 4 этапа (рис. 3.109).
- Презентация дендритными клетками антигена CD4+ Т-лимфоци- там, приводящая к их активации.
- Развитие хелперных Т-лимфоцитов типа ТЫ.
- Презентация антигена макрофагами ранее сформировавшимся Т-хелперам (ТЫ-типа), их взаимная активация и выделение цитокинов.
- Активация цитолиза в фагосомах макрофагов.
За реализцию этой формы защиты отвечают Thl-клетки и макрофаги. Thl-клетки формируются на этапе запуска иммунного ответа и отвечают за специфическую составляющую реакции (распознавание антигена и направление реакции на его носителя). Макрофаги выступают в качестве эффекторных клеток. Начальный этап реакции против внутриклеточных патогенов, локализованных в фаголизосомах, осуществляется так же, как при запуске любой формы иммунного ответа: дендритные клетки, захватившие патоген или его фрагмент, презентируют антигенный пептид CD4+ Т-клеткам, которые активируются, пролиферируют и дифференцируются в хелперные Т-лимфоциты. Уже на этапе распознавания антигена происходит ориентация дифференцировки CD4+ Т-лимфоцитов в хелперы Thl-типа, которая затем поддерживается цитокинами, продуцируемыми дендритными клетками — IL-12, IFNy (см. раздел 2.5.5.5).

Рис. 3.109. Схема развития клеточного иммунного ответа воспалительного типа
Активирующее взаимодействие Thl-клеток с макрофагами
Этот этап характерен именно для воспалительного иммунного ответа. Он состоит во взаимодействии специфических TM-клеток с макрофагами, которые содержат на своей поверхности молекулы MHC-II, несущие пепидный фрагмент антигена. При взаимодействии формируется иммунный синапс. В результате генерируются активирующие сигналы, направленные как в ТЫ-клетку, так и в макрофаг. В TW-лимфоцит сигналы поступают через молекулы TCR/CD4 и CD28. В результате этой повторной стимуляции Т-клетки (первая стимуляция была вызвана презентацией антигена дендритной клеткой) происходит усиление выработки цитокинов, важных для реализации последующих событий (в частности IFNy и TNFa).
Стимуляция макрофага при взаимодействии с TW-клеткой реализуется с помощью двух механихмов (рис. 3.110). Один из них — контактный — через костимулирующую молекулу CD40, с которой связывается ее лиганд CD154. CD40 спонтанно экспрессируется макрофагами, тогда как ее лиганд появляется на поверхности TM-клеток в результате активации при формировании иммунного синапса. В передаче сигнала от молекулы CD40 участвуют адапторные факторы TRAF-1, TRAF-2, TRAF-6. В результате происходят активация фактора NF-kB и запуск Rac-зависимой ветви MAP-каскада, завершающейся формированием транскрипционного фактора с-Jun. Второй механизм активации опосредуется IFNy. При связывании этого цитокина с рецептором включается сигнальный путь, вовлекающий киназы Jak1 и Jak2, транскрипционный фактор STAT1, а также дополнительные пути с участием MAP-каскада.
Результат активации макрофагов — экспрессия многочисленных генов, приводящая к повышению содержания на поверхности клетки молекул MHC-I и особенно MHC-II, сборке NADPH-оксидазы, активации ферментов окислительного метаболизма. Наиболее специфичное проявление ответа макрофагов на стимулирующее действие IFNy — экспрессия гена индуцибельной NO-синтазы. Именно NO и его производные, такие

Рис. 3.110. Активация макрофагов Т-хелперами. Показаны механизмы воздействия Thl-клеток на макрофаги (контактный и опосредованный цитокинами), а также индуцируемые Т-клетками проявления активации макрофагов
как пероксинитрит (ОО*NO), вызывают гибель микобактерий и других внутриклеточных патогенов, сохранявшихся и даже размножавшихся в фагосомах. Все эффекты IFNy, в том числе способность индуцировать образование NO-синтазы, усиливаются TNFa, продуцируемым как Th1- клетками, так и самими макрофагами. Эффективность действия цитокинов, вырабатываемых TM-клетками, существенно повышается в связи с сосредоточением их секреции в области контакта с макрофагами. Это, кроме того, уменьшает активацию посторонних клеток и их повреждение. Для обеспечения этой ориентированной секреции необходима поляризация клеток в ходе формирования иммунного синапса.
Особого внимания заслуживает взаимодействие цитокинов IL-12 и IFNy при воспалительном иммунном ответе (рис. 3.111). Экспрессия IL-12 в макрофагах индуцируется при связывании PAMP с TLR. Экспрессия гена IL12 — один из результатов сигнального пути, вовлекающего адапторный белок MyD88 и транскрипционный фактор NF-kB. IL-12 играет решающую роль в индукции дифференцировки TM-клеток и стимулирует выработку этими клетками IFNy, один из важнейших эффектов которого — усиление выработки макрофагами IL-12. Таким образом, эти цитокины вместе с рецепторами и сигнальными путями, ответственными за экспрессию их генов, образуют единую функциональную систему, которой принадлежит ключевая роль в реализации воспалительной формы клеточного иммунного ответа. Дефекты в любом звене этой системы приводят к развитию иммунодефицитов, сопровождающихся повышенной чувствительностью к микобактериям и другим патогенам, в ответ на которые вовлечены ТЫ-клетки и макрофаги.
Воспалительная составляющая Thl-клеточного иммунного ответа
В отличие от цитотоксического иммунного ответа, не связанного очевидным образом с воспалительной реакцией, иммунный ответ, опосредованный TW-клетками, полностью реализуется в ее рамках. Запуск ответа происходит по классической схеме. В очаге инфицирования (обычно в

Рис. 3.111. Роль интерферона у в дифференцировке и реализации функций Т-хел- перов. Интерферон у, продуцируемыйклеткамиврожденногоиммунитета, определяет направление развития адаптивного иммунного ответа, в ходе которого он также секретируется Thl-клетками и активирует основные эффекторы воспалительной формы клеточного ответа — макрофаги
барьерных тканях) дендритные клетки поглощают патоген или его фрагмент и транспортируют его в региональный лимфатический узел или иные вторичные лимфоидные органы. Дифференцировавшиеся специфические ХЫ-клетки поступают в рециркуляцию. Подобно цитотоксическим Т-лимфоцитам, они утрачивают мембранные молекулы, направляющие их миграцию в лимфоидные органы (CD62L, CCR7) и приобретают обычные свойства эффекторных клеток, включая усиленную экспрессию мембранных интегринов (LFA-1, VLA-4) и рецепторов для хемокинов, секретируе- мых в очагах воспаления и барьерных тканях (для Thl-клеток — CXCR3, CCR5, CCR2 и др.).
Оказавшись в очагах инфицирования, Thl-клетки в кооперации с макрофагами осуществляют реакции, описанные выше. В результате взаимодействия этих клеток, особенно действия IFNy, происходит максимально выраженная активация макрофагов. Эта активация результативна с точки зрения защиты от внутриклеточных патогенов, но деструктивна для окружающих тканей. Активированные макрофаги выделяют весь спектр своих секреторных продуктов. Он включает разнообразные провоспалительные факторы и факторы бактерицидности. К последним относят активные формы кислорода, их галоидные производные, оксид азота и его дериваты, ферменты и т.д. Среда в окружении таких клеток закисляется. Поскольку контакт макрофагов с Thl-клетками к этому моменту прекращается, секреция уже не носит ориентированного характера. Выделяемые молекулы выступают как факторы внеклеточной
микробицидности и одновременно вызывают повреждение окружающих нормальных клеток организма. Таким образом, продукты Th1-клеток дополнительно усиливают воспалительную реакцию, в то же время придавая ей специфичность в отношении конкретных возбудителей.
Вариант воспаления, реализуемый с участием Th1-клеток, называют иммунным воспалением, а сам Th1-клеточный иммунный ответ носит название воспалительного клеточного иммунного ответа. В рамках этой формы иммунного ответа особенно ярко проявляется соотношение факторов врожденного и адапативного иммунитета: эффекторным механизмом служит типичная реакция врожденного иммунитета — фагоцитоз, однако он усиливается и приобретает специфичность в отношении конкретных антигенов благодаря вовлечению в реакцию клеток адаптивного иммунитета.
Гранулема

При неэффективном клеточном ответе воспалительного типа, т.е. в случаях, когда разрушения и переваривания внутриклеточных патогенов не происходит, формируется гранулема (рис. 3.112). Гранулема представляет собой морфологическую структуру округлой формы, в центре которой расположены инфицированные макрофаги, а также клеточный детрит и патогены, освободившиеся в результате разрушения макрофагов. Вследствие слияния макрофагов образуются гигантские многоядерные клетки. Некоторые макрофаги претерпевают морфологические изменения, приобретая фенотип так называемых эпителиоидных клеток. Периферическая часть гранулемы образована активированными макрофагами, лишенными патогенов, и Т-лимфоцитами (преимущественно TM-клетками). Т-клетки постоянно
перемещаются, причем эта подвижность важна для сохранения структурной целостности гранулемы. Формирование гранулемы сопряжено с деструкцией ткани и нарушением функционирования большого участка пораженных органов (например, легких при туберкулезе), что делает ее патологическим образованием. С другой стороны, гранулема представляет способ изоляции патогена, с уничтожением которого иммунная система не справляется, и в этом смысле выступает как защитное приспособление организма.
Эффекторные реакции, опосредованные ТН2-клетками
^2-клетки участвуют в эффекторных реакциях, направленных на защиту от многоклеточных паразитов. Эти реакции изучены пока крайне мало. При этом, подобно TM-клеткам, ^2-лимфоциты вовлекают в защитную реакцию клетки миелоидного ряда. В отличие от реакций, опосредованных TW-клетками, эти клетки представлены не макрофагами, а эозинофилами и тучными клетками.
Роль ^2-клеток в этих процессах в значительной степени состоит в секреции цитокинов: IL-4, IL-5, IL-13, IL-9, IL-3 и GM-CSF. Каждый из них в той или иной степени участвует во взаимодействии с исполнительными клетками. Основную роль при этом играет IL-5. Этот цитокин служит фактором выживания эозинофилов, поддерживает их развитие и привлекает эти клетки в очаг поражения. Эозинофилы инфильтрируют ткань вокруг паразита и выделяют продукты своих гранул, из которых главный белок эозинофилов (MBP), пероксидаза эозинофилов (EPO) и катионный белок эозинофилов (ECP) обладают цитопатогенной активностью в отношении клеток гельминтов и других макропаразитов.
Вспомогательную роль в подобных реакциях играют антитела класса IgE. Полагают, что этот минорный класс иммуноглобулинов, известный как ключевой фактор аллергии немедленного типа, предназначен для осуществления антипаразитарной защиты. Помимо прямого блокирующего действия на паразитов, IgE способен «армировать» макрофаги, связываясь с высокоаффинными FceRI-рецепторами на их поверхности, что придает прицельность действию макрофагов и служит дополнительным фактором их активации.
Положим, вы все-таки подцепили коронавирус – или думаете, что подцепили. Можно ли в домашних условиях предпринять какие-то экстренные меры, чтоб переболеть легко – без осложнений, реанимации и ИВЛ? Подстегнуть иммунитет, наделать уколов, напихаться таблетками? Или все бессмысленно, спасения нет?
Мы попросили ответить на эти вопросы нашего соотечественника, который сейчас проживает в Лос-Анджелесе, США, доктора биологических наук Петра Игнатова, профессора, специалиста в области инфекционной иммунологии.
– Петр Евгеньевич, раньше считалось, если человек заболел ОРВИ, надо принимать препараты, повышающие иммунитет. Но в случае коронавируса это правило не работает. Ведь тяжелые осложнения, как объясняют медики, как раз и происходят из-за слишком сильного иммунного ответа организма на инфекцию. Выходит, в начале болезни иммунитет надо, наоборот, подавлять?
– Это не совсем так. Подавлять иммунитет, особенно в начале болезни, дело ненужное и даже очень опасное.
Существует два типа иммунного ответа: клеточный и гуморальный. Если отвечать на ваш вопрос очень упрощенно, то я считаю, что клеточный иммунный ответ при коронавирусной инфекции надо ослаблять, а гуморальный – наоборот, усиливать.
Но в начале инфекционного процесса все иммунные реакции запускают одни и те же клетки врожденного иммунитета. Поэтому на ранних стадиях болезни лучше ничего не подавлять, а активировать процессы, склоняющие иммунитет именно к гуморальному типу. Разделение и их взаимный антагонизм будут развиваться на более поздних этапах болезни.
– Чем отличается клеточный иммунный ответ от гуморального?
– При клеточным типе иммунного ответа с инфекцией воюют лимфоциты, способные обнаруживать и распознавать в организме клетки, пораженные вирусом. Это– киллеры. Они убивают наши зараженные клетки, ликвидируя таким образом, сразу всю «фабрику» по производству вирусов.
Это вроде бы хорошо. Но при ближайшем рассмотрении оказывается не очень нужным. При большинстве респираторных болезней с острым течением инфицированные клетки всё равно погибают при выходе из них вирионов. Все развивается очень быстро, и киллеры, часто, просто не успевают их обнаружить.
Гораздо успешнее при коронавирусной инфекции другая стратегия: заранее подавить способность вируса внедряться в здоровые клетки. Для этого нужно блокировать адгезивные свойства его поверхностного S-белка. Тогда вирус просто не сможет поражать здоровые клетки, и клеткам-киллерам уже не понадобится их убивать.
Наиболее эффективным блокирующим агентом здесь оказываются антитела. Они вырабатываются нашим организмом в процессе гуморального типа иммунного ответа. Это совершенно иной механизм, чем клеточный ответ.
Сейчас, кстати, предлагаются различные технологии по созданию искусственных антител и антителоподобных молекул-ловушек, блокирующих адгезию вируса на клетках. Некоторые лекарственные препараты тоже демонстрируют способность изменять адгезивные свойства вирусного S-белка — низкомолекулярные гепарины, например. Так, что эти направления противовирусной терапии имеют сейчас большую перспективу.
– Но почему надо оказывать предпочтение только одному типу иммунного ответа? Пусть война с вирусом идет в организме на двух фронтах.
– Клеточный и гуморальный типы иммунного ответа находятся в достаточно антагонистических отношениях друг к другу. Если преимущество получает клеточный тип — он подавляет гуморальный ответ, и наоборот. Таким приемом организм экономит ресурсы и сосредотачивает свою защиту преимущественно на одном типе, но зато на самом губительном для данного возбудителя.
Но SARS-CoV2 обманывает наш организм. Он вызывает выработку специальных белков, которые, словно компьютерный вирус, встраиваются и нарушают работу сигнальных путей в наших макрофагах. Это заставляет их усиленно продуцировать про-воспалительные цитокины. Если про-воспалительные цитокины вырабатываются в очень большом количестве, они буквально «сводят с ума» клетки иммунитета, и те начинают быстро разрушать собственный организм. Такой феномен называют «цитокиновым штормом».
Кроме того, что данные цитокины индуцируют массовые воспалительные реакции по всему организму, они активно включают запуск именно клеточного иммунного ответа, малоэффективного для организма в плане защиты. А, это в свою очередь, влечет за собой подавление гуморального иммунитета и снижение продукции антител, нейтрализующих коронавирус.
Коронавирус «научился» провоцировать такой тип ответа, который ему выгоден, поскольку при нем снижается выработка опасных для него противовирусных антител. Таким образом он избегает эффективной атаки со стороны иммунитета. Подобные уловки возбудителей совсем не редкость при инфекционных болезнях и носят название «иммунного отклонения».
– Можно ли помочь организму скорректировать иммунные реакции?
– Да. Как я уже сказал, надо активировать реакции гуморального иммунитета и, наоборот, при необходимости – подавить клеточный.
Для подавления клеточного иммунитета обычно используют 1) кортикостероиды, 2) хлорохин — известный блокатор клеточного иммунитета, он часто назначается для лечения ревматоидного артрита, волчанки; 3) моноклональные антитела — блокаторы про-воспалительных цитокинов и других молекул-инициаторов воспаления; 4) перепрограммирование клеток (макрофагов в частности) и др.
– У таких препаратов есть побочные явления? Можно принимать их самостоятельно, в домашних условиях, если человек только что заболел? Или это опасно?
– Самому этого делать не следует. Эти вещества небезопасны и имеют массу побочных эффектов. Подавление воспалительных реакций, индуцированных массивным «цитокиновым штормом», проводят обычно в условия стационара, на этапе развития серьезных патологий в легких и других органах.
– А какими препаратами можно активировать гуморальный иммунный ответ?
– Они тоже достаточно известны. Например, холекальциферол (или витамин Д3), который действует в организме наподобие гормона. Рецепторы к нему имеются на многих клетках и особенно на макрофагах. Включение этих рецепторов оказывает на них очень сильное воздействие, заставляя отменять выработку про- воспалительных цитокинов.
Вместо про-воспалительных цитокинов макрофаги начинают синтезировать цитокины анти-воспалительные, что естественным образом подавляет воспаление в организме. Они же запускают и процесс гуморального иммунного ответа. То есть, этот витамин способен выступать в роли некого переключателя, отменяющего «неправильный» и запускающего «правильный» механизм иммунного ответа для данной болезни.
В целях профилактики дефицита витамина Д3 в организме, его ежедневно можно принимать в небольших дозах (1-2 тыс. ед.), но при лечении эти дозы должны быть существенно выше. В течение кратковременного периода это не опасно, но в любом случае лучше проконсультироваться с врачом, поскольку имеются противопоказания.
– Если бы у вас поднялась сейчас температура и держалась сутки, какую дозу витамина Д3 вы бы приняли?
– При подозрении на коронавирусную инфекцию я бы начал принимать витамин Д3 в дозе 10-15 тыс.ед в день, а может и больше. Но принимал бы его в такой дозе только до уменьшения или прекращения симптомов болезни. Потом дозу необходимо снизить до профилактической. Витамин Д3 очень активный продукт и в больших дозах работает как сильное лекарство. Поэтому длительное его использование в очень больших дозах опасно и даже токсично для организма.
– Как еще можно помочь гуморальному иммунитету?
– Вообще-то стимуляторов гуморального иммунитета довольно много, как среди фармацевтических препаратов, так и среди продуктов природного происхождения. Препараты цинка, например, усиливают многие ферментативные процессы в клетках и активируют В-лимфоциты. Это известные стимуляторы гуморального иммунитета и выработки антител. Их применение в различных странах уже продемонстрировало хороший терапевтический эффект при COVID-19. Причем некоторые американские доктора рекомендуют очень большие дозы цинка, но не все люди их легко переносят. При повышенной кислотности цинк может раздражать желудок.
Препараты гаммаглобулинов или их фрагментов тоже хорошо работают. Показано, что введение продуктов такого рода значительно усиливает синтез антител в организме. Даже простое переливание плазмы крови способно стимулировать этот процесс.
– Вы имеете в виду плазму донора с антителами к короновирусу? Или просто обычное переливание плазмы, рутинную процедуру, которую делают, например, после операций, чтоб пациент быстрее восстановился?
– Да, я имею в виду обычное переливание плазмы. Процессы антителообразования могут стимулировать и препараты неспецифических человеческих гамма-глобулинов и даже их фрагментов. А уж гипериммунная плазма или сыворотка, с антителами к коронавирусу считается очень эффективным лекарством при данной болезни.
– Как ученый-микробиолог, что бы вы посоветовали человеку, который с большой вероятностью заразился коронавирусом? Стоит ли экстренно принять какие-то препараты? Вызвать врача? Поехать на КТ легких? Залечь в постель? Или, наоборот, больше двигаться, ходить по квартире? Делать дыхательную гимнастику?
– Я считаю, что двигаться следует как можно меньше. Нужно отлежаться! Вспомните сколько осложнений дает перенесенный «на ногах» грипп. Организм мобилизует все силы для борьбы с вирусом, а различные стрессы, переохлаждения, физические нагрузки и т. п. совершенно точно снижают активность защитных реакций при остром инфекционном процессе.
Если есть возможность, следует обязательно обратиться к врачу и выслушать его рекомендации. Кстати, не забывайте и о «втором мнении», то есть рекомендации других врачей. Любой доктор – это не господь Бог и может ошибаться.
Конечно, лечиться надо как можно раньше и интенсивно. Бездействие или недостаточно эффективное действие не способно нейтрализовать того вреда, какой наносит организму быстро размножающийся возбудитель инфекции. Я уже говорил, что в отсутствии врачебной помощи начал бы как можно раньше принимать витамин Д3 и препараты цинка.
Очень осторожно нужно относиться к приему иммуномодуляторов и интерфероногенов, поскольку большинство из них будут стимулировать нежелательные про-воспалительные реакции и в дальнейшем ухудшат ситуацию.
Китайские доктора сообщают о хорошем эффекте препаратов лакрицы (солодки) при КАК, а также гиспередина — биофлавоида из кожуры лимона и апельсина.
Доступное средство омепразол может повышать рН в эндосомах клеток и таким образом затруднять репликацию коронавируса. Он же усиливает эффект противовирусных препаратов, ингибиторов протеаз, в частности.
При першении в горле, я бы рекомендовал полоскания теплым раствором (не кипятком!) жженого сахара. В него можно добавлять соль и немного соды. Кстати, жженый сахар (без соли и соды, конечно) полезно просто рассасывать и съедать где-то по 15-20 гр. в день.
В последнее время появляется все больше работ о лечении COVID-19 с помощью ингаляций лекарственных препаратов. При такой доставке непосредственно в бронхи и легкие требуются дозы лекарств на порядок меньшие, чем обычно. Причем действуют они намного эффективнее и в основном только местно. Ингаляции можно делать с помощью обыкновенных нибулайзеров, которые продаются в любой аптеке.
На ранних этапах развития болезни ингаляции даже обыкновенного раствора соды могут быть полезны. А если встает вопрос об ингаляции каких-либо лекарств, то обязательно проконсультируйтесь с лечащим врачом.
Температуру до 38-38,5 градусов лучше вообще не сбивать. Защитные реакции врожденного иммунитета функционируют при таких температурах лучше. Если выше — можно применять парацетамол или ибупрофен. Парацетамол слабее, но считается более безопасным в плане подавления противовирусного ответа.
Можно использовать препараты интерферонов – альфа, бета, лямбда. Но гамма-интерфероны могут спровоцировать нежелательные реакции при коронавирусной инфекции.
Что касается антибиотиков, то их прием на ранних этапах болезни, (в том числе и с целью профилактики) – вопрос довольно дискутабельный. Обычно их начинают применять при затруднении дыхания, когда к патологическим процессам присоединяется вторичная микрофлора. Наиболее эффективным при COVID-19 все-таки признается азитромицин, который не только подавляет микрофлору, но и непосредственно ингибирует репликацию коронавируса. Он же усиливает действие некоторых противовирусных препаратов. Однако и другие антибиотики, применяемые для лечения респираторных инфекций, могут быть эффективны.
Поэтому антибиотик лучше иметь в запасе, но применять только в соответствии с рекомендациями врача, так как можно ошибиться с дозировкой, режимом приема и кроме того, здесь тоже имеются свои противопоказания.
А при серьезном затруднении дыхания не стоит медлить и необходимо срочно требовать госпитализацию.
Так что выбор не маленький, и незачем просто так ходить по квартире. Надо лежать и лечиться!