Основная клетка хронического воспаления
Клетки участвующие в хроническом воспалении — макрофаги и другие клетки
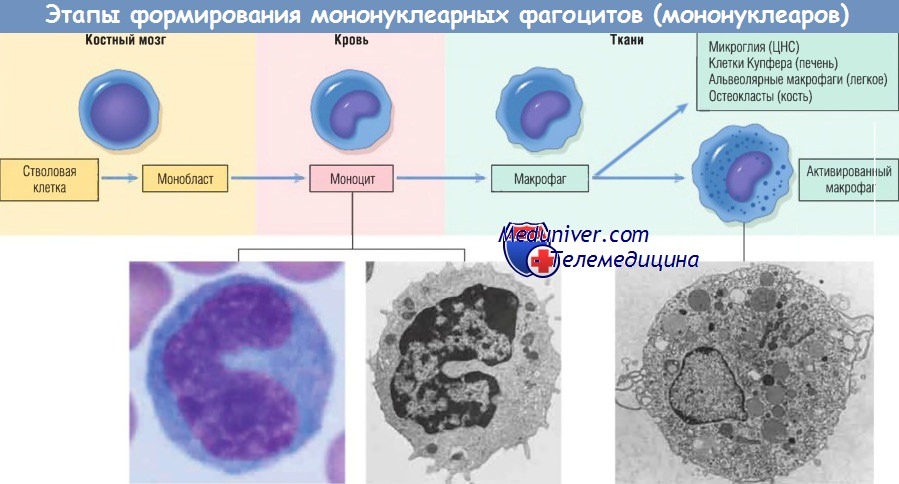
Макрофаг — главная клетка, участвующая в процессе хронического воспаления. Макрофаги являются частью системы мононуклеарных фагоцитов (иногда называемой ретикулоэндотелиальной системой), состоящей из клеток, близкородственных клеткам костного мозга, включая моноциты и тканевые макрофаги.
Тканевые макрофаги диффузно разбросаны по соединительной ткани или расположены в таких органах, как печень (клетки Купфера), селезенка и лимфатические узлы (гистиоциты синусов), легкие (альвеолярные макрофаги), а также в ЦНС (микроглия). Мононуклеарные фагоциты происходят из клеток-предшественников костного мозга, которые дифференцируются в моноциты. Из крови моноциты мигрируют в разные ткани и дифференцируются в макрофаги.
Период полужизни моноцитов длится около 1 дня, когда как период жизни тканевых макрофагов составляет несколько месяцев или лет. Превращение стволовой клетки костного мозга в тканевый макрофаг регулируется различными факторами роста и дифференцировки, цитокинами, молекулами адгезии и клеточными взаимодействиями.
Моноциты начинают мигрировать во внесосудистые ткани на ранних стадиях развития острого воспаления и в течение 48 час могут стать доминирующим типом клеток инфильтрата. Экстравазация моноцитов управляется теми же стимулами, которые участвуют в миграции нейтрофилов и представлены молекулами адгезии и химическими медиаторами с хемотаксическими и активирующими свойствами.
При попадании моноцита во внесосудистую ткань он подвергается трансформации в большую фагоцитарную клетку — макрофаг. Макрофаги активируются различными стимулами, включая микробные продукты, активирующие TLR и другие клеточные рецепторы, цитокины (например, IFN-y), секретированные сенсибилизированными Т-лимфоцитами и естественными клетками-киллерами, и другие химические медиаторы.
В результате активации макрофагов происходят элиминация таких повреждающих агентов, как микробы, и инициация процессов репарации, а также повреждение ткани (при хроническом воспалении).

Активация макрофагов приводит также к повышению уровней лизосомных ферментов и активных форм кислорода и азота, продукции цитокинов, факторов роста и других медиаторов воспаления. Некоторые из этих продуктов токсичны для микробов и организма (например, активные формы кислорода и азота) или ВКМ (протеазы); другие вызывают миграцию клеток (например, цитокины, хемотаксический стимул); третьи влияют на пролиферацию фибробластов, отложение коллагена и ангиогенез (например, факторы роста).
Разные популяции макрофагов выполняют различные функции: некоторые необходимы при киллинге микробов и воспалении, другие очень важны при репарации.
Впечатляющий арсенал медиаторов делает макрофаги мощным союзником организма в защите от непрошеных гостей, но в то же время при неправильной активации макрофаги могут вызывать значительное разрушение ткани, которое является одним из признаков хронического воспаления. Процесс разрушения ткани сам по себе может активировать каскад воспалительной реакции, поэтому одновременно могут присутствовать признаки и острого, и хронического воспаления.
При недолгом процессе воспаления, если стимул удален, макрофаги в итоге либо умирают, либо уходят в лимфатические сосуды и лимфоузлы. При хроническом воспалении происходит накопление макрофагов в результате их мобилизации из кровотока и местной пролиферации в очагах воспаления.
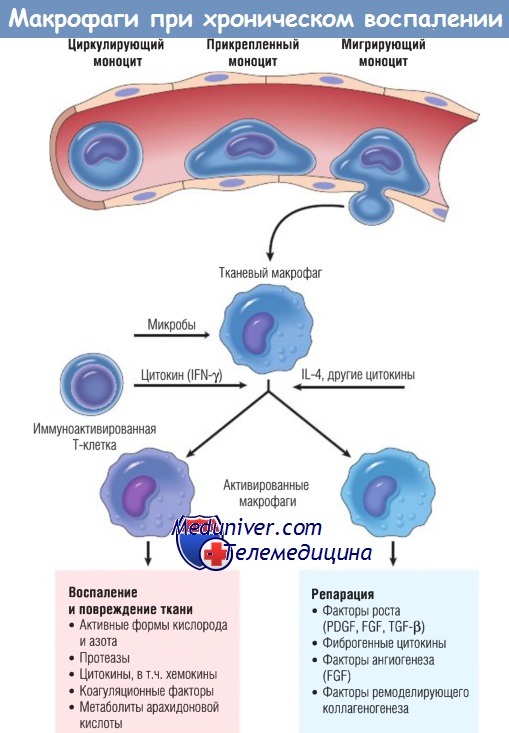
Роль активированных макрофагов при хроническом воспалении.
Макрофаги активируются неиммунными стимулами, например эндотоксином, или цитокинами из иммуноактивированных Т-клеток (особенно IFN-y).
Перечислена продукция активированных макрофагов.
FGF — фактор роста фибробластов; IFN — интерферон; IL — интерлейкин;
PDGF — тромбоцитарный фактор роста; TGF — трансформирующий фактор роста.
В развитии хронического воспаления участвуют и другие типы клеток: лимфоциты, клетки плазмы крови, эозинофилы и тучные клетки:
— лимфоциты мобилизуются в ходе как антителоопосредованных, так и клеточно-опосредованных иммунных реакций. Антиген-стимулированные лимфоциты (эффекторные клетки и клетки памяти) различных типов (Т- и В-клетки) используют разные пары адгезивных молекул (селектинов, интегринов и их лигандов) и хемокины для миграции в очаг воспаления. Цитокины активированных макрофагов, в основном TNF, IL-1 и хемокины, усиливают мобилизацию лейкоцитов, запуская стадию персистенции воспалительной реакции.
Лимфоциты и макрофаги взаимодействуют по реверсивному типу, что играет важную роль в развитии хронического воспаления. Макрофаги презентируют антигены Т-клеткам и продуцируют мембранные молекулы (костимуляторы) и цитокины (например, IL-12), которые стимулируют ответ Т-клеток. Активированные Т-клетки продуцируют цитокины, некоторые из которых мобилизуют моноциты из кровотока, и IFN-y — мощный активатор макрофагов. В результате этих взаимодействий Т-клеток и макрофагов в воспалительную реакцию вовлекается иммунная система, что делает реакцию хронической и тяжелой. Термин «иммунное воспаление» отражает наличие выраженного иммунного компонента в воспалительном процессе, например ответа Т- и В-клеток;
— клетки плазмы крови образуются из активированных В-клеток и продуцируют антитела, направленные либо против персистирующих чужеродных или собственных антигенов в очаге воспаления, либо против компонентов поврежденной ткани. При некоторых сильных воспалительных реакциях скопление лимфоцитов, антигенпрезентирующих клеток и клеток плазмы крови может напоминать морфологическое строение лимфоидного органа, особенно лимфоузла, содержащего хорошо сформированные герминативные центры.
Подобные очаги скопления лимфоцитов называют третичными лимфоидными органами. Такой тип лимфоидного органогенеза часто встречается в синовиальных оболочках у пациентов, длительно страдающих ревматоидным артритом;
— эозинофилами изобилуют иммунные реакции, опосредованные IgE и паразитарными инфекциями. Особо важный хемокин для мобилизации эозинофилов — эотаксин. Эозинофилы содержат гранулы, имеющие главный основной белок (высокоактивный катионный белок), который токсичен для паразитов, но может вызвать лизис эпителиальных клеток млекопитающих. Таким образом, эозинофилы контролируют паразитарные инфекции, но также участвуют в повреждении ткани при иммунных реакциях, например аллергии;
— тучные клетки широко распространены в соединительных тканях по всему телу и могут участвовать как в острых, так и в хронических воспалительных реакциях. Тучные клетки экспрессируют на своей поверхности рецептор FceRI, связывающийся с Fc-фракцией антитела IgE. При реакции гиперчувствительности немедленного типа антитела IgE связываются с клеточными Fc-peцепторами, специфично распознающими антиген, клетка дегранулируется и высвобождает медиаторы — гистамин и простагландины. Этот тип ответа наблюдается при пищевой аллергии, укусах насекомых, лекарственной аллергии, иногда с ужасающими исходами (например, анафилактическим шоком).
Тучные клетки тоже присутствуют при реакциях хронического воспаления и секретируют множество цитокинов, т.е. они способны как усиливать, так и ограничивать воспалительную реакцию в разных ситуациях.
Как правило, присутствие нейтрофилов характерно для острого воспаления, но и при многих формах хронического воспаления, длящегося месяцами, выявляется большое количество нейтрофилов, индуцированных либо персистирующими микробами, либо медиаторами, продуцированными активированными макрофагами и Т-лимфоцитами. При хронических бактериальных инфекциях костей (остеомиелите) нейтрофильный экссудат может сохраняться многие месяцы. Нейтрофилы также важны при хроническом воспалении в легких, индуцированном курением или другим стимулом.
Помимо мононуклеарного характера клеточного инфильтрата при хроническом воспалении часто происходит пролиферация кровеносных и лимфатических сосудов. Этот процесс стимулируют факторы роста, продуцируемые макрофагами и эндотелиальными клетками.
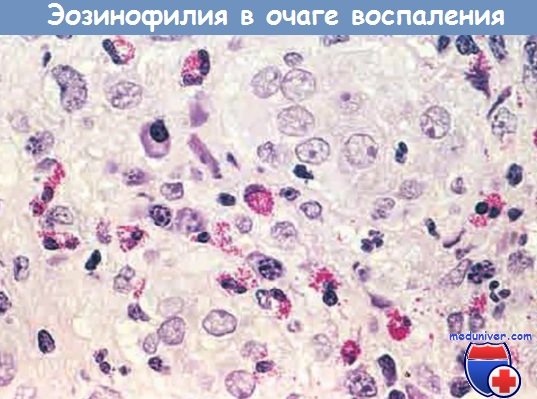
Очаг воспаления с большим количеством эозинофилов (эозинофилия)
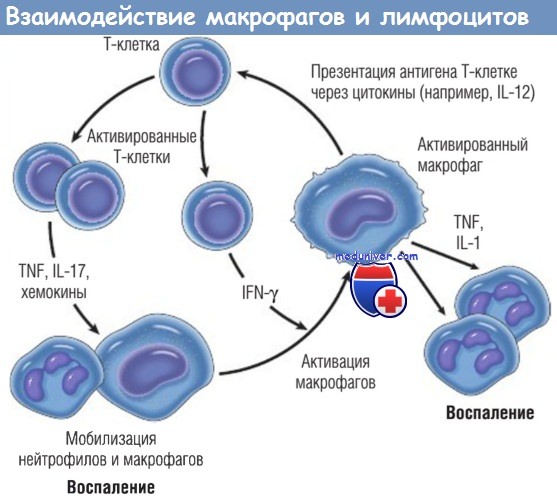
Взаимодействия макрофагов и лимфоцитов при хроническом воспалении.
Активированные Т-клетки продуцируют цитокины, которые мобилизуют макрофаги (TNF, IL-17, хемокины), и IFN-y, который является мощным активатором макрофагов.
Разные типы Т-клеток (Тh1 и Тh17) могут продуцировать различные типы цитокинов.
В свою очередь, активированные макрофаги стимулируют Т-клетки, презентируя им антигены через цитокины (например, IL-12).
IFN — интерферон; IL — интерлейкин; TNF — фактор некроза опухоли.
— Рекомендуем ознакомиться со следующей статьей «Причины и механизмы гранулематозного воспаления. Что такое гранулема?»
Оглавление темы «Патофизиология»:
- Клетки участвующие в хроническом воспалении — макрофаги и другие клетки
- Причины и механизмы гранулематозного воспаления. Что такое гранулема?
- Влияние воспаления на организм в целом (системные симптомы воспаления)
- Варианты воспалительной реакции и ее последствия
- Пути заживления и обновления тканей — репарация, регенерация
- Регуляция деления и пролиферации клеток в тканях
- Виды стволовых клеток и их характеристика
- Эмбриональные стволовые клетки и их характеристика
- Индуцированные плюрипотентные стволовые клетки (ИПСК) и их характеристика
- Где присутствуют стволовые клетки у взрослых?
Воспаление (лат. inflammatio) – это сложный процесс реакции организма на внешний или внутренний повреждающий (болезненный) фактор. Воспаление направлено на устранение этого фактора, восстановление поврежденных тканей и защиту от развития заболеваний.
Таким образом, воспаление выполняет защитную функцию в организме, но только тогда, когда оно острое. Хроническое воспаление перестает быть физиологическим фактором и становится патогеном, ведущим к аутоиммунным заболеваниям и раку.
Воспаление – это естественный процесс, который происходит на определенных этапах. Без воспалительной реакции, которая активирует иммунную систему для борьбы с патогеном, например, вирусом, бактериями, травмированными участками, мы не смогли бы пережить даже самую маленькую инфекцию.
Сложность воспалительного процесса отражается в часто используемых терминах – состояние, процесс или воспалительная реакция.
Симптомы воспаления
Симптомы острого воспаления были впервые описаны римским ученым и энциклопедистом Аврелием Цельсом (25 г. до н.э. – 50 г. н.э.). в единственной работе «Медицина», которая сохранилась до наших дней, он описал четыре основных симптома острого воспаления, которые иногда называют тетрадой Цельса:
- боль (лат. dolor);
- повышенная температура (лат. calor);
- покраснение (лат. rubor);
- отек (лат. tumor).
Пятый признак воспаления – потеря функции и повреждение органов (лат. Functiolaesa) был добавлен немного позже, возможно, греческим врачом и философом Галеном (129-200 н.э).
Покраснение кожи является результатом увеличения кровотока в области, пораженной патогенными микроорганизмами, отек – это результат проникновения белка и клеток из сосудов в ткани – все это вызывает боль. Температура также является следствием увеличения кровотока. В свою очередь, «потеря функции» означает, что орган не функционирует должным образом.
В развитии воспалительной реакции участвуют многие физиологические механизмы, связанные как с клетками – гранулоцитами, моноцитами, тромбоцитами, лимфоцитами Т и В, тучными клетками, эндотелиальными клетками кровеносных сосудов, макрофагами, фибробластами, так и с веществами, выделяемыми ими – медиаторами воспаления. Со временем могут быть поражены целые органы и могут возникнуть системные симптомы – повышение температуры тела, потеря веса, мышечная атрофия, чувство общей слабости.
Воспаление при ларингите
Как возникает воспаление?
Чаще всего повреждающий фактор, который инициирует воспалительный процесс, приходит извне. Это может быть:
- физическое повреждение – химическое, тепло или холод, механическая травма;
- биологический агент – бактерии, вирус, чужеродный белок.
Также бывает, что причиной воспаления является процесс, происходящий внутри организма – эмболия артерии, сердечный приступ или развитие рака.
Изменения в кровеносных сосудах всегда являются корнем воспалительной реакции. Сосуды расширяются, и их проницаемость увеличивается. Это приводит к проникновению медиаторов и воспалительных клеток в окружающие ткани.
Составляющие воспаления
Острое воспаление выполняет важную защитную функцию – оно удаляет возбудителя и восстанавливает нормальную функцию органа. Переход острой фазы в хроническую фазу часто связан с потерей контроля организма над воспалительными механизмами и, следовательно, с функциональными нарушениями и даже повреждением пораженной ткани. Этот процесс можно сравнить с превращением острой боли (защитной функции) в хроническую боль, которая становится самой болезнью.
Патогенез воспалительного процесса
Воспалительная реакция неразрывно связана с иммунным ответом. Начинается с контакта патогена со специализированными клетками иммунной системы, так называемыми антигенпрезентирующие клетки. Когда клетки стимулируются, они продуцируют и высвобождают медиаторы воспаления, которые имеют решающее значение для инициации и поддержания воспалительного процесса.
Медиаторы оказывают про-и противовоспалительное действие на клетки-мишени, модулируя течение воспаления. Со временем адаптивная иммунная система (специфическая реакция) также участвует в борьбе с повреждающим фактором. Работа этой системы чрезвычайно точна – взаимодействие лимфоцитов Т и В приводит к выработке специфических антител, которые селективно нейтрализуют возбудителя.
Правильно функционирующая иммунная система эффективно распознает патогены и эффективно уничтожает их, не повреждая свои собственные клетки и ткани. Однако в определенных ситуациях иммунорегуляторные механизмы могут работать с дефектом – возникает воспалительная реакция на аутоантигены.
Это состояние встречается при многих аутоиммунных заболеваниях (диабет 1 типа, ревматоидный артрит, красная волчанка, целиакия, болезнь Хашимото).
Поделиться ссылкой:
Клеточные механизмы защитных реакций организма при воспалении.Основные закономерности развития необратимых патологических изменений в клетках при первичной и вторичной альтерации Рассматривая воспаление как типовой патологический процесс, протекающий в виде последовательно сменяющих друг друга, а в ряде случаев развивающихся параллельно стадий альтерации, экссудации и пролиферации, необходимо отметить, что при определенных условиях течение воспалительных реакций может иметь как преимущественно защитно-приспособительный, так и разрушительный характер. Воздействие на ткани различных по своей природе факторов (химических, физических, бактериальных), как правило, приводит к развитию первичной альтерации. Степень выраженности и распространенность альтеративных изменений определяется интенсивностью действующего фактора, устойчивостью клеток к этому воздействию и способностью клеточных механизмов компенсировать патологические изменения. Повреждение ткани сопровождается выделением биологически активных веществ, способных еще в большей степени увеличивать альтеративные процессы — вызывать вторичную альтерацию. Независимо от особенностей воздействующего фактора, индуцирующего воспалительный процесс, все изменения в клетках можно свести к следующим типам:
Деструктивные процессы в тканях, возникающие в альтернативной стадии (фазе) воспаления, имеют преимущественно патологический характер. Их выраженностью в значительной степени определяется возможная степень неблагоприятного течения воспалительного процесса в целом. При обратимых сублетальных изменениях клетка способна адаптироваться и восстанавливать свою структуру и функцию. В этом случае, как правило, происходит снижение интенсивности метаболических процессов, ограничение потребления кислорода, угнетение процессов окислительного фосфорилирования, активирование гликолиза, уменьшение запасов макроэргических фосфорных соединений, падение уровня активности K-Na-АТФ-азы, ингибирование внутриклеточных ферментов, активирующих анаболические процессы. В процессе необратимого повреждения клетки наблюдается постепенное увеличение объема внутриклеточных структур (расширение эндоплазматической сети, набухание митохондрий, увеличение объема лизосом). Летальные изменения в клетках сопровождаются повреждением наружной и внутриклеточных мембран, в результате чего повышается их пассивная проницаемость для ионов. Одним из кардинальных признаков повреждения клетки является увеличение содержания натрия в цитозоле и выход во внеклеточную среду калия. Тяжелые метаболические расстройства клеточных функций сопровождаются увеличением содержания кальция в цитозоле. В нормальных условиях в цитоплазме регистрируется низкая концентрация кальция, не превышающая 10″‘ моль/л, которая обеспечивается непрерывной работой Са-АТФаз. Основные запасы кальция содержатся в эндоплазматическом ретикулуме, большая часть мембраны которого плотно покрыта белком с молекулярной массой 110 кДа, являющегося Са-насосом. Концентрация кальция в эндоплазматическом ретикулуме в 10 000-100 000 раз выше чем в цитозоле. Деполяризация клеточной мембраны и гидролиз мембранных липидов сопровождаются раскрытием кальциевых каналов, по которым кальций из внутриклеточных депо (цистерн эндоплазматического ретикулума, митохондрий) или интерстициального пространства устремляется в цитозоль. Возникающие в ходе воспаления метаболические нарушения энергообеспечения работы транспортных систем клеток изменяют нормальное протекание процессов реабсорбции кальция, который устремляется из кальцийсодержащих структур и внеклеточной среды в цитозоль по механизмам пассивного транспорта. — Также рекомендуем «Изменения клеток при альтеративной стадии воспаления.» Оглавление темы «Ключевые механизмы воспаления легких.»: |