Основные цитокины участвующие в воспалении

Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 июля 2019;
проверки требуют 4 правки.
Цитокины — небольшие пептидные информационные молекулы.
Цитокины имеют молекулярную массу, не превышающую 30 кD.
Цитокин выделяется на поверхность клетки А и взаимодействует с рецептором находящейся рядом клетки В. Таким образом, от клетки А к клетке В передается сигнал, который запускает в клетке В дальнейшие реакции.
Их основными продуцентами являются лимфоциты.
Кроме лимфоцитов их секретируют макрофаги, гранулоциты, ретикулярные фибробласты, эндотелиальные клетки и другие типы клеток.
Они регулируют межклеточные и межсистемные взаимодействия, определяют выживаемость клеток, стимуляцию или подавление их роста, дифференциацию, функциональную активность и апоптоз, а также обеспечивают согласованность действия иммунной, эндокринной и нервной систем в нормальных условиях и в ответ на патологические воздействия.
Термин предложен Стэнли Коэном (англ. S. Cohen) в 1974 г.[1]
Цитокины активны в очень малых концентрациях. Их биологический эффект на клетки реализуется через взаимодействие со специфическим рецептором, локализованным на клеточной цитоплазматической мембране. Образование и секреция цитокинов происходит кратковременно и строго регулируется.
Все цитокины, а их в настоящее время известно более 30, по структурным особенностям и биологическому действию делятся на несколько самостоятельных групп. Группировка цитокинов по механизму действия позволяет разделить цитокины на следующие группы:
- провоспалительные, обеспечивающие мобилизацию воспалительного ответа (интерлейкины 1,2,6,8, ФНОα, интерферон γ);
- противовоспалительные, ограничивающие развитие воспаления (интерлейкины 4,10, TGFβ);
- регуляторы клеточного и гуморального иммунитета — (естественного или специфического), обладающие собственными эффекторными функциями (противовирусными, цитотоксическими).
Спектры биологических активностей цитокинов в значительной степени перекрываются: один и тот же процесс может стимулироваться в клетке более чем одним цитокином. Во многих случаях в действиях цитокинов наблюдается синергизм. Цитокины — антигеннеспецифические факторы, поэтому специфическая диагностика инфекционных, аутоиммунных и аллергических заболеваний с помощью определения уровня цитокинов невозможна. Но определение их концентрации в крови даёт информацию о функциональной активности различных типов иммунокомпетентных клеток; о тяжести воспалительного процесса, его переходе на системный уровень и о прогнозе заболевания.
Цитокины регулируют активность гормональной оси гипоталамус-гипофиз-надпочечники:[2] например, Интерлейкин 1, воздействуя на гипоталамус, усиливает синтез кортиколиберина, что, в свою очередь, повышает выработку АКТГ.
См. также[править | править код]
- Фактор некроза опухоли (ФНО, англ. TNF)
- Фактор переноса
- Остеопонтин
Примечания[править | править код]
Ссылки[править | править код]
- Научно-практический журнал «Цитокины и Воспаление»
- Цитокины — причина парадонтита (недоступная ссылка)
- Все о цитокинах — Иммунинфо
Цитокины, являясь медиаторами межклеточных взаимоотношений, играют Центральную роль в регуляции воспалительного ответа. Цитокиновая сеть представлена множеством протеинов или гликопротеинов, вырабатываемых преимущественно активированными лимфоцитами и моноцитарно-макрофа-гальной системой, а также в меньшей мере фибробластами, эндотелиальными, соматическими клетками, в том числе клетками эндометрия и трофобласта.
Первыми представителями этого класса явились ИФН, впервые описанные в 1957 г. A.Isaacs и J.Lindemann. В 1960-х годах были обнаружены новые белковые регуляторные молекулы, способные управлять процессами активации,
54Глава I
Таблица 1.10 Участие цитокинов в реакции воспаления
| Функция | Цитокин |
| Провоспалительные | ИЛ-ip, ИЛ-6, ИЛ-8, ИЛ-12, ИЛ-18, ФНО-а, ИФН-у |
| Противовоспалительные | ИЛ-4, ИЛ-10, ТФР-р |
| Регуляторные | ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИФН-у, ТФР-р |
пролиферации и дифференцировки лимфоцитов и гемопоэтических клеток. L.A.Aarden в 1979 г. предложил термин «интерлейкин», подчеркивая способность цитокинов служить коммуникационными сигналами для клеток различных популяций лейкоцитов.
Цитокины представляют собой обширное семейство биологически активных пептидов, оказывающих гормоноподобное действие и обеспечивающих взаимодействие клеток иммунной, кроветворной, нервной и эндокринной систем. Цитокины объединяют следующие общие свойства: 1) они служат медиаторами иммунной и воспалительной реакций; 2) проявляют свою активность при концентрациях порядка 10—11 моль/л; 3) действуют как факторы роста и факторы дифференцировки клеток; 4) образуют регуляторную сеть; 5) обладают плейо-тропной активностью и перекрывающимися функциями. Хотя цитокины и называют иногда гормонами иммунной системы, от гормонов их отличает способ передачи сигнала клетке. Так, если гормоны вступают во взаимодействие с цито-зольными рецепторами, которые встраиваются затем в ДНК, то цитокины специфически связываются с поверхностным рецептором, через который происходит передача сигнала внутрь клетки с помощью системы вторичных мессенджеров. Как правило, рецептор для цитокина состоит из нескольких полипептидных цепей. Последние могут отличаться по своей специфичности, аффинности и способности передавать сигнал. Существует два принципиально различных механизма торможения биологической активности цитокинов. Один — быстрый, за счет связывания цитокина растворимыми рецепторами или специфическими антагонистами. Другой механизм торможения (медленный) обеспечивается гормонами (например, глюкокортикоидами) или другими цитокинами, воздействие которых тормозит синтез цитокинов клеткой. В зависимости от выполняемой функции принято различать провоспалительные, противовоспалительные и регуляторные цитокины (табл. 1.10). С учетом такого важного свойства цитокинов, как плейо-тропность, это разделение носит в достаточной мере условный характер.
Одной из важнейших функций системы цитокинов является обеспечение согласованного действия иммунной, эндокринной и нервной систем в развитии реакции воспаления. Так, на месте внедрения инфекции обычно имеет место массивный выброс провоспалительных цитокинов (ИЛ-1в, ИЛ-6, ИЛ-12, ФНО-а). При превышении в крови пороговых концентраций эти цитокины способны преодолевать в преоптической области гематоэнцефалический барьер и стимулировать высвобождение кортикотропин-рилизинг-гормона, который, в свою очередь, стимулирует продукцию АКТГ гипофизом.
Следующим этапом является усиление синтеза кортизола надпочечниками. Одновременно происходит активация симпатической нервной системы, что сопровождается повышенным высвобождением катехоламинов (адреналина и норадреналина). Как глюкокортикоиды, так и катехоламины активно вмешиваются в течение воспалительного процесса. Основными мишенями кортизола и норадреналина являются моноциты/макрофаги и Тh1-лимфоциты. В резуль-
Генитальные инфекции и факторы противоинфекционной защиты в генезе
воспалительных заболеваний женских половых органов 55
тате происходит торможение продукции макрофагами провоспалительных цитокинов и стимулируется синтез противовоспалительного цитокина ИЛ-10. Последний вместе с кортизолом и норадреналином снижает продукцию ИЛ-2 и ИФН-у Тh1-лимфоцитами. Таким образом, активация гипоталамо-гипофи-зарно-надпочечниковой оси (ГГНО) и симпатической нервной системы снижает интенсивность воспалительного процесса, предотвращая тем самым повреждение внутренних органов медиаторами воспаления. Однако в ряде случаев, например при хронической инфекции, подавить реакцию воспаления не удается. В очаг воспаления продолжается рекрутирование лимфоцитов, и синтез цитокинов остается достаточно высоким. Это приводит к формированию порочного круга, при котором равновесие между про- и противовоспалительными цитокинами оказывается нарушенным. При этом противовоспалительные агенты (глюкокортикоиды, катехоламины), не будучи в состоянии ликвидировать очаг воспаления, существенно угнетают Тh1 -лимфоциты, практически не влияя при этом на Тh2-клетки. В результате образовавшегося сдвига в пользу Тh2 имеет место повышение продукции таких цитокинов, как ИЛ-4 и ИЛ-5, которые являются медиаторами синтеза низкоаффинных IgE-антител В-лимфоцитами (Пухальский А.Л., Шмарина Г.В., Капранов Н.И., 2004).
Воспалительный процесс может проявляться в виде как локальных, так и системных изменений, свидетелями которых могут быть различные маркеры воспаления, включая цитокины (Pukhalsky A.L., Shmarina G.V. et al., 2004). Для получения объективной картины патологического процесса при воспалительных заболеваниях женских половых органов необходимо исследовать маркеры воспаления в крови и цервикальной слизи.
Наиболее информативными маркерами воспаления при исследовании цервикальной слизи являются ФНО-а, ИЛ-4, ИФН-у, ИЛ-10 и ТФР-р. Эти показатели не только могут дать представление об интенсивности местного воспалительного процесса, но и укажут на сдвиги равновесия между Тh1- и Тh2-компо-нентами иммунного ответа, а также о преобладании про- или противовоспалительных механизмов его реализации. Однако многие цитокины (ФНО-а и ИЛ-10) могут присутствовать в биологических жидкостях не только в виде свободных биологически активных молекул, но и в связанном виде — в виде комплекса, состоящего из цитокина и его ингибитора. Исходя из этого целесообразно использовать соответствующие диагностические наборы, способные определять как свободный цитокин, так и общий (свободный + связанный). Так, например, обнаружение высокого содержания общего ФНО-а при низком или нулевом содержании свободного цитокина, с одной стороны, свидетельствует об активации клеток — продуцентов ФНО-а, что может быть связано с наличием хронического источника инфекции, а с другой стороны — указывает на активную роль противовоспалительных механизмов. Исследование соотношения между уровнем ИФН-у и ИЛ-4 позволяет судить о развитии иммунного ответа по ТЫ- или Тп2-типу.
Исследование сыворотки крови позволяет судить о наличии системных изменений у данного пациента в условиях наличия локального очага воспаления. При этом, помимо исследования содержания цитокинов, может быть использован метод оценки индивидуальной чувствительности лимфоцитов периферической крови к антипролиферативному действию глюкокортикоид-ных гормонов. Производят определение параметра Ah, который характеризует количество активированных лимфоцитов в кровотоке и может иметь как отрицательное, так и положительное значение (Pukhalsky A.L., Kapranov N.I. et al., 1999; Pukhalsky A.L., Kalashnikova E.A. et al., 1990). Если величина 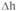 <0, это
<0, это
56 Глава I
свидетельствует о том, что большую часть лимфоцитов периферической крови составляют покоящиеся лимфоциты, чей пролиферативный ответ на стимуляцию фитогемагглютинином (ФГА) может быть заблокирован глюкокортикои-дами. Положительные значения 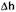 свидетельствуют о наличии в периферической крови большого количества активированных лимфоцитов, резистентных к антипролиферативному действию гормона. Такого рода резистентность связана с тем, что в активированных лимфоцитах уже произошло образование мРНК для ИЛ-2, и глюкокортикоиды не могут подавить синтез этого цитоки-на. Если средние значения величины Дп существенно превышают ноль, это можно рассматривать как свидетельство персистенции в крови большого количества клеток, активированных в очаге воспаления. В результате успешной антибактериальной терапии воспалительная реакция затухает и количество активированных лимфоцитов в крови уменьшается. Отражением этого процесса является повышение чувствительности лимфоцитов к антипролиферативному действию глюкокортикоидных гормонов. Важным элементом мониторинга реакции воспаления является определение высоты пролиферативного ответа лимфоцитов на Т-клеточные митогены (ФГА). Обычно при хронизации воспалительного процесса в результате сдвига иммунного ответа в направлении Th2 ответ лимфоцитов на ФГА оказывается сниженным. Напротив, при положительной динамике заболевания происходит переключение иммунного ответа на Thl-тип, что сопровождается существенным повышением высоты пролиферативного ответа лимфоцитов периферической крови на стимуляцию ФГА.
свидетельствуют о наличии в периферической крови большого количества активированных лимфоцитов, резистентных к антипролиферативному действию гормона. Такого рода резистентность связана с тем, что в активированных лимфоцитах уже произошло образование мРНК для ИЛ-2, и глюкокортикоиды не могут подавить синтез этого цитоки-на. Если средние значения величины Дп существенно превышают ноль, это можно рассматривать как свидетельство персистенции в крови большого количества клеток, активированных в очаге воспаления. В результате успешной антибактериальной терапии воспалительная реакция затухает и количество активированных лимфоцитов в крови уменьшается. Отражением этого процесса является повышение чувствительности лимфоцитов к антипролиферативному действию глюкокортикоидных гормонов. Важным элементом мониторинга реакции воспаления является определение высоты пролиферативного ответа лимфоцитов на Т-клеточные митогены (ФГА). Обычно при хронизации воспалительного процесса в результате сдвига иммунного ответа в направлении Th2 ответ лимфоцитов на ФГА оказывается сниженным. Напротив, при положительной динамике заболевания происходит переключение иммунного ответа на Thl-тип, что сопровождается существенным повышением высоты пролиферативного ответа лимфоцитов периферической крови на стимуляцию ФГА.
Таким образом, исследование маркеров воспаления при заболеваниях женских половых органов позволяют ответить на ряд важных вопросов, существенных для выбора тактики дальнейшей терапии. Прежде всего можно установить, в какой мере затронуты центральные механизмы иммунорегуля-ции. Существенный сдвиг иммунного ответа в сторону Th2 требует назначения адекватной иммунокорригирующей терапии. При обнаружении признаков центральной иммуносупрессии следует попытаться разорвать сложившийся порочный круг, воздействуя на различные его звенья.
Цитокины – это обширное семействе биологически активных пептидов, которые обладают гормоноподобным действием и обеспечивают взаимодействие клеток иммунной, кроветворной, эндокринной и нервной систем.
В зависимости от клеток-продуцентов различают интерлейкины, монокины и лимфокины. Совокупность цитокинов иммунной системы образует «каскад цитокинов». Антигенная стимуляция приводит к секреции цитокинов «первого поколения» — фактора некроза опухоли α, интерлейкинов -1 β и — δ, которые индуцируют биосинтез центрального регуляторного цитокина ИЛ-2, а также ИЛ-3, ИЛ-4, ИЛ-5, γ-интерферона (цитокинов второго поколения). В свою очередь цитокины второго поколения влияют на биосинтез ранних цитокинов. Такой принцип действия позволяет вовлекать в реакцию все возрастающее число клеток.
Основными продуцентами цитокинов являются Т-хелперы и макрофаги.
В процессе роста и дифференцировки клеток крови, а также развития иммунною ответа происходит модуляция (индукция, усиление, ослабление) экспрессии рецепторов, в результате чего меняется способность той или иной клетки отвечать на определенный цитокин. Модуляторами экспрессии рецепторов нередко служат цитокины, причем в некоторых случаях цитокин способен изменять экспрессию собственного рецептора.
Основные свойства цитокинов:
- синтезируются в процессе иммунного ответа;
- регулируют процесс иммунною ответа;
- проявляют активность при очень низких концентрациях;
- являются факторами роста и дифференцировки клеток;
- способны выполнять несколько функций в широком круге тканей и клеток (плейотропный эффект);
- способны оказывать сходные биологические эффекты (феномен дублирования);
- могут продуцироваться самыми разнообразными клетками.
К провоспалительным цитокинам относятся ИЛ-1β, ИЛ-2, ИЛ-6, ИЛ-8, γ-ИФН, ФНО-α, а к антивоспалительным — ИЛ-4, ИЛ-10, ИЛ-13.
Сегодня выделяют такие классы цитокинов:
- интерлейкины (выполняющие многочисленные функции);
- интерфероны (ограничивают распространение внутриклеточных инфекций и оказывают иммунорегуляторный эффект);
- колониестимулирующие факторы (регулируют дифференцировку и деление предшественников лейкоцитов);
- хемокины (репетируют миграцию клеток в очаг воспаления);
- факторы некроза опухоли (оказывают провоспалительный эффект и опосредуют индукцию апоптоза скомпрометированных клеток);
- факторы роста (регулируют пролиферацию разнообразных клеток, что способствует заживлению ран и восполнению дефектов, причиненных воспалением).
см. Интерлейкины
Колониестимулирующие факторы
Гранулоцит-макрофаг колониестимулирующий фактор α
Гранулоцит-макрофаг колониестимулирующий фактор α (GM-CSF-α) наряду с ИЛ-3 относится к ранним полипотентным гемопоэтическим факторам. Поддерживает клональный рост костномозговых предшественников гранулоцитов-макрофагов. Клетками-мишенями GM-CSF служат также зрелые гранулоциты, моноциты, эозинофилы. Он стимулирует антимикробную и противоопухолевую активность нейтрофилов, эозинофилов и макрофагов, индуцирует биосинтез ими некоторых цитокинов (ФНО- α, ИЛ-1, M-CSF). GM-CSF ингибирует миграцию нейтрофилов, способствуя их накоплению в зоне воспаления. Продуцентами GM-CSF являются стимулированные Т-лимфоциты, моноциты, фибробласты, эндотелиальные клетки.
Гранулоцит-колониестимулирующий фактор
Гранулоцит-колониестимулирующий фактор (G-CSF) является более поздним гемопоэтическим фактором, чем GM-CSF. Стимулирует рост колоний почти исключительно гранулоцитов и активирует зрелые нейтрофилы. Секретируется макрофагами, фибробластами, клетками эндотелия и стромы костного мозга. Клиническое применение G-CSF направлено на восстановление числа нейтрофилов в крови при лейкопении.
Макрофаг-колониестимулирующий фактор
Макрофаг-колониестимулирующий фактор (M-CSF) стимулирует роет макрофагальных колоний из костномозговых предшественников. Вызывает пролиферацию и активирует зрелые макрофаги, индуцируя биосинтез ими ИЛ-1β, G-CSF, интерферонов, простагландинов, усиливая их цитотоксичность по отношению к инфицированным и опухолевым клеткам. Продуцентами цитокина являются фибробласты, эндотелиальные клетки и лимфоциты.
Эритропоэтин
Эритропоэтин является основным цитокином, регулирующим образование эритроцитов из незрелых костномозговых предшественников Основным органом, в котором происходит образование эритропоэтина в процессе неонатального развития, является печень. В постнатальном периоде он продуцируется прежде всего ночками.
Хемокины — специализированные цитокины, вызывающие направленное движение лейкоцитов. У человека описано более 30 различных хемокинов.
Хемокины вырабатываются лейкоцитами, тромбоцитами, клетками эндотелия, эпителия, фибробластами и некоторыми другими клетками. Регуляцию продукции хемокинов осуществляют про- и противовоспалительные цитокины. Хемокины классифицируют в зависимости от местоположения в молекуле первых двух цистеиновых остатков. При этом различают следующие разновидности молекул:
- α -хемокины — хемоаттрактанты нейтрофилов (ИЛ-8, ИЛ-10 и др.);
- β -хемокины — принимают участие в развитии затяжного воспаления (RANTES, MIP-1, -2, -3, -4);
- γ -хемокины — хемоаттрактанты CD4+ и CD8+ Т-лимфоцитов, а также естественных киллеров (лимфотактин);
- фракталкин — специфический для Т-лимфоцитов хемокин;
- хемокины липидной природы (в частности, тромбоцитактивирующий фактор).
Фактор некроза опухоли α (ФНО-α) является одним из центральных регуляторов врожденного иммунитета (наряду с ИЛ-1β, α/ β-ИФН). Проявляет множество биологических активностей, значительная часть которых аналогична ИЛ-1β. Длительное пребывание ФНО-α в кровотоке приводит к истощению мышечной и жировой ткани (кахексии) и супрессии кроветворения. Многие биологические эффекты ФНО-α потенцируются γ-ИФН. Основными клетками-продуцентами цитокина являются макрофаги, секретирующие его при стимуляции бактериальными продуктами, а также естественные киллеры (ЕК).
Лимфотоксин
Лимфотоксин (ЛТ, ФНО-β) является одним из первых описанных цитокинов. Спектры биологической активности ЛТ и ФНО-α идентичны. Цитокин может играть роль в противоопухолевом, противовирусном иммунитете и иммунорегуляции. Клетками-продуцентами ЛТ являются активированные Т-лимфоциты. Материал с сайта https://wiki-med.com
Трансформирующий фактор роста
Трансформирующий фактор роста β (ТФР-β) является полифункциональным цитокином, секретируется Т-лимфоцитами на поздних стадиях активации и оказывает супрессирующее действие на пролиферацию Т- и В-клеток. Может продуцироваться также макрофагами, тромбоцитами, клетками почек и плаценты. Ингибирует образование цитотоксических Т-лимфоцитов и активацию макрофагов. В отношении полиморфноядерных лейкоцитов он выступает как антагонист провоспалительных цитокинов. Таким образом, он является элементом отрицательной обратной регуляции иммунного ответа и прежде всего воспалительной реакции. В то же время он важен для развития гуморального ответа, а именно — для переключения биосинтеза иммуноглобулинов на IgA. Также этот цитокин вызывает рост сосудов (стимулирует процесс ангиогенеза). Попытки терапевтического применения ТФР-β связаны в первую очередь с его способностью ускорять заживление ран.
Цитокины и воспаление
см. Цитокины и воспаление
Цитокины рассматриваются как перспективные терапевтические препараты. Многие из них успешно прошли клинические испытания в качестве противоопухолевых средств (ИЛ-2), стимуляторов гемопоэза (GM-CSF), средств для лечения атопических заболеваний (γ -ИФН).
 На этой странице материал по темам:
На этой странице материал по темам:
белки острой фазы википедия
утилизация цитокинов
цитокины на цитокины
цитокины презентация
цитокины.интерлейкины и какие препараты к ним относятся
