Перекисное окисление липидов при воспалении
[06-359]
ПОЛ (перекисное окисление липидов)
1900 руб.
Исследование, направленное на выявление в образце крови продуктов перекисного окисления липидов и их активности в целях оценки роли данных веществ в реакциях окислительного повреждения клеток организма (так называемого окислительного стресса).
Синонимы русские
Перекисное окисление липидов; оценка окислительного повреждения (окислительного стресса).
Синонимы английские
Lipid peroxidation; assessment of oxidative damage (oxidative stress).
Метод исследования
Спектрофотометрия.
Единицы измерения
Мкмоль/л (микромоль на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.
- Не принимать пищу в течение 2-3 часов до исследования, можно пить чистую негазированную воду.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Перекисное окисление липидов – это химический процесс, каскад реакций превращения липидов (поступающих с пищей или синтезированных в организме) с участием свободных радикалов – активных заряженных молекул. Так как липиды — компоненты мембран всех клеток организма, реакции перекисного окисления могут приводить к нарушению их структуры и повреждению клетки, что является одним из механизмов патогенеза ряда заболеваний.
Реакции ПОЛ постоянно происходят в организме в норме в определенной степени, которая не должна превышаться во избежание их повреждающего действия. Перекисное окисление липидов играет важную роль для процесса апоптоза, регулирования структуры мембран и их функций (презентация рецепторов, работа ионных каналов, высвобождение биологически активных веществ, передача сигналов между клетками и т.д.).
Чрезмерная активность ПОЛ может приводить к разрушению мембраны клетки, проникновению или выходу из нее веществ, которых не должно быть в норме, что ведет к нарушению жизнедеятельности клеток (их преждевременное старение, разрушение, измененные функции передачи веществ, связывания ферментов и рецепторов). Повышенная активность ПОЛ может быть причиной развития сердечно-сосудистых заболеваний (атеросклероза и сопутствующей патологии), поражения ЦНС, воспалительных процессов, заболеваний респираторного тракта, одним из факторов новообразований, нарушения функции иммунной системы.
В организме в роли ингибирующего фактора (т.е. сдерживающего реакции ПОЛ) выступает антиоксидантная система. Таким образом, патологические реакции перекисного окисления липидов могут быть как при чрезмерной активности самих этих процессов, так и при недостаточности работы антиоксидантной системы.
Исследование позволяет оценить количественно, насколько активно протекают реакции ПОЛ в организме и насколько с ними справляются собственные защитные системы организма. Такой анализ продуктов перекисного окисления липидов играет важную роль в определении связи их повреждающего действия с возникновением, развитием или прогрессированием того или иного заболевания. Исследование проводится методом спектрофотометрии, основанным на изучении физико-химических свойств веществ, в частности их спектров поглощения. Таким способом из образца венозной крови пациента выделяются анализируемые вещества, а затем происходит их количественный подсчет, выражаемый в мкмоль/л. Спекрофотометрический метод оценки продуктов перекисного окисления липидов — достаточно современный и точный (погрешность составляет +/- 5,2 %), отличается высокой специфичностью (за счет использования определенных длин волн), чувствительностью (1,0 нмоль/л) и достоверностью, о чем свидетельствует низкий процент ложноположительных и ложноотрицательных результатов (достоверность более 90 %).
Таким образом, анализ продуктов реакций ПОЛ позволяет понять механизмы развития серьезных заболеваний, определить так называемый маркер окислительного стресса организма. При своевременно выявленном нарушении есть возможность оптимально подобрать лечение и предотвратить развитие заболевания, его прогрессирование, направить его течение по более благоприятному варианту. Следует отметить, что интерпретация результата осуществляется только врачом с учетом всех имеющихся данных анамнеза и других методов диагностики.
Для чего используется исследование?
- Для диагностики оксидативного стресса и степени интоксикации организма вследствие повышенной активности реакций перекисного окисления липидов.
- Для выявления дефицита антиоксидантной системы и оценки риска заболеваний, ассоциированных с ее недостатком (заболевания сердечно-сосудистой системы, иммунодефициты, доброкачественные и злокачественные опухоли, гормональные нарушения, аутоиммунные заболевания, воспалительные процессы и др.).
- Для выявления генетических форм дефицита ферментов.
Когда назначается исследование?
- При заболеваниях сердечно-сосудистой системы (атеросклеротическое повреждение сосудов, ишемическая болезнь сердца, гипертоническая болезнь).
- При метаболических заболеваниях (в первую очередь, при сахарном диабете).
- При предраковых заболеваниях и злокачественных новообразованиях.
- При заболеваниях дыхательной системы (ХОБЛ, бронхиальная астма).
- При поражении ЦНС (болезнь Паркинсона, болезнь Альцгеймера, ОНМК, энцефалопатии).
- При аутоиммунных заболеваниях (ревматоидный артрит, системная красная волчанка, диффузная склеродермия).
- При бесплодии и привычном невынашивании беременности.
- При хронических инфекциях и воспалительных процессах.
- При подозрении на врождённый дефицит ферментов.
Что означают результаты?
Референсные значения: 2.2 – 4.8 мкмоль/л.
При повышении результата относительно референсного диапазона можно рассматривать процесс перекисного окисления липидов как фактор развития или прогрессирования какого-либо патологического процесса. Это позволяет подбирать терапию, исходя из патогенетического процесса, т.е. механизма развития патологии, что делает ее наиболее оптимальной.
Также рекомендуется
- Клинический анализ крови: общий анализ, лейкоцитарная формула, СОЭ (с микроскопией мазка крови при выявлении патологических изменений)
- Базовые биохимические показатели
Кто назначает исследование?
Терапевт, врач общей практики, кардиолог, эндокринолог, онколог, пульмонолог, токсиколог, нутрициолог.
Литература
- Halliwell B, Chirico S. Lipid peroxidation: its mechanism, measurement, and significance. Am J Clin Nutr. 1993 May; 57.
- Ramana KV, Srivastava S, Singhal SS. Lipid peroxidation products in human health and disease 2014. Oxid Med Cell Longev. 2014;2014:162414.
- Niki E. Lipid peroxidation products as oxidative stress biomarkers. Biofactors. 2008;34(2):171-80.
- Gaschler MM, Stockwell BR. Lipid peroxidation in cell death. Biochem Biophys Res Commun. 2017 Jan 15; 482(3):419-425.
Причины воспаления пародонта. Перекисное окисление липидов (ПОЛ) и его роль
Лейкоциты, адгезировавшиеся на эндотелии сосудов, начинают генерировать целый ряд цитотоксических соединений, что приводит к образованию свободных радикалов. Все эти соединения разрушают эндотелий, увеличивая его проницаемость. Последнее непосредственно приводит к периваскулярному отеку, способствуя тяжелым ишемическим расстройствам в тканях.
Происходящее вследствие первичного воспалительного ответа ухудшение трофики тканей пародонта, в свою очередь, вызывает еще большее нарушение кислородного питания тканей и изменение энергетического процесса, обеспечивающего жизнеспособность клеток. Ухудшение микроциркуляции при пародонтите усугубляется тем, что ПОЛ снижает антиагрегационную способность тканей пародонта. Образуются лейкоцитарно-тромбоцитарные агрегаты, которые блокируют микроциркуляторное русло, включая даже относительно крупные артериолы. Это усугубляет ишемию тканей, способствует дальнейшему развитию отека.
В результате накопления высокотоксичных продуктов в основном веществе и всех структурах соединительной ткани нарастает кислотность среды, нарушается созревание остеобластов и активируется функция остеокластов.
В здоровом организме соотношение между свободнорадикальным окислением и антиоксидантной защитой оптимальное. Хроническое течение ВЗП и нарастающие при этом гипоксия и поражение ферментных систем клеток способствуют постепенному падению антиоксидантной активности тканей — фактически последнего наиболее устойчивого механизма защиты.
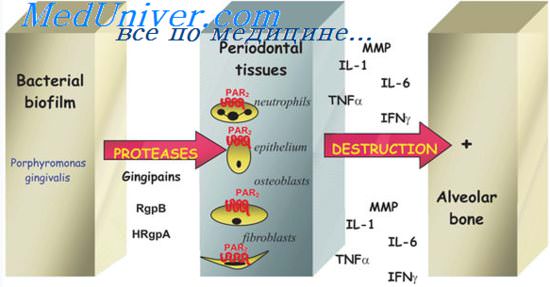
При заболеваниях пародонта необходима оптимизация взаимодействия свободнорадикального окисления и антиоксидантной защиты. Поэтому при профилактике пародонтита патогенетически обосновано применение антиоксидантов и антигипоксантов: токоферол, аскорбиновая кислота, мексидол, которые ингибируют свободнорадикальное окисление.
Перекисное окисление липидов (ПОЛ) — это свободнорадикальный процесс, протекающий на полиненасыщенных жирных кислотах с образованием активных форм кислорода.
Источники активных форм кислорода:
• оксидантные реакции;
• оксигеназные реакции;
• комплексирование кислорода;
• образование синглетного кислорода;
• образование активных форм кислорода фагоцитирующими клетками;
• реакция аутоокисления гемоглобина;
• реакция протеолиза;
• окисление эндогенных катехоламинов. Наиболее активные формы радикалов кислорода:
• супероксидный анионрадикал 02;
• перекись водорода;
• гидроксильный радикал ОН.
АОС — это весь комплекс процессов, включающих систему генерации радикалов кислорода и липидных гидроперекисей.
Состояние процессов свободнорадикального окисления липидов в ротовой жидкости и десневой крови оценивают по активности АОС и ПОЛ. Скрининговым методом для оценки состояния процессов ПОЛ и АОС является индуцированная биохемилюминесценция, при которой происходит каталитическое разложение перекиси водорода ионами металла с переменной валентностью — двухвалентного железа.
Данные биохемилюминесцентного анализа продемонстрировали, что показатели антиоксидантной активности не зависят от степени тяжести заболевания, но имеют сильную зависимость от активности процессов воспаления в пародонте. Так, у большинства пациентов с хроническим генерализованным пародонтитом показатели антиоксидантной активности находились в пределах нормы, тогда как у лиц с БПП были снижены. Это свидетельствует об истощении АОС при длительных активных воспалительно-деструктивных процессах в тканях пародонта.
— Также рекомендуем «Фосфатидилинозиты. Влияние и обмен фосфатидилинозитов»
Оглавление темы «Диагностика и лечение воспалений парадонта»:
1. Причины воспаления пародонта. Перекисное окисление липидов (ПОЛ) и его роль
2. Фосфатидилинозиты. Влияние и обмен фосфатидилинозитов
3. Цитологическое исследование пародонта. Техника цитологии пародонта
4. Функциональное исследование пародонта. Реопародонтография
5. Лазерная допплеровская флоуметрия (ЛДФ). Оценка кровотока в пародонте
6. Допплерография пародонта. Ультразвуковая остеометрия — эхоостеометрия
7. Прогнозирование течения пародонтита. Прогноз лечения воспаления пародонта
8. Начальное лечение заболеваний пародонта. Виды местной анестезии в стоматологии
9. Антибиотики при лечении парадонтита. Производные имидазола при парадонтите
10. Антисептики при парадонтите. Местное лечение парадонтита
Комментарии
Опубликовано в журнале:
« Поликлиника » 4/2015 Л.А. Звенигородская, Т.В. Нилова, А.В. Петраков, МКНЦ (ЦНИИГ), Москва
В настоящее время неалкогольная жировая болезнь печени (НАЖБП) считается одним из основных факторов риска сердечно-сосудистых заболеваний. Печень играет важную роль в развитии атерогенной дислипидемии. [4,7] При прогрессировании ожирения увеличивается поступление в печень свободных жирных кислот [9,13] , в результате происходит усиление процессов перекисного окисления липидов. [2,15,17,]
Воздействие токсических форм кислорода на ненасыщенные жирные кислоты (фосфолипидов, триглицеридов, эфиров холестерина) ведет к разрушению этих кислот и появлению токсичных альдегидов как малоновый диальдегид (МДА). Накопление перекисей липидов в тканях сопровождается разрушением молекулярной структуры мембран. Фосфолипиды являются важнейшими компонентами клеточных мембран и представлены в основном фосфатидилхолинами. Фосфолипидный состав определяет жидкокристаллические свойства и проницаемость мембраны. [16] Мембраны обеспечивают нормальную работу белков транспортеров, ферментов, катализирующих процессы окисления, клеточного дыхания, окислительного фосфорилирования. При НАЖБП наблюдается снижение содержания фосфатидилхолина в гепатоцитах. [14 ] Фосфатидилхолин синтезируется в гепатоцитах при достаточном уровне холина. Интенсификация процессов перекисного окисления липидов (ПОЛ) зависит от степени повреждения мембран гепатоцитов. Накопление ПОЛ в гепатоцитах играет большую роль в нарушении их ультраструктуры. Перекисный и фосфолипазный механизмы повреждения липидов тесно связаны. ФЛА2 связана в плазме с атерогенными частицами ЛПНП, является высоко специфичным маркером васкулярного воспаления. [6] Повышенный уровень ФЛА2 в сыворотке крови указывает на наличие бляшки, склонной к разрыву и является независимым фактором риска сердечно-сосудистых заболеваний, в том числе коронарного атеросклероза, инфаркта миокарда и инсульта. [12,18]
Ключевые слова: неалкогольная жировая болезнь печени, малоновый диальдегид фосфолипаза А2,оксид азота, эндотоксин.
Цель настоящего исследования – определить уровень малонового диальдегида (МДА) у больных НАЖБП в сыворотке крови и его связь с повреждением мембран гепатоцитов в зависимости от морфологической картины заболевания. Выявить взаимосвязь перекисного и фосфолипазного механизма повреждения мембран гепатоцитов с другими маркерами воспаления эндотоксином и оксидом азота.
Материалы и методы исследования
Обследовано 80 больных НАЖБП (59 женщин и 21 мужчина). Средний возраст 53,5±9,5 лет. Индекс массы тела (ИМТ) более 30 кг/м2. Диагноз был верифицирован клиническими, биохимическими, инструментальными и морфологическими методами исследования. Основные морфологические изменения обследованных больных характеризовались крупнокапельной жировой дистрофией гепатоцитов. [См. рис. 4, 5, 6 (Морфология)] При анализе биохимических показателей в 40% случаев отмечено повышение аминотрансфераз и ГГТП в 2–3 раза. Показатели липидного спектра обследуемых больных характеризовались повышением общего холестерина, ХС ЛПНП, ТГ и снижением ХС ЛПВП.
Содержание ФЛА2 определяли иммуноферментным методом с помощью диагностических наборов PLAC TEST Elisa Kit(CША). Метод позволяет провести измерение белка секретируемой ФЛА2 при использовании высокоспецифичных моноклональных антител. ПОЛ определяли по содержанию МДА с тиобарбитуровой кислотой. [1] Для определения эндотоксина применяли хромогенный метод по конечной точке с использованием ЛАЛ теста (Limulus amebocyte lysate, США). Уровень метаболитов оксида азота определяли скрининг-методом в биологических жидкостях как маркер дисфункции эндотелия с хлоридом ванадия (Германия). [11] Статистическую обработку данных провели с использованием программ «Биостат» и Статистика.
Введение
Свободнорадикальные реакции ПОЛ протекают во всех клетках и тканях живых организмов, в основном в биомембранах, и представляют собой каскад окислительных реакций деградации ненасыщенных жирных кислот, входящих в состав фосфолипидов. В клетках здорового организма уровень ПОЛ является жизненно важным звеном в регуляции проницаемости и транспорта веществ через мембраны, в синтезе простагландинов, метаболизме стероидных гормонов и других клеточных механизмах. [3]
Окислительные реакции с участием свободных радикалов рассматриваются в настоящее время как необходимый процесс в регуляции клеточного метаболизма. Особо важное значение ПОЛ для организма заключается в обновлении мембран клеток. При нарушении структуры и функции клеточной мембраны изменяется концентрация ионов по обе стороны мембраны, повреждаются функции сигнальных и транспортных систем. Это приводит к развитию инсулинорезистентности.
Полиненасыщенные жирные кислоты (ПНЖК) являются субстратами для синтеза простагландинов. Избыток кальция активирует фосфолипазу А2, что отражается на структуре фосфолипидов, в митохондриях уменьшается содержание фосфатидилхолина и фосфатидилэтаноламина. При активации фосфолипаз из фосфолипидов высвобождаются ПНЖК и легко окисляются.
Окисление ПНЖК с образованием эндоперекисей может происходить в процессе ПОЛ, которое необходимо для синтеза лейкотриенов, регуляции липидного состава мембран, метаболизма катехоламинов и фагоцитоза. Стационарный уровень протекания ПОЛ регулируется антиоксидантной системой, которая ограничивает образование липидных радикалов.
Супероксиддисмутаза, каталаза и глутатионзависимые ферменты сохраняют клетки от окислительного стресса. Активность ферментов антиоксидантной защиты снижалась при воспалении, а активация фосфолипазы увеличивалась. [5] Ингибировать глутатионзависимые ферменты могут продукты фосфолипазного гидролиза – свободные жирные кислоты. Важную роль в антиоксидантной защите организма играют пептиды, в состав которых входят SH-содержащие аминокислоты: цистеин, цистин и метионин. Особое место занимает глутатион, образованный аминокислотами цистеином, глицином и глутаминовой кислотой. SH-содержащие соединения защищают клетки от повреждающего действия свободных радикалов. Дефицит холина и метионина способствует угнетению фермента cтеаторил-коэнзим А-десатураза-1 (SСД-1), которая катализирует десатурацию пальмитиновой и стеариновой кислот, регулирует запасы ТГ в клетке и проявляет защитное действие на клетки печени. Низкая активность SСД-1 усугубляет тяжесть течения стеатогепатита. [19]
В качестве основных механизмов перехода от стеатоза к стеатогепатиту рассматривают ускоренный липолиз, аккумуляцию липидов в гепатоцитах, оксидативный стресс с формированием избытка свободных радикалов, повреждение ДНК и некроз гепатоцитов.
При стеатогепатите морфологические изменения характеризуются формированием гигантских митохондрий, что ведет к апоптозу клеток. Воспалительная реакция представлена внутридольковыми инфильтратами на фоне жировой дистрофии гепатоцитов. Также наблюдаются жировые кисты, «пустые» ядра гепатоцитов, липогранулемы. [2]
Воспалительная реакция начинается с эндотелия. При воспалении, гипоксии, эндотоксиновой агрессии происходит нарушение функции эндотелия. Макрофаги под действием эндотоксина выделяют оксид азота, который легко проникает в клетки и взаимодействует с ферментами и белками. Оксид азота ингибирует калий-натрий-АТФ-азу, тем самым снижается чувствительность к инсулину, ингибируются митохондриальные ферменты, цитохром-Р-450, который метаболизирует жирные кислоты и холестерин, происходит накопление СЖК в клетках печени. В условиях гипергликемии усиливаются процессы ПОЛ, что может индуцировать апоптоз, за счет активации ядерного фактора транскрипции, повышающего экспрессию индуцибельной синтазы оксида азота. [8,20]
Влияние ЛПС и других медиаторов воспаления на функцию печени вызывает экспрессию синтеза фосфолипазы А2 и усиление жировой инфильтрации печени. Усиление гепатоцитами и клетками эндотелия синтеза ФЛА2 формирует воспалительный процесс.
Липопротеин-ассоциированная фосфолипаза А2 (ФЛА2) гидролизует фосфолипиды в ЛПВП и ЛПНП в кровотоке. В результате гидролиза образуется лизо-фосфатидилхолин (лизо-ФХ) – активный провоспа-лительный липид, который стимулирует образование активных форм кислорода нейтрофилами, клетками эндотелия и макрофагами в интиме артерий. Лизо-ФХ также изменяет активность синтазы оксида азота и количество синтезируемого NO.
Лизо-ФХ играет ключевую роль в атерогенезе, являясь цитотоксичным к клеткам сосудов, резко изменяет текучесть мембран, способствует высвобождению медиаторов воспаления, также изменяет активность синтазы оксида азота и количество синтезируемого NO.
Происходит нарушение эндотелий зависимой ва-зодилатации за счет снижения биодоступности оксида азота для гладкомышечных клеток артериол. [14] Липо-литический фермент ФЛА2 проявляет свою активность в клетках печени. Особое значение имеет фосфолипаз-ная активность митохондрий, которая играет ведущую роль в развитии некротических изменений в клетке.
Результаты исследования и их обсуждение
Верхней границей физиологического уровня принято считать 200 нг/мл. У больных НАЖБП в стадии стеатогепатита (НАСГ) содержание ФЛА2 у 33 больных (40%) было повышено в 3,8 раза (медиана 199,7–528,2 нг/мл) и составило 493,6±81,93 нг/мл. У 22 больных из них высокий риск сердечно-сосудистых осложнений (медиана 324,3–764,4), в среднем 488,9±25,86 нг/мл. ФЛА, мг/мл
Рис. 1а. Содержание ФЛА у больных НАЖБП
Рис. 1б. Корреляционное соотношение ФЛА2 с ЛПНП
При попадании в кровоток ФЛА2 связывается и транспортируется с ЛПНП, отмечена тесная корреляционная связь ФЛА2 с ЛПНП (r=0,957). Р2 у 47 больных (60%) в среднем 129,7±6,22 нг/ мл. Активность фермента в плазме и тканях регулируется индукцией цитокинов и бактериальных токсинов и коррелирует со степенью развития патологических процессов при различных заболеваниях.
У 65 больных НАЖБП в стадии НАСГ было определено в сыворотке крови содержание МДА и ФЛА2. Содержание МДА у этих больных было увеличено в 2 раза и составило в среднем 18,81 ±1,24 мкмоль/л, в контроле 9,94±1,62 мкмоль/л. МДА мкмоль/л
Рис. 2а. Перекисное окисление липидов (ПОЛ).
Содержание малонового диальдегида (МДА) у больных НАЖБП
Рис. 2б. Корреляция ФЛА2-МДА
Отмечен высокий уровень ФЛА2 (640 нг/мл) и МДА (15,98 мкмоль/л) у 26 больных НАСГ и низкий уровень ФЛА2 при нормальном содержании МДА у остальных больных НАЖБП. и МДА находятся в отрицательной корреляционной зависимости, коэффициент корреляции –0,578.
Рис. 3а. Содержание ФЛА2 в сыворотке крови у больных НАЖБП
Рис. 3б. Содержание МДА в сыворотке крови у больных НАЖБП
Рис. 3в. Корреляционное соотношение между ФЛА2 и МДА
При чрезмерном накоплении липидов в гепатоцитах усиливаются процессы ПОЛ, что ведет к некрозу гепатоцитов, нарушению функций митохондрий, постепенному развитию фиброза печени и формированию стеатогепатита.
Сравнительный анализ содержания стабильных метаболитов оксида азота в сыворотке крови больных и контрольной группы показал, что воспалительный процесс в группе стеатогепатита достоверно сопровождался повышенной продукцией оксида азота. Уровень метаболитов возрастал параллельно концентрации аминотрансфераз. Отмечена корреляционная зависимость оксида азота и аланиновой трансаминазой (АЛТ) r=0,86 Р=0,001). Уровень ФЛА2 возрастал при воспалении у больных НАСГ и коррелировал с уровнем оксида азота (r=0,62 Р=0,001).
Рис. 4. Морфология. Жировая инфильтрация гепатоцитов при стеатозе печени
Рис. 5. Морфология. Смешанноклеточный внутридольковый инфильтрат при стеатогепатите
Рис. 6. Морфология. Фагоцитарные гранулемы и перигепатоцеллюлярный фиброз при стеатогепатите
У больных с висцеральным ожирением и инсулинорезистентностью усиление оксидативного стресса приводит к инактивации NO за счет накопления реактивных кислородных радикалов. Нарушается равновесие в системе NO в сторону увеличения концентрации сосудосуживающих факторов и снижении биодоступности NO. Повреждение эндотелия сосудов усугубляется воздействием окисленных форм ЛПНП.
Обильный рост патогенной микрофлоры вызывает формирование бактериального воспаления в слизистой оболочке тонкой кишки, что вызывает активацию процессов ПОЛ.
Содержание эндотоксина в сыворотке крови было повышено у больных НАСГ по сравнению с контролем и больными стеатозом печени. При попадании ЛПС в системный кровоток он связывается с белком и запускает каскад иммунных реакций. Эндотоксемия определяется как циркуляция в крови бактериальных эндотоксинов в концентрации выше 2,5 ЕЭ. [10]
Отмечена корреляционная связь между содержанием эндотоксина и оксида азота (r=0,62, Р=0,001). Повышение эндотоксина и оксида азота выявлено при прогрессировании воспалительной инфильтрации в печени, что доказывает участие маркеров воспаления в патогенезе НАЖБП.
При НАЖБП маркеры воспаления были повышены при воспалительной стадии перехода стеатоза к стеатогепатиту параллельно повышению печеночных ферментов и морфологической картине воспалительной инфильтрации в печени.
НАЖБП часто ассоциируется с метаболическими нарушениями: повышенной массой тела, дислипидемией, сердечно-сосудистыми заболеваниями, сахарным диабетом типа 2.
В настоящее время для лечения больных НАЖБП используют препараты, сочетающие в себе антиоксидантную защиту, стабилизацию мембран гепатоцитов, противовоспалительную терапию. Получены убедительные данные о влиянии препарата Дибикор на углеводный и жировой обмен при НАЖБП. Дибикор – лекарственный препарат (ПИК-ФАРМА, Россия), действующим веществом которого является таурин. Дефицит таурина в печени приводит к нарушению желчевыделения и образования камней.
Желчные кислоты препятствуют развитию ожирения и тканевой резистентности к инсулину. Повышение растворимости гидрофильности желчных кислот достигается конъюгированием с аминокислотами глицином и таурином. Соединяясь с холевой кислотой, таурин образует парные желчные кислоты и непосредственно участвует во всасывании жиров и жирорастворимых витаминов, а также способствует выведению холестерина.
Дибикор может быть использован для коррекции и профилактики метаболических нарушений в терапии НАЖБП. Клиническая эффективность препарата Дибикор была оценена у больных с НАЖБП и СД типа 2, нарушением толерантности к глюкозе. Двойное слепое плацебо-контролируемое сравнительное исследование проводилось на базе ЦНИИГ.
Дибикор назначался по 0,5 г 2 раза в день за 20 минут до еды в течение 3 месяцев. Все больные продолжали получать подобранную терапию по поводу сахарного диабета – метформина гидрохлорид 1000мгсут и эналаприла малеат 20 мг сут. Прием Дибикора статистически значимо улучшал показатели билирубина, АСТ, АЛТ, ХС, фибриногена, веса, ИМТ. АЛТ снижалась с 51,48±8,9 Ел до 32,98±5,93 (Р=0,001), АСТ с 39,13±6,53 Ел до 26,81±2,99 (Р=0,01), ГГТП с 68,86±17,56Ел до 63,45±18,4. Снижались также метаболиты оксида азота с 220,7±14,27 до 123,9 ±8,13мкмольл и содержание эндотоксина с 2,2 ЕЭмл до 0,9 ЕЭмл.
Фармакотерапия больных НАЖБП с включением препарата Дибикор, который проявляет свойства антиоксиданта, способствует удалению свободных радикалов за счет повышения доступности глутатиона и гипотаурина, таурин ингибирует генерацию активных молекул перекисей и супероксидных анионов, тем самым снижается уровень малонового диальдегида и активность маркеров воспаления.
Применение Дибикора улучшает самочувствие больных, способствует нормализации АД, приводит к улучшению углеводного и жирового обмена, проявляет гепатопротективный эффект, что может быть использовано в лечении больных и профилактике НАЖБП.
Выводы
Выявлена взаимосвязь между маркерами воспаления (ФЛА2, NO, Эт, МДА), морфологической картиной печени и активностью печеночных ферментов.
Активность липопротеин-ассоциированной фосфо-липазы А2 при НАСГ у 40% больных была увеличена в 3,8 раза по сравнению с контрольной группой и сте-атозом, что сопровождалось повышением активности печеночных ферментов и тяжестью морфологических изменений. При НАЖБП развивается недостаточность антиок-сидантной системы в результате активации процессов ПОЛ. Содержание МДА в сыворотке крови было увеличено в 2 раза у больных НАЖБП при стеатогепатите в 30% случаев. Активность ФЛА2 и уровень МДА находятся в корреляционной зависимости (r=-578).
Повышение эндотоксина, оксида азота и активность ФЛА2 наблюдается при прогрессировании воспалительной инфильтрации в печени. Применение Дибикора в комплексной терапии НАЖБП снижает активность маркеров воспаления, оказывает положительный эффект на антиоксидантную систему клетки и удаление супероксидных радикалов.
Литература
1. Андреева Л. И., Кожемякин Л. А., Кишкун А. А. Модификация метода определения перекисей липидов в тесте с тиобарбитуровой кислотой // Лабор. дело. 1988. № 11. С. 41-43.
2. Буеверов А. О., Богомолов П. О., Маевская М. В. Патогенетическое лечение неалкогольного стеатогепатита: обоснование, эффективность, безопасность // Тер. архив. Т. 2007. № 8. С. 1-4.
3. Горожанская Э. Г. Свободнорадикальное окисление и механизмы антиоксидантной защиты в нормальной клетке и при опухолевых заболеваниях // Клин. лаб. диагн. 2010. № 6. С. 28-44.
4. Драпкина О. М. Атерогенная дислипидемия и печень // Приложение к журналу Consilium medicum. 2013. № 1. С. 52-56.
5. Жаворонок Т. В., Степовая Е. А., Рязанцева Н. В. и др. Нарушение окислительного метаболизма при острых воспалительных заболеваниях // Клин. лаб. диагн. 2006. № 12. С. 10-14.
6. Звенигородская Л. А., Нилова Т. В., Ткаченко Е. В., Варванина Г. Г. Клиническое значение определения содержания липопротеин-ассоциированной фосфолипазы А2 в диагностике НАЖБП // Гастроэнтерология. 2, 2013. Приложение Consilium medicum. C. 42-46.
7. Звенигородская Л. А., ЧеркашоваЕ. А., Нилова Т. В. Гиполипидемическая терапия у больных с НАЖБП // Эффективная фармакотерапия. Гастроэнтерология. № 2. 2012. С. 22-32.
8. Ивашкин В. Т., Драпкина О. М., Корнеева О. Н. Клинические варианты метаболического синдрома. – М.: ООО Издательство «Медицин. информац. агентство. – 2012. – 216 с.
9. Ивашкин В. Т., Маевская М. В. Липотоксичность и метаболические нарушения при ожирении // Рос. журн. гастро-энтер. гепатол. колопроктол. 2010. № 1. С. 4-13.
10. Ивашкин В. Т., Морозова М. А., Маевская М. В. Основные причины лихорадки у пациентов с нарушением функции печени // Рос. журн. гастроэнтерол. гепатол. колопроктол. 2010. № 1. С. 21-29.
11. Метельская В. А., Гуманова Н. Г. Оксид азота в регуляции биологических функций. Методы определения в крови человека // Лаб. медицина. 2005. № 7. С. 17-24.
12. Нозадзе Д. Н., Семенова А. Е., Каминная В. И. и др. Липопротеин ассоциированная фосфолипаза А2 – новая позиция в системе стратификации риска.// Атеросклероз и дислипидемии.2011№1 С.39-46
13. Титов В. Н. Альбумин. Транспорт насыщенных жирных кислот и метаболический стресс синдром // Клин. лаб. диагн. 1999. № 4. С. 3-11.
14. Титов В. Н., Дугин С. Ф. Синдром транслокации, липополисахариды бактерий, нарушения биологических реакций воспаления и артериального давления // Клин. лаб. диагн. 2010. № 4. С. 21-37.
15. Федосьина Е. А., Маевская М. В. Применение урсодезоксихолевой кислоты при неалкогольном и алкогольном стеатогепатите // Рос. журн. гастроэнтерол., гепатол. и колопроктол. 2010. № 3. С. 29-36.
16. Чернов Ю. Н., Васин М. В., Батищева Г. А. Патологические изменения клеточных мембран при ишемической болезни сердца и возможные пути фармакологической коррекции // Эксперим. и клин. фармак. 1992. Т. 57. № 4. С. 67-72.
17. Шульпекова Ю. О. Роль липидов в патогенезе НАЖБП // Рос. журн. гастроэнтерол., гепатол., колопроктол. 2012. № 1. С. 45-56. 18. Gorelick P. B. Lipoprotein-associated phospholipase A2 and risk of stroke. Am. J. Cardiol. 2008, 101 (12A) 34 F. – 40 F.
19. Li Z. Z., Berk M., McIntyre T. M. et al. Hepatic lipid partitioning and liver gamage in Nonalcoholic fatty liver disease role of steatoril-CoA desaturase // J. Biol. Chtm. 2009. 284 (9) 5637-44.
20. Lin K. T., Xue J. Y., Nomen M. et. al. Peroxynitrite-induced apoptosis in cells // J. Biol. Chem. 1995. 270, 16487-90.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
