Расстройство кровообращения при воспалении
Стадии расстройства микроциркуляции:
1. Кратковременный спазм артериол:результат рефлекторного возбуждения
вазоконстрикторов на воздействие
флогогена (несколько сек–мин).
2. Артериальная гиперемия:увеличение
притока артериальной крови и кровенаполнения
ткани. Способствует усилению оксигенации
тканей, снижению степени ацидоза,
активации обмена веществ.
3. Венозная гиперемия:сопровождается
замедлением тока крови, расширением
просвета посткапилляров и венул. В
механизме выделяют 3 группы факторов:
нарушения реологических свойств крови;
изменения сосудистой стенки;
тканевые изменения.
4. Предстаз:периодические
маятникообразные движения крови «вперёд
↔ назад» в результате механического
препятствия оттоку крови по посткапиллярам,
венулам и венам агрегатами форменных
элементов крови в просвете сосуда и
пристеночными микротромбами.
5. Стаз:возникает в результате
закрытия просвета микрососудов агрегатами
клеток изнутри и сдавления экссудатом
снаружи. Является завершающей стадией
сосудистых изменений.
Экссудация
Экссудация (от лат.exsudatio— выпотевание) — компонент воспаления,
включающий в себя триаду: сосудистые
реакции и изменения кровообращения в
очаге воспаления; выход жидкой части
крови из сосуда (собственно экссудацию);
эмиграцию (выход лейкоцитов в очаг
воспаления и развитие фагоцитарной
реакции).
Основная причинаэкссудации —
увеличение проницаемости стенок
микрососудов вследствие множества
процессов, повреждающих их стенку.
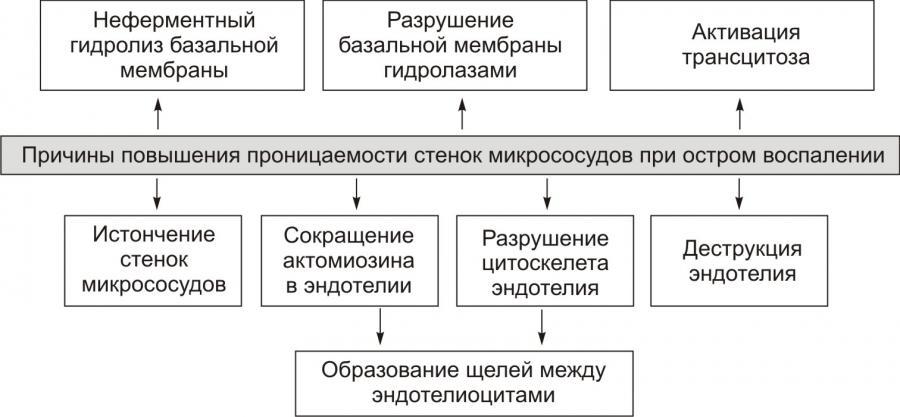
Рис. 9. —
Причины повышения проницаемости стенок
микрососудов
при остром воспалении (по
П.Ф. Литвицкому, 2002)
Основные факторы механизма экссудации:
1) повышение проницаемости сосудов
(венул и капилляров) в результате
воздействия медиаторов воспаления и в
ряде случаев самого воспалительного
агента — ведущий фактор;
2) увеличение кровяного (фильтрационного)
давления в сосудах очага воспаления
вследствие гиперемии;
3) возрастание осмотического и онкотического
давления в воспаленной ткани в результате
альтерации и начавшейся экссудации и,
возможно, снижение онкотического
давления крови из-за потери белков при
обильной экссудации.
Виды экссудата
1. Серозный экссудат: состоит из
полупрозрачной жидкости, богатой белком
(до 2–3%), и немногочисленных клеток, в
том числе форменных элементов крови
(ФЭК).
2. Фибринозный экссудат: содержит
большое количество фибриногена и
фибрина.
3. Гнойный экссудат:мутная густая
жидкость, содержащая до 6–8% белка и
большое количество различных форм
лейкоцитов, микроорганизмов, погибших
клеток повреждённой ткани.
4. Геморрагический экссудат:содержит
большое количество белка и эритроцитов,
а также другие ФЭК.
5. Гнилостный (ихорозный) экссудат:
любой вид экссудата может приобрести
гнилостный (ихорозный) характер при
внедрении в очаг воспаления гнилостной
микрофлоры (анаэробы).
6. Смешанные формыэкссудата могут
быть самыми разнообразными (например,
серозно-фибринозный, гнойно-фибринозный,
гнойно-геморрагический и др.).
Значение процесса экссудации в очаге воспаления
Адаптивное:
транспорт медиаторов воспаления
доставка иммуноглобулинов в очаг
воспаленияудаление из крови метаболитов и токсинов
задержка и/или фиксация в очаге воспаления
флогогена и продуктов его действия на
ткань
Патогенное:
сдавление, смещение органов и тканей
экссудатомвозможность излияния экссудата в
полости тела и сосудыформирование абсцессов, развитие
флегмон
Эмиграция (emigratio, от лат.emigrare
— выселяться, переселяться) — выход
лейкоцитов из сосудов в ткань.Осуществляется путем диапедеза через
стенку венул и является ключевым событием
патогенеза воспаления.
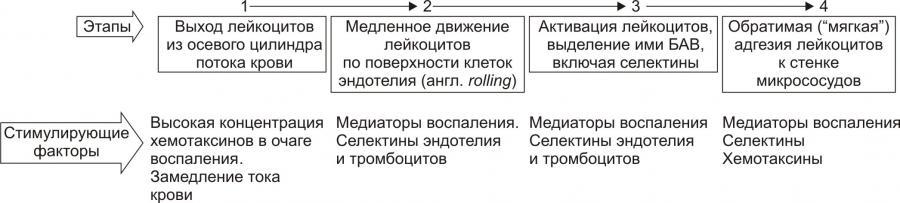
Стадии процесса эмиграции лейкоцитов
в очаге воспаления:
1. краевое стояние лейкоцитов;
2. адгезия к эндотелию и проникновения
через сосудистую стенку;
3. направленное движение лейкоцитов в
очаге воспаления.
На стадии краевого стояния(маргинации)
условно выделено четыре последовательных
этапа.

Рис. 10. —Этапы стадии краевого
стояния лейкоцитов и факторы, стимулирующие
краевое стояние (по П.Ф. Литвицкому,
2002)
В стадии адгезии и выхода лейкоцитов
выделяют 2 этапа: устойчивой («плотной»)
адгезии (1) и прохождения лейкоцитов
через стенку микрососуда (2).

Рис. 11. —Этапы стадии устойчивой
адгезии и прохождения лейкоцитов через
стенку микрососуда; факторы, стимулирующие
адгезию (по П.Ф. Литвицкому, 2002)
Значение эмиграции лейкоцитов
в очаг воспаления:
поглощение и деструкция
флогогенного фактора;поглощение и деструкция
поврежденных клеток и неклеточных
структур;синтез и выделение медиаторов воспаления;
поглощение и «процессинг» антигенов
и презентация последних лимфоцитам;развитие иммунных и/или аллергических
реакций.
Развитие воспаления всегда связано с изменением периферического кровообращения.
Этот процесс можно рассматривать во времени и пространстве. В первом случае речь идет об изменениях периферического кровообращения, происходящих в одном конкретном месте при развитии воспаления, а во втором – об особенностях кровообращения в разных участках воспалительных очагов.
Стадии изменения кровообращения при воспалении
Последовательность (стадии) изменений кровообращения в очаге воспаления следующая:
- артериолярный спазм;
- артериальная гиперемия;
- венозная гиперемия;
- застой.
Артериолярный спазм
Временное сужение сосудов вызвано действием воспалительных этиологических агентов: они вызывают возбуждение гладкой мускулатуры сосудосуживающих нервов и артериол.
Артериолярный спазм
Спазм кратковременен, потому что первичное действие патогенных агентов быстро прекращается. Кроме того, норадреналин, медиатор симпатической иннервации артериол, быстро разрушается из-за повышения уровня моноаминоксидазы в воспаленных тканях.
Биологическая нацеленность на спазм артериол в организме заключается в подавлении дальнейшего распространения патогенного агента.
Артериальная гиперемия
Гиперемия развивается в следствии действия биологически активных веществ: сначала высвобождается гистамин (в течение 5-30 минут), затем хинины (в течение 1-8 часов), а затем – простагландины и другие медиаторы.
Эти медиаторы снижают мышечный тонус прекапиллярного сфинктера и артериол и тем самым способствуют их расширению. Кроме того, в условиях ацидоза и расслоения чувствительность α-адренорецепторов к сосудосуживающему действию адреналина на прекапиллярные сфинктеры снижается. Артериальная гиперемия развивается как в результате прямого сосудистого, так и аксонального рефлекса.
Увеличивается приток артериальной крови к очагу воспаления. По мере повышения артериального давления открываются ранее нефункционирующие капилляры. Вены расширяются, и в результате удаляется вся притекающая кровь.
Повышение артериального давления
При воспалительной артериальной гиперемии диаметр капилляров и вен увеличивается больше, чем когда артериальная гиперемия не связана с воспалением. Часто эти сосуды расширяются неравномерно – местами появляются варикозные выросты, что способствует «краевому положению» и эмиграции лейкоцитов.
По мере увеличения числа функционирующих капилляров линейная скорость кровотока и, в частности, объемная скорость увеличиваются. Увеличение линейной скорости кровотока увеличивает количество кислорода в венозной крови, и, таким образом, артериовенозный кислородный промежуток уменьшается.
Однако из-за увеличенного объема кровотока количество кислорода, получаемого тканями, увеличивается, что аналогично объему кровотока, умноженному на артериовенозную разницу в кислороде.
Сильная артериальная гиперемия наблюдается при остром воспалении кожи. Вызывает характерное для воспаления местное покраснение.
Венозная гиперемия
По мере прогрессирования воспаления артериальная гиперемия переходит в венозную. Биологически активные вещества, ацидоз, лизосомы лейкоцитов и бактериальные ферменты разрушают венозные и мелкие венозные десмосомы – волокна эластичной и коллагеновой соединительной ткани, окружающие капилляры и вены.
Лизосомные ферменты действуют как непосредственно на коллагеназу сосудистой стенки, так и опосредованно – они влияют на участие образующихся веществ (катионных белков, простагландинов). Катионные белки высвобождают гистамин из тучных клеток в периваскулярном пространстве. В результате капилляры и вены теряют тонус и расширяются под действием артериального давления. Уменьшается скорость кровотока, способствует переносу жидкой части крови к месту воспаления (экссудации).
Постепенно меняется расположение элементов формы в кровотоке. При артериальной гиперемии элементы формы располагаются в основном в центре кровеносного сосуда, но на стенках есть плазма и несколько лейкоцитов. Теперь это разделение исчезает. Кроме того, в кислой среде элементы плесени и стенки сосудов набухают, просвет сосудов сужается.
В первые минуты после смены начинают образовываться тромбы. В результате повреждения стенки формоэлементов и сосудов высвобождаются и активируются факторы свертывания (I, II, III, V, VII, X, XII и др.), Ускоряется свертывание крови. Тромбоз дополнительно затрудняет венозный отток и усиливает прохождение жидкой части крови к тканям, поэтому кровь продолжает сгущаться, образуются агрегаты эритроцитов и сгустки. По мере ускорения свертывания крови фибрин и глобулины откладываются в лимфатических сосудах, и образуются конгломераты лимфоцитов, что затрудняет возврат лимфы из места воспаления.
По мере перехода жидкой части крови и элементов формы к месту воспаления (эмиграции) давление жидкости в воспаленных тканях увеличивается. Мелкие вены и лимфатические сосуды еще сильнее сдавливаются, в результате чего прогрессируют нарушения оттока крови и лимфы («магический круг» патогенеза).
Таким образом, переходу артериальной гиперемии в венозную способствуют два фактора:
- внутрисосудистые факторы – набухание и агрегация формоэлементов, положение края лейкоцитов, тромбообразование, загустение крови, набухание эндотелия, нарушения структуры вен и мелких вен;
- внесосудистые факторы (факторы экссудата) – лимфатическое подавление экссудатом.
Описанная венозная гиперемия (застой) была названа Конгеймом истинной воспалительной гиперемией. Выраженно часто встречается у пациентов с хроническим воспалением: оттенок воспаления синеватый.
Стазислокальное прекращение кровотока
Венозная гиперемия, скопление элементов формы, шлак и застой в очаге воспаления возникают в основном в капиллярах, венах и мелких венах, поэтому обычно говорят о застойных явлениях (венозных) и истинном застое капилляров.
Застой капилляров
Перед остановкой кровотока часто возникают колебательные движения крови – во время систолы кровь движется вперед, во время диастолы – назад. Когда пульсовая волна проходит через расширенные артериолы во время систолы, возникает так называемый капиллярный пульс.
Ионы водорода и калия повышают возбудимость нервных рецепторов в месте воспаления. Эти ионы, осмотически активные вещества, полипептиды (брадикинин), гистамин, а также механические факторы (экссудат, расширенные кровеносные сосуды и лимфатические сосуды) раздражают рецепторы чувствительных нервов и вызывают местные клинические признаки воспаления, боли. Капиллярные импульсы также механически раздражают рецепторы и вызывают пульсирующую боль, например, у пациентов с панаридозом, пульпитом и другими острыми воспалениями.
В дополнение к маятниковым движениям, которые происходят в сердечном ритме, на стадии венозной гиперемии происходят другие изменения кровотока – закупорка капилляров агрегатами состава, промывание тромба, сжатие открытия или закрытия просвета капилляров, региональное расширение капилляров и т. д. Эти нарушения не являются синхронными.
Однако наблюдаемые изменения кровообращения при развитии воспаления не всегда постоянны. Спазм артериол часто не обнаруживается. Острое воспаление после легкого ожога в основном характеризуется артериальной гиперемией, тогда как сразу после сильного кислотного ожога наблюдается застой. При хроническом воспалении кожи обычно наблюдаются признаки венозной гиперемии, отека и цианоза.
Если посмотреть на клинически выраженное очаговое воспаление в пространстве, наиболее выраженное повреждение ткани находится в центре очага (зона альтерации) – тромбоз сосудов, некроз тканей, гнойные тела, микрофаги, а также могут быть обнаружены наиболее серьезные отеки.
Зона альтерации окружена тканями с высокой концентрацией биологически активных веществ, в которых возникают тяжелые нарушения кровообращения – венозный застой и венозная гиперемия. Затем, по направлению к периферии, следует самая широкая область – артериальная гиперемия, которая вызывает покраснение от источника воспаления.
В области артериальной гиперемии концентрация биологически активных веществ ниже. Зона микрофага по направлению к периферии окружена зоной макрофагов и фибробластов.
Продолжение статьи
- Часть 1. Этиология и патогенез воспаления. Классификация.
- Часть 2. Особенности обмена веществ при воспалении.
- Часть 3. Физико – химические изменения. Роль нервной и эндокринной систем в развитии воспаления.
- Часть 4. Изменения в периферическом кровообращении при воспалении.
- Часть 5. Экссудация. Экссудат и транссудат.
- Часть 6. Эмиграция лейкоцитов. Хемотаксис.
- Часть 7. Фагоцитоз. Асептическое и острое воспаление.
- Часть 8. Распространение. Последствия. Принципы лечения воспаления.
Поделиться ссылкой:
Нарушение микроциркуляции в очаге воспаления характеризуется изменением тонуса микроциркуляторных сосудов, усиленным током жидкой части крови за пределы сосуда (т.е. экссудацией) и выходом форменных элементов крови (т.е. эмиграцией).
Для сосудистой реакции характерны 4 стадии:
1) кратковременный спазм сосудов,
2) артериальная гиперемия,
3) венозная гиперемия,
4) стаз.
Спазм сосудов возникает при действии повреждающего агента на ткани и связан с тем, что вазоконстрикторы возбуждаются первыми, поскольку они чувствительнее вазодилятаторов. Спазм длится до 40 секунд и быстро сменяется артериальной гиперемией. Артериальная гиперемия формируется следующими тремя путями: а) как результат паралича вазоконстрикторов; б) как результат воздействия медиаторов с сосудорасширяющей активностью; в) как результат реализации аксон-рефлекса.
Расслабляются прекапиллярные сфинктеры, увеличивается число функционирующих капилляров и кровоток через сосуды поврежденного участка может в десятки раз превышать таковой неповрежденной ткани.
Расширение микроциркуляторных сосудов, увеличение количества функционирующих капилляров и повышенное кровенаполнение органа определяет первый макроскопический признак воспаления — покраснение. Если воспаление развивается в коже, температура которой ниже температуры притекающей крови, то температура воспаленного участка повышается — возникает жар. Поскольку в первое время после повреждения линейная и объемная скорость кровотока в участке воспаления достаточно велики, то оттекающая из очага воспаления кровь содержит большее количество кислорода и меньшее количество восстановленного гемоглобина и поэтому имеет яркокрасную окраску. Артериальная гиперемия при воспалении сохраняется недолго (от 15 минут до часа) и всегда переходит в венозную гиперемию, при которой увеличенное кровенаполнение органа сочетается с замедлением и даже полным прекращением капиллярного кровотока.
Венозная гиперемия начинается с максимального расширения прекапиллярных сфинктеров, которые становятся нечувствительными к вазоконстрикторным стимулам и венозный отток затрудняется. После этого замедляется ток крови в капиллярах и приносящих артериолах. Главной причиной развития венозной гиперемии является экссудация — выход жидкой части крови из микроциркуляторного русла в окружающую ткань. Экссудация сопровождается повышением вязкости крови, периферическое сопротивление кровотоку возрастает, скорость тока крови падает. Кроме того, экссудат сдавливает венозные сосуды, что затрудняет венозный отток и также усиливает венозную гиперемию. Развитию венозной гиперемии способствует набухание в кислой среде форменных элементов крови, сгущение крови, нарушение десмосом, краевое стояние лейкоцитов, образование микротромбов. Кровоток постепенно замедляется и приобретает новые качественные особенности из-за повышения гидростатического давления в сосудах: кровь начинает двигаться толчкообразно, когда в момент систолы сердца кровь продвигается вперед, а в момент диастолы кровь останавливается. При дальнейшем повышении гидростатического давления кровь в систолу продвигается вперед, а в момент диастолы возвращается обратно — т.е.возникает маятникообразное движение. Толчкообразное и маятникообразное движение крови определяет возникновение пульсирующей боли. Постепенно экссудация вызывает развитие стаза — обычное явление при воспалении. Как правило, стаз возникает в отдельных сосудах венозной части микроциркуляторного русла из-за резкого повышения ее проницаемости. При этом жидкая часть крови быстро переходит во внесосудистое пространство и сосуд остается заполненным массой плотноприлежащих друг к другу форменных элементов крови. Высокая вязкость такой массы делает невозможным продвижение ее по сосудам и возникает стаз. Эритроциты образуют «монетные столбики», границы между ними постепенно стираются и образуется сплошная масса в просвете сосуда — сладж (от англ. sludge — тина, грязь).
При воспалении реакция сосудов стереотипна и развивается в 4 стадии:
1.Кратковременный преходящий спазм артериол и прекапилляров, сопровождающиеся развитием ишемии.
2.Расширение артериол, сопровождающееся ускорением кровотока и развитием артериальной гиперемии.
3.Дальнейшее расширение сосудов и замедление кровотока с развитием венозной гиперемии.
4.Развитие стаза и остановка кровотока.
Начальный спазм сосудов отчетливо выражен при быстро развивающемся повреждении (ожог, травма) и менее заметен при постепенном развитии повреждения (инфекционный процесс). Причиной вазоконстрикции является выделение под влиянием повреждающего фактора сосудосуживающих БАВ: катехоламинов из симпатических нервных окончаний, тромбоксана А2 из тромбоцитов, эндотелина-1 из поврежденных эндотелиоцитов. Кратковременность ишемии обусловлена быстрой инактивацией этих эффекторов и накоплением вазодилататоров.
Расширение артериол, метартериол и прекапиллярных сфинктеров возникает в результате воздействия вазодилататоров: гистамина, кининов, оксида азота и PgI2 (простациклина). В результате скорость кровотока в микро-циркуляторном русле повышается, возрастает количество функционирующих капилляров, увеличивается кровенаполнение тканей, улучшается их оксиге-нация — развивается артериальная гиперемия (см. главу «Нарушение периферического кровотока»). Артериальная гиперемия сохраняется недолго (обычно 10-30 мин) и сменяется венозной гиперемией.
Развитие венозной гиперемии начинается с максимального расширения артериол и прекапиллярных сфинктеров, которые становятся резистентны к сосудосуживающим стимулам, а также с затруднения венозного оттока. Скорость кровотока в микроциркуляторных сосудах падает. Причинами этого состояния являются сдавление венул накапливающимся экссудатом, повышение тонуса их стенок под влиянием гистамина, действующего на Н1-рецепторы. Немаловажную роль в развитии венозной гиперемии имеет изменение реологических свойств крови — повышение ее вязкости в результате выхода жидкой части крови из сосудистого русла при экссудации и «сладжирования» форменных элементов.
Сладж эритроцитов — это прилипание их друг к другу вследствие адсорбции на их поверхности высокомолекулярных глобулинов (белков острой фазы воспаления), что снижает их поверхностный потенциал. Агрегаты эритроцитов формируют структуры напоминающие монетные столбики, которые значительно затрудняют кровоток. Накопление лейкоцитов у стенок посткапилляров и венул в процессе маргинации также способствует замедлению тока крови.
Закономерное развитие причин венозной гиперемии, приводит к стазу и прекращению кровотока в очаге воспаления.
Экстравазация жидкости ( экссудация )
Отличительной особенностью сосудистых изменений при воспалении является значительное повышение сосудистой проницаемости и выход богатой белками жидкости (экссудата) в ткани. Потеря белков плазмой крови приводит к снижению внутрисосудистого онкотического давления и повышению онкотического давления интерстициальной жидкости. Совместно с повышением гидростатического давления в расширенных сосудах, это приводит к значительному оттоку жидкости в ткани и формированию отека.
Повышение проницаемости сосудистой стенки при остром воспалении развивается в 3 фазы, каждая из которых обусловлена различными механизмами.
1. Ранняя преходящая фаза возникает вскоре после повреждения и продолжается 15-30 минут. Механизм повышения сосудистой проницаемости заключается в сокращении эндотелиоцитов и формировании промежутков между ними. Развивается эта реакция под действием гистамина, лейкотриенов, простагландинов и кининов в венулах и не затрагивает капилляры и артериолы.
2. Поздняя продленная фаза начинается через 2 часа после повреждения и продолжается 24 часа и более. Повышается проницаемость капилляров и венул. Изменения в микрососудах являются следствием активации эндоте-лиоцитов и обеспечивается цитокинами (ИЛ-1, ФНО, ИФН-γ). Происходит перестройка цитоскелета эндотелиоцитов, что приводит к разрушению межклеточных контактов и втягиванию цитоплазматических отростков с образованием щелей между соседними эндотелиоцитами. Важное значение имеет усиление транспорта через эндотелиоциты — трансцитоза за счет увеличения количества специфических транспортных органелл.
3.Раннее стойкое повышение проницаемости возникает вследствие прямого повреждения эндотелия, некроза эндотелиоцитов и их отделения от базальной мембраны. Подобная ситуация часто встречается при значительной альтерации в результате ожогов или инфекции экзотоксинпродуцирующими возбудителями (например, Corynebacterium diphteriae, Str pyogenes). Повышение сосудистой проницаемости развивается сразу после повреждения, продолжается несколько часов и наблюдается в артериолах, капиллярах и венулах.
Жидкость, выходящая из микрососудов при повышении их проницаемости, содержащая большое количество белка и форменные элементы крови формирует экссудат, который накапливается в тканях и/или полостях тела при воспалении. Экссудат следует отличать от транссудата, формирующегося, в основном, в результате повышения гидростатического давления в сосудах без повышения их проницаемости (например, при сердечной недостаточности). Для транссудата характерны удельная плотность < 1.012, отсутствие клеток и содержание белка < 2%; для экссудата — удельная плотность > 1.015, наличие клеток-участников воспаления и содержание белка > 2%.
Клеточный и химический состав экссудата имеет диагностическое значение и зависит от причины воспаления, ткани, в которой развивается воспаление, реактивности организма и ряда других факторов.
Различают следующие типы экссудатов:
Серозный — содержит преимущественно альбумины в умеренной концентрации (3-5%) небольшое количество клеток, образуется на ранних стадиях воспаления.
Катаральный (слизистый) — образуется при воспалении слизистых оболочек воздухоносных путей, ЖКТ. Отличается высоким содержанием муко-полисахаридов и секреторных антител (IgA), содержит лизоцим.
Фибринозный экссудат отличается высоким содержанием фибриногена, что является результатом значительного повышения проницаемости сосудов. При контакте с поврежденными тканями фибриноген превращается в фибрин и выпадает в виде ворсинчатых масс (на серозных оболочках) или пленки (на слизистых), вследствие чего экссудат уплотняется. Если фибринозная пленка расположена рыхло, поверхностно, легко отделяется без нарушения целостности слизистой, такое воспаление называется крупозным. Оно наблюдается в желудке, кишечнике, трахее, бронхах. В том случае, когда пленка плотно спаяна с подлежащей тканью и ее удаление обнажает язвенную поверхность, речь идет о дифтеритическом воспалении. Оно характерно для миндалин, полости рта, пищевода. Такое различие обусловлено характером эпителия слизистой оболочки и глубиной повреждения. Фибринозные пленки могут самопроизвольно отторгаться благодаря аутолизу, развертывающемуся вокруг очага, и демаркационному воспалению и выходить наружу; подвергаться ферментативному расплавлению или организации, т. е. прорастанию соединительной тканью с образованием соединительно-тканных сращений, или спаек. Фибринозный экссудат может наблюдаться при дифтерии, дизентерии, туберкулезе.
Гнойный — содержит большое количество лейкоцитов, фрагменты нек-ротизированных тканей. Образуется чаще всего при инфекциях, вызываемыхпиогенными бактериями (стафилококками, стрептококками, пневмококками
и др.).
Геморрагический — содержит большое количество белка и эритроцитов. Образуется при повреждениях сосудов с разрушением базальной мембраны, характерен для сибирской язвы, гриппозной пневмонии и др.
Смешанные формы экссудата могут быть самыми разнообразными (се-розно-фибринозный, гнойно-фибринозный и др.)
Биологическое значение экссудации состоит в том, что, являясь одним из основных компонентов воспаления как, патологического процесса, она выполняет вместе с тем важную защитную роль, которая заключается прежде всего в локализации воспалительного процесса.
Положительные последствия:
1. Экссудат разбавляет, снижает концентрацию повреждающих агентов и тем самым ослабляет их вредное воздействие.
У новорожденных и эмбрионов, у которых экссудация практически не развивается, воспаление принимает характер альтеративного, проявляется тканевыми дистрофиями и некрозом.
2. С экссудатом в очаг воспаления поступают защитные факторы — иммуноглобулины, факторы свертывания крови и др.
3. Экссудат обладает бактерицидными свойствами.
4. Если в экссудате содержится фибрин, он блокирует лимфатические сосуды и препятствует резорбции и генерализации повреждающих факторов.
Отрицательные последствия:
1. Экссудат может механически смещать органы и ткани, тем самым нарушая их работу (экссудат в плевральной полости, перикарде).
2. Экссудат может сдавливать ткани, обусловливая боль и повреждения (особенно в замкнутых полостях — при артритах, гайморитах, пульпитах и др.).
3. Если происходит потеря экссудата или его удаление при медицинских манипуляциях — это может привести к обезвоживанию и белковому дефициту (при диарее, потере «плазмы» с обожженной кожи, нерациональном пункгировании при плевритах).
4. Резорбция экссудата может сопровождаться интоксикацией.
Скопление в ткани экссудата обусловливает такой внешний местный признак воспаления, как припухлость. Кроме того, наряду с действием брадикинина, гистамина, простагландинов, нейропептидов давление экссудата на окончания чувствительных нервов имеет некоторое значение в возникновении воспалительной боли.
Эмиграция лейкоцитов
Наряду с микроциркуляторными изменениями в очаге воспаления происходят характерные изменения функций ряда клеточных элементов, обусловленные их активацией. Активируются эндотелиоциты, различные популяции лейкоцитов, тромбоциты, клетки соединительной ткани и др. Эти клеточные процессы определяют защитную функцию воспаления.
Для обобщающей характеристики этих процессов приняты термины: эмиграция клеточных элементов, то есть их выход за пределы микрососудов в ткани и пролиферация.
В ходе воспалительной реакции в результате внедрения патогенных возбудителей или повреждения какой-либо другой природы имеет место активация макрофагов.
Это проявляется фагоцитозом и выделением большого количества регуляторных молекул главным образом пептидной природы — цитокинов. Цитокины в свою очередь активируют множество других клеток-мишеней. Цитокины — интерлейкины (ИЛ-1, ИЛ-3, ИЛ-8) и фактор некроза опухолей (ФНО) и др. в очаге воспаления активируют эндотелиоциты и нейтрофилы.
Активация эндотелиоцитов и нейтрофилов под влиянием ИЛ-1 и ФНО проявляется во-первых в появлении на их мембранах особых адгезивных молекул (адгезинов), относящихся к классам селектинов и интегринов. В результате нейтрофилы выходят из кровотока к сосудистой стенке и «прокатывается» по эндотелию, а затем «прилипают» — фиксируются к эндотелиоцитам в местах межэндотелиальных контактов. Потом нейтрофилы формируют псевдоподии, проникающие между эндотелиальными клетками и как бы «переливаясь» в псевдоподии в конце концов выходят за пределы сосудов. «Прокатывание» осуществляется с помощью адгезинов типа селектинов, «прилипание» и прохождение в межэндотелиальные пространства с помощью интегринов.
Неактивированные нейтрофилы и эндотелиоциты взаимодействовать не могут и эмиграция нейтрофилов не происходит.
Наследственный дефект по одному из адгезинов эндотелиоцитов (болезнь неадгезивных лейкоцитов) снижает сопротивляемость организма к инфекционным заболеваниям.
Активация эндотелиоцитов проявляется выделением в кровь нескольких прокоагулянтных факторов и их пролиферацией и при формировании грануляционной ткани.
Состояние активации эндотелиоцитов достигает пика за 4-6 часов после воздействия ИЛ-1 и других активаторов. Исходный уровень активности, в том числе освобождение мембраны от адгезинов, восстанавливается за 24-36 часов, если нет повторных активирующих воздействий.
Мембрана нейтрофила быстро теряет адгезивные молекулы после прохождения нейтрофила через стенку капилляра.
Наряду с адгезивностью, активация нейтрофилов в очаге воспаления проявляется хемотаксисом, фагоцитозом, бактерицидностью и апоптозом — запрограмированной гибелью нейтрофила после его выхода в ткани.
Хемотаксис обусловлен рядом факторов. Это моноцитарный цитокин йнтерлейкин-8 (ИЛ-8), метаболиты арахидоновой кислоты — лейкотриены, активированные компоненты системы комплемента, факторы, продуцируемые базофилами, нейтрофилами, Т-лимфоцитами-эффекторами ГЗТ и мн. др.
Фагоцитоз — важнейший механизм защитного действия воспалительной реакции впервые описанный И.И. Мечниковым.
Бактерицидные механизмы нейтрофила разнообразны. Одним из важнейших является так называемый «респираторный взрыв» — резкое увеличение потребления О2 (в 10-15 раз) и внемитохондриального окисления. Образующиеся при этом свободные радикалы перекиси водорода, супероксидного аниона, гидроксильного радикала, синглетного кислорода повреждают микробы. Особо мощным повреждающим действием обладает система: миелопероксидаза + перекись водорода + галогены.
По современным представлениям, возможно, наиболее важным бактерицидным фактором является радикал NO -.
Хорошо известно бактерицидное действие таких факторов, как лизоцим, катионные белки, лактоферрин. Недавно были изучены пептиды с «антибиотическим» действием, так называемые дефензины.
Экзоцитоз нейтрофилов способствует проявлению их внеклеточной бактерицидности. В результате экзоцитоза, апоптоза выходят также гидролитические лизосомальные ферменты. Это приводит к активации систем ограниченного протеслиза, а также простагландин-тромбоксановой системы и накоплению БАВ . Если ферментов очень много, может происходить расплавление тканевых структур и формирование таких форм гнойного воспаления, как абсцессы и флегмоны.
Преимущественная эмиграция нейтрофилов характерна для начального периода воспаления, они выполняют исключительно важную работу по очистке тканей от патогенных возбудителей и необратимо поврежденных фрагментов самих тканевых структур.
Постепенно начинает преобладать эмиграция моноцитов.Моноцит, покидая сосуд, превращается в экссудативный моноцит-макрофаг, затем в незрелый и зрелый макрофаг. Зрелые макрофаги по структурно-функциональным характеристикам разделяются на фагоцитарные и секреторные макрофаги.
В отличие от нейтрофилов, которые располагаются преимущественно в центре очага воспаления, макрофаги размещаются по периферии, образуя своеобразный вал (предшественник грануляционного вала), отграничивающий очаг воспаления от неповрежденной ткани. Сначала формируется нейтрофильно-макрофагальный вал, затем макрофагальный и наконец, макрофагально-фибробластный вал, который непосредственно трансформируется в грануляционную ткань.
Фагоцитарная активность макрофагов значительно ниже активности нейтрофилов, хотя они, так же как нейтрофилы, осуществляют «респираторный взрыв» и неокислительную бактерицидную активность.
Главной их функцией является отграничение очага воспаления, предотвращение дальнейшей агрессии и создание условий для антигенной стимуляции для Т- иВ-лимфоцитов, тем самым макрофаги участвуют в формировании специфического иммунного ответа на системном уровне.
Выделяя цитокины (ИЛ-1, ФНО, ИЛ-6, ИЛ-8), колониестимулирующие факторы — КСФ и многие другие, макрофаги осуществляют аутокринную (в отношении других макрофагов), паракринную (в отношении других клеток, находящихся в непосредственной близости: эндотелиоцитов, нейтрофилов, лимфоцитов, тромбоцитов и др.) и эндокринную (системную на уровне всего организма) регуляторные функции. Например, ИЛ-1 и ФНО (в несколько меньшей степени) стимулируют тепловой центр — вызывая лихорадку, ИЛ-1 — костный мозг, мобилизуя из костного мозга уже созревшие нейтрофилы в периферическую кровь — эффект в течение 24 часов, ИЛ-1, ИЛ-3, колониестимулирущие факторы усиливают миелопоэз и появление незрелых форм нейтрофилов в крови, ИЛ-1 стимулируют поступление в кровь стрессовых гормонов: кортикотропина и глюкокортикоидов
ПРОЛИФЕРАЦИЯ
Пролиферация — завершающая стадия воспаления — характеризуется увеличением числа стромальных и, как правило, паренхиматозных клеток ,
также образованием межклеточного вещества в очаге воспаления. Эти процессы направлены на регенерацию альтерированных и замещение разрушенных тканевых элементов. Существенное значение на этом этапе воспаления имеют различные БАВ, стимулирующие пролиферацию клеток (митогены).
Пролиферативные процессы при остром воспалении начинаются вскоре после воздействия флогогенного агента на ткань и более выражены по периферии ?
