Роль циклических нуклеотидов в воспалении

Циклические нуклеотиды, нуклеотиды, в молекулах которых остаток фосфорной кислоты, связываясь с углеродными атомами рибозы в 5′ и 3′ положениях, образует кольцо; универсальные регуляторы биохимических процессов в живых клетках.
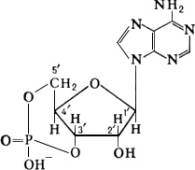
Циклический 3′,5′-аденозинмонофосфат (цАМФ)
Наиболее изучен циклический 3′, 5′-аденозинмонофосфат (цАМФ) — белый порошок, хорошо растворимый в воде. цАМФ открыт в 1957 американским биохимиком Э. Сазерлендом с сотрудниками при исследовании механизма активации фермента фосфорилазы печени гормонами глюкагоном и адреналином. В тканях животных и человека цАМФ служит посредником в осуществлении многообразных функций различных гормонов и др. биологически активных соединений (некоторых медиаторов, токсинов, лактинов). У бактерий при недостатке в среде легкоусвояемых соединений, например глюкозы, увеличивается содержание цАМФ в клетке, что приводит к биосинтезу адаптивных (индуцируемых) ферментов, необходимых для усвоения др. источников питания. Уровень цАМФ в клетках сальмонеллы Salmonella thyphimurium определяет будущее попавшего в неё фага (при высокой концентрации цАМФ происходит лизогенизация культуры бактерий, при низкой — фаг вызывает её лизис). У миксоамёбы Dictyostelium discoideum цАМФ играет роль аттрактанта, привлекающего клетки друг к другу. У высших растений цАМФ опосредует влияние фитохрома на синтез пигментов бетационинов (у Amaranthus paniculatus).
Концентрация цАМФ в тканях млекопитающих очень мала и составляет десятые доли микромоля на 1 кг сырой ткани (10-7—10-6моль). При активации аденилатциклазы, катализирующей биосинтез цАМФ, или блокировании фосфодиэстеразы, осуществляющей гидролиз этого нуклеотида, концентрация цАМФ в клетке быстро увеличивается. Т. о., содержание цАМФ в клетке определяется соотношением активностей этих двух ферментов. Связь между гормоном или др. химическим сигналом (первый «посредник») и цАМФ (второй «посредник») осуществляет т. н. аденилатциклазный комплекс, включающий рецептор, настроенный на определённый гормон (или др. биологически активное вещество) и расположенный на внешней стороне клеточной мембраны, и аденилатциклазу, расположенную на внутренней стороне мембраны. Гормон, взаимодействуя с рецептором, во многих случаях активизирует аденилатциклазу, которая катализирует биосинтез цАМФ. Концентрация цАМФ, образующегося т. о. в клетке, превышает концентрацию действующего на клетку гормона в 100 раз. В основе механизма действия цАМФ в тканях животных и человека лежит его взаимодействие с протеинкиназами — ферментами, активность которых проявляется в присутствии этого нуклеотида (см. схему). Связывание цАМФ с регуляторной субъединицей протеинкиназы приводит к диссоциации фермента и активации его каталитической субъединицы, которая, освободившись от регуляторной субъединицы, способна фосфорилировать определённые белки (в т. ч. ферменты). Изменение свойств этих макромолекул путём фосфорилирования меняет и соответствующие функции клеток. Например, при действии адреналина на клетки печени происходит фосфорилирование двух ферментов — фосфорилазы и гликогенсинтетазы. Фосфорилаза при этом активируется, что приводит к быстрому гидролизу гликогена — запасного вещества печени. Одновременно с началом гидролиза гликогена прекращается его новый синтез, т.к. фермент, участвующий в его образовании, — гликогенсинтетаза при фосфорилировании его протеинкиназами теряет свою активность. Один и тот же гормон, действуя через посредство цАМФ, в разных тканях вызывает различные функциональные ответы, зависящие от особенностей данной ткани. При стрессе, когда потребность в энергии очень велика, мозговой слой надпочечников в повышенном количестве образует гормон адреналин. В печени адреналин обусловливает активное расщепление (фосфоролиз) гликогена, образование фосфорных эфиров глюкозы и выброс в кровь большого количества глюкозы, в жировой ткани — приводит к гидролизу липидов, достигнув сердца, — увеличивает силу сокращения сердечной мышцы, усиливает кровообращение и улучшает питание тканей, осуществляя мобилизацию всех сил организма. цАМФ играет определённую роль в морфологии, подвижности, пигментации клеток, в кроветворении, клеточном иммунитете, вирусной инфекции и др. Некоторые медиаторы, например ацетилхолин, могут ускорять образование др. Ц. н. — 3′,5′-гуанозинмонофосфата (цГМФ), который синтезируется в клетке из гуанозинтрифосфата при активации фермента гуанилатциклазы, входящей в гуанилатциклазный комплекс, расположенный в клеточной мембране. Характерно, что многие эффекты цГМФ прямо противоположны эффектам цАМФ. Антагонистические отношения Ц. н. проявляются чаще всего в сложных системах, когда для регуляции клеточной функции требуется разновременная модификация многих белков, осуществляемая согласованным действием попеременно активируемых цАМФ- и цГМФ-зависимых протеинкиназ. У бактерий цАМФ, соединившись с неферментным рецепторным белком, присоединяется к ДНК и позволяет ферменту РНК-полимеразе начать транскрипцию гена, ответственного за синтез индуцируемого фермента (см. Оперон). Т. о., механизм действия цАМФ у бактерий и в тканях животных и человека принципиально различен. Исследования роли Ц. н. в живых клетках — одно из наиболее быстро развивающихся направлений в биохимии, уже внёсшее существенный вклад в понимание механизмов биологической регуляции на молекулярном уровне.
Лит.: Боннер Дж., Гормоны миксомицетов и млекопитающих, в кн.: Молекулы и клетки, пер. с англ., в. 5, М., 1970; Васильев В. Ю., Гуляев Н. Н., Северин Е. С., Циклический аденозинмонофосфат — биологическая роль и механизм действия, «Журнал Всесоюзного химического общества им. Д. И. Менделеева», 1975, т. 20, № 3; Доман Н. Г., Феденко Е. П., Биологическая роль циклического АМФ, «Успехи биологической химии», 1976, т. 17; Федоров Н. А., Циклический гуанозинмонофосфат (цГМФ): метаболизм и его биологическая роль, «Успехи современной биологии», 1976, т. 82, в. 1 (4); Sutherland Е. W., Roil Т. W., The properties of an adenine ribonucleotide produced with cellular particles, ATP, Mg++ and epinephrine or glucagon, «Journal of the American Chemical Society», 1957, v. 79, № 13; Advances in cyclic nucleotide research, v 1—6 N. Y. Amst., 1972—75.
Е. П. Феденко.

Схема механизма действия цАМФ в клетках животных и растений. АТФ — аденозинтрифосфат; АДФ — аденозиндифосфат; фн — фосфат; фф — пирофосфат.
Оглавление
Получить выполненную работу или консультацию специалиста по вашему
учебному проекту
Узнать стоимость
Циклические нуклеотиды – это нуклеотиды, в молекулах которых остаток фосфорной кислоты, связываясь с углеродными атомами рибозы в 5″ и 3″ положениях, образует кольцо. Одним из представителей циклических неклеотидов является цАМФ(3’,5’-аденозинмонофосфат).
 Циклический 3″,5″-аденозинмонофосфат (цАМФ)
Циклический 3″,5″-аденозинмонофосфат (цАМФ)
6.1. Циклический AMФ синтезируется аденилатциклазой и расщепляется фосфодиэстеразой
цАМФ образуется из АТФ под действием мембранного фермента аденилатциклазы:
Эта реакция в небольшой степени эндергонична. Источником энергии для синтеза цАМФ служит последующий гидролиз пирофосфата. Специфическая фосфодиэстераза разрушает цАМФ путем гидролиза до AMФ:
6.2. АМФ служит вторым посредником при действии многих гормонов
Работа Эрла Сазерленда , по выяснению механизма действия адреналина и глюкагона га распад гликогена и образование глюкозы, привела к созданию концепции о роли цАМФ как второго посредника в механизме действия некоторых гормонов. Первым посредником является сам гормон. Сущность этой концепции заключается в следующем.
1.Плазматические мембраны клеток содержат рецепторы гормонов.
2. Взаимодействие гормона с его специфическим рецептором на плазматической мембране ведет к стимуляции аденилатциклазы, также связанной с плазматической мембраной.
3.В результате активации аденилатци клазы в клетке увеличивается содержание цАМФ.
4. Действие цАМФ проявляется внутри клетки и состоит в изменении скорости одного или более процессов.
Важная особенность этой гипотезы второго посредника состоит в том, что она не предполагает проникновения гормона в клетку.
Действие самого гормона ограничивается клеточной мембраной. Биологический эффект гормона опосредован действием цАМФ внутри клетки; непосредственного действия сам гормон не оказывает. Обоснованность этой концепции была проверена с использованием целого ряда экспериментальных критериев, а именно:
1. Аденилатциклазу клетки должны стимулировать те гормоны, которые дествуют на эту клетку как на мишень. Гормоны, не вызывающие специфического биологического ответа данной клетки, не должны повышать в ней активности этого фермента.
2. Концентрация цАМФ в клетках-мишенях должна изменяться пропорционально биологическому ответу этих клеток на гормональную стимуляцию, т.е. она должна проявлять временную и количественную зависимость от концентрации гормона.
Ингибиторы фосфодиэстеразы, например теофиллин или кофеин, должны действовать синергично с теми гормонами, эффект которых опосредован вторым посредником.
4. Добавление цАМФ или родственного ему соединения к клеткам-мишеням должно имитировать биологическое действие гормона. (На практике цАМФ в таких опытах не используется, так как он плохо проникает в клетки; однако менее полярные производные цАМФ, в частности дибутирил- цАМФ, проникают в клетки и оказывают свое действие.)
Проведенные опыты показали, что циклический AMP является вторым посредником при действии не только адреналина и глюкагона, но и многих других гормонов. цАМФ оказывает влияние на исключительно большое число клеточных процессов. Так, под действием этого соединения увеличивается распад накопленных запасов топливных веществ, повышается выделение соляной кислоты слизистой желудка, происходит дисперсия пигментных гранул меланина, уменьшается агрегация тромбоцитов.
Внимание!
Если вам нужна помощь в написании работы, то рекомендуем обратиться к
профессионалам. Более 70 000 авторов готовы помочь вам прямо сейчас. Бесплатные
корректировки и доработки. Узнайте стоимость своей работы.
05.08.2011г.
Циклические нуклеотиды занимают центральное положение в регуляции процессов метаболизма мышечного волокна.
Являясь производными адениловой и гуаниловой кислот, эти соединения имеют рациональные химические названия — циклический 3,5-аденозинмонофосфат (цАМФ) и циклический 3,5-гуанозинмонофосфат (цГМФ); в медицинской литературе их часто обозначают, исходя из их физиологической роли, клеточными медиаторами.
Строение циклических нуклеотидоа

Строение циклических нуклеотидоа: а — цАМФ; б — цГМФ.
Наиболее изучен обмен цАМФ. Содержание этого соединения в клетке зависит от активности двух ферментов — аденилатциклазы (АЦ) и фосфодиэстеразы (ФДЭ). Встроенная в мембрану АЦ катализирует синтез цАМФ из АТФ; ФДЭ осуществляет гидролиз соединения до неактивной формы [Sutherland W. et al., 1968]. В свою очередь влияние нуклеотида на обменные процессы опосредовано через систему протеинкиназ (ПК) и изменения уровня кальция [Cheung W., 1972].
ПК имеет сложное строение и состоит из 2 субъединиц — регуляторной и каталитической. Присоединение цАМФ к регуляторной субъединице приводит к освобождению каталитической, которая путем фосфорилирования ряда ферментов и структурных белков контролирует течение различных физиологических процессов; метаболизм гликогена, жирных кислот, мембранные процессы, связанные с обменом электролитов и прежде всего кальция, работу генетического аппарата клетки и др. [Буларгина Т. В. и др., 1980; Северин Е. С. и др., 1980].
Увеличение концентрации цАМФ при стимуляции симпатической нервной системы ведет к возрастанию активности ПК и запуску каскада биохимических реакций. Соматический отдел нервной системы, по-видимому, оказывает противоположное воздействие на циклазную систему, изменяя сродство ПК и цАМФ.
Согласно данным V. Novak и соавт. (1972), чувствительность ПК к цАМФ из эмбриональных мышц (лишенных соматической иннервации) в 4 — 6 раз выше, чем в зрелых. Одновременно система цАМФ путем фосфорилирования специфических белков сарколеммы обеспечивает активное состояние пассивных ионных каналов [Spereakis N., Sheider К., 1976] и подавляет работу натриевого и кальциевого насосов, т. е. участвует в формировании потенциала действия.
Участие цАМФ в регуляции уровня кальция имеет важное биологическое значение. Кальций служит связывающим звеном между нервным сигналом, инициацией мышечного сокращения и усилением реакций, поставляющих энергию для этого процесса [Fisher Е., 1977]. Регуляцию процессов метаболизма кальций осуществляет изменением активности отдельных ферментов, но главным образом системы цАМФ. Таким образом, эффекты кальция и цАМФ взаимосвязаны.
Система цАМФ ткани мышц

Деполяризация плазмолеммы сопутствует увеличению тока кальция через систему медленных ионных каналов и освобождению иона из участков мышечных мембран. Процесс находится под контролем цАМФ-зависимой ПК. Увеличение количества ионов (в 1,5 — 2 раза) стимулирует активность АЦ, соответственно увеличивает скорость тока и ингибирует работу кальциевого насоса.
Увеличение содержания кальция служит одним из факторов инициации массированного перехода иона в саркоплазму из цистерн саркоплазматического ретикулума, что, однако, ограничивает дальнейшее возрастание уровня цАМФ из-за активации ФД и торможения активности АЦ. Ионы кальция после достижения определенной концентрации устремляются в миофиламенты, где захватываются тропонином [Mayer F. et al., 1970].
Удаление иона кальция из саркоплазмы в цистерны саркоплазматического ретикулума после акта сокращения также зависит от состояния циклазной системы [Fisher Е. et al., 1976]. Выяснено, что саркоплазматический ретикулум обладает АЦ- и ПК-ной активностью и максимум интенсивности фосфорилирования специфических его белков совпадает с пиком поглощения иона кальция.
«Нервно-мышечные болезни»,
Б.М.Гехт, Н.А.Ильина
Читайте далее:
- Роль трофического влияния нервной системы в патогенезе ПМД
- Система кальций — циклические нуклеотиды
Автор: А. Н. Дрыгин, В. Л. Пастушенков, С. Б. Шустов, А. Р. Григорян
Циклический 3΄, 5΄-аденозинмонофосфат (цАМФ) и циклический
3΄, 5΄-гуанозинмонофосфат (цГМФ) относятся к универсальным
регуляторам метаболических процессов в живых
клетках. Концентрация циклические нуклеотиды (ЦН) в клетке
поддерживается путем регуляции соотношения активностей ферментов —
циклаз (аденилатциклазы и гуанилатциклазы) и гидролизующих ЦН
фосфодиэстераз. Концентрация цАМФ и цГМФ в клетках очень мала
и измеряется пикомолями. Характерно, что многие биохимические
эффекты цАМФ прямо противоположны эффектам цГМФ. Антагонистические
отношения ЦН появляются чаще всего в сложных системах, когда для
регуляции внутриклеточных процессов требуется разновременная
модификация многих белков, осуществляемая согласованным действием
попеременно активируемых цАМФ- и цГМФ-зависимых протеинкиназ
[3, 6].
Повышенное содержание цАМФ в клетках приводит к фосфорилированию
клеточных мембран и увеличению в цитоплазме концентрации
Са2+, активизирующего фосфодиэтеразу. В
результате этого ускоряется гидролиз цАМФ и синтез цГМФ.
Образование цАМФ ускоряется адреналином, а цГМФ — ацетилхолином,
поэтому принято считать, что цАМФ стимулирует в основном процессы
распада (катаболизма), а цГМФ — процессы синтеза (анаболизма).
Следует отметить, что сродство ЦН к цАМФ- и цГМФ-зависимых
протеинкиназ в 100-1000 раз больше, чем у фосфодиэстераз. Этим
объясняется метаболический механизм контроля
за максимальной степенью повышения концентрации ЦН в клетках
[3, 6-8].
В этой связи представляется перспективным проведение
исследования по изучению биохимических механизмов, выявление общих
процессов при сравнении показателей внутриклеточного метаболизма и
гормональной регуляции у больных сахарным диабетом (СД).
Цель исследования:
Изучить диагностическую значимость содержания цАМФ, цГМФ и
соотношения цАМФ/цГМФ в лейкоцитах больных СД в ходе проведения
инсулинотолерантного теста (ИТТ) и оценить роль ЦН в развитии
тканевой инсулинорезистентности.
Материалы и методы:
Обследовано 52 пациента с СД. Тип СД определялся на
основанииклинических критериев, предложенных комитетом
экспертов ВОЗ [1, 2]. Больных с СД1 было 29 (19 мужчин
и 10 женщин), их средний возраст составил 30,6 лет (17-46
лет), они имели нормальную массу тела,
длительность заболевания варьировала от 10 до 24 лет.
Больных с СД2было 23 (20 мужчин и 3 женщин), их средний возраст
составил 54,7 лет (20-67 лет), 9 из них имели
алиментарно-конституциональное ожирение I-II степени,
длительность заболевания варьировала от 10 до 18 лет. Группу
контроля составили 19 здоровых мужчин, находящихся в
клинике на диспансерном обследовании, средний возраст которых
составил 48,8 лет (31-59 лет). Обследование проводилось через 1
неделю пребывания больных и лиц контрольной группы в условиях
стационара. За 2 суток до обследования все препараты,
за исключением инсулина, нитратов и гипотензивных
средств, отменялись.
Обследуемым больным утром натощак до введения лечебной дозы
инсулина и получения таблетированных препаратов проводилось
внутривенное капельное введение простого монопикового инсулина в
200 мл физиологического раствора в дозе: больным СД 0,2 ед/кг,
а лицам контрольной группы — 0,1 ед/кг в течение 90 мин.
Взятие крови для исследования производилось
до и сразу после ИТТ. После взятия последнего образца
крови с целью профилактики гипогликемии больным внутривенно
вводилось 20 мл 40% раствора глюкозы,
после чего больные завтракали. Перед завтраком
больным с СД1 вводилась обычная утренняя доза инсулина за
вычетом количества инсулина, введенного при ИТТ. В ходе пробы
через каждые30 мин определялась концентрация глюкозы в крови,
производился контроль артериальногодавления,
электрокардиографическое исследование. При достижении
уровня глюкозы в крови 3,5 ммоль/л или появлении
субъективных клинических признаков
легкой гипогликемии, проба прекращалась. Переносимость
ИТТ больными была хорошая.
Концентрация глюкозы и количества инсулинсодержащих
эритроцитов (ИСЭ) в крови
определялась общепринятым методом. Взятие крови для
определения содержания лейкоцитарных ЦН, концентрации
иммунореактивного инсулина (ИРИ) и С-пептида в плазме
производилось с помощью вакуумных
систем Vacuette «Greiner» с ЭДТА. Концентрацию цАМФ, цГМФ
и гормонов определяли радиоиммунологическим методом на приборе
«Clinic Gamma 1272 LKB». После выделения
лейкоцитарной взвеси производился подсчет лейкоцитов на
гематологическом анализаторе «Coulter LH500» фирмы
«Beckman Coulter» (США), после чего клетки разрушались, а
взвесь замораживалась при температуре 20ОС для
последующего определения концентрации нуклеотидов
радиоиммунологическим методом. Расчет содержания нуклеотидов
производился на 109 клеток. Для определения
концентрации ИРИ, С-пептида, цАМФ и цГМФ использовались
коммерческие наборы реактивов фирм «Amersham», «Biodata»,
«Internationale-CIS», «BehrindwerkeAG» (Австрия).
Статистическую обработку результатов проводили с применением
пакета прикладных программ ЕХCЕL-95 и Statistica 7.1,
достоверность между полученными показателями в сравниваемых
подгруппах оценивали с помощью t-критерия Стьюдента и
непараметрического U-критерия Вилкоксона — Манна — Уитни.
Результаты и их обсуждение:
Результаты клинико-лабораторных исследований больных СД при
проведении ИТТ приведены в таблице.
Динамика лабораторных
показателей у больных СД при проведении инсулинотолерантного
теста
Показатель | Группы обследуемых | |||||
Здоровые, n=19 | СД1, n=29 | СД2, n=23 | ||||
I | II | I | II | I | II | |
Глюкоза, ммоль/л | 4,9±0,1 | 3,3±0,2* | 10,9±0,6** | 7,6±0,6* | 8,6±0,5** | 6,7±0,6* |
ИСЭ, ед. | 628±37 | 610±20 | 602±24 | 629±32 | 557±29** | 562±24 |
ИРИ, мкЕд/мл | 12,1±1,5 | 19,0±1,6* | 15,5±1,8 | 29,3±4,5* | 19,8±2,2** | 175,9±14,7* |
С-пептид, нг/мл | 1,9±0,2 | 1,3±0,2 | 0,7±0,1 | 0,6±0,1 | 1,3±0,2 | 0,9±0,1* |
цАМФ, | 0,7±0,1 | 1,6±0,2* | 0,8±0,1 | 1,2±0,2* | 1,4±0,2** | 0,7±0,1* |
цГМФ, пмоль/109лейк. | 0,4±0,1 | 0,3±0,1 | 0,3±0,1 | 0,3±0,1 | 0,3±0,1 | 0,5±0,1 |
цАМФ/цГМФ, ед. | 1,57 | 6,12 | 2,43 | 4,45 | 4,89 | 1,40 |
Примечание: I — исходные показатели; II —
после ИТТ; * — при сравнении с исходными показателями после
ИТТ в группе, р<0,05; ** — при сравнении с исходными
показателями здоровых людей, р<0,05.
Степени снижения концентрации глюкозы в обеих
группах больных СД
существенно неотличались. Концентрация С-пептида
закономерно снижалась у всех обследуемых под
влияниеминфузии инсулина, что,
возможно, свидетельствует о снижении инкреторной функции b-клеток.
Лишь у больных СД1 с исходно низкой остаточной
функцией b-клеток концентрация С-пептидапрактически не
менялась. Исходный уровень ИРИ в группе больных
СД1 является интегральнымпоказателем, зависящим как
от секреции эндогенного инсулина, так
и от концентрацииэкзогенного инсулина, поступающего
в кровь в процессе лечения.
Принято считать, что как уровень ИРИ, так и
содержание в крови С-пептида отражают функциональную
активность b-клеточного аппарата поджелудочной железы
[4, 9, 10]. Между тем у больных СД2 концентрация
ИРИ в крови была достоверно выше, а С-пептида — ниже
на 32% контрольных значений. Выявленное
противоречие может быть объяснено известным фактом
снижения активности печеночной инсулиназы у больных
СД2 [7, 9]. Нельзя исключить также возможность
повышения концентрации циркулирующего инсулина вследствие
снижения егоутилизации тканями в результате
характерной для этой категории больных тканевой
инсулинорезистентности [1, 5, 8]. Увеличение концентрации ИРИ
после ИТТ происходило, по-видимому, за счет внутривенного
введения простого инсулина. Если у здоровых людей
и больных СД1 концентрация ИРИ увеличивалась в 1,5-2
раза, то у больных СД2 — в 8-10 раз, что является
свидетельством тканевой инсулинорезистентности, которая
считается основным патобиохимическим фактором в нарушениях
углеводного обмена у данной категории больных [1, 5, 8].
Исходное содержание цАМФ в лейкоцитах больных СД1 имело
лишь тенденцию кповышению, а у больных СД2 уровень цАМФ
был выше нормы в 2 раза при сравнении с контролем.
ИТТ вызывал достоверное повышение цАМФ
в лейкоцитах здоровых, больных СД1, а у пациентов,
страдающих СД2, направленность реакции была противоположной —
уровень цАМФ снизился по сравнению с базальным, достигая значений
нормы. Содержание лейкоцитарного цГМФу больных,
страдающих СД 1 и 2 типов, было несколько ниже нормы.
Под влиянием ИТТ уровень цГМФ у здоровых, больных
СД1 имел тенденцию к снижению, а у больных СД2 он повышался по
сравнению с исходными значениями. Метаболистическая ситуация в
клетке в значительной степени определяется
соотношением содержащихся в ней цАМФ и цГМФ. Коэффициент
цАМФ/цГМФ у больных СД2 до ИТТ был значительно выше, чем в
других группах обследуемых. ИТТобуславливал неодинаковую
направленность изменения этого коэффициента: у здоровых,больных
СД1 он повышался, а у больных СД2 — снижался по сравнению с
исходными значениями. Количество ИСЭ в ходе инсулиновой
нагрузки достоверно не изменялось ни в одной группе обследуемых,
однако необходимо отметить достоверно низкий исходный уровень ИСЭ у
больных СД2 по отношению к исходному уровню здоровых.
Новизна проведенного исследования определялась использованием
нового методического приема, заключающегося в динамической оценке
показателей внутриклеточного метаболизма, состоянии клеточных
мембран и нейрогормональной регуляции под влиянием одного из
основных физиологических регуляторов метаболизма — инсулина.
Использование этого приема позволило выявить различия в обмене ЦН у
больных СД 1 и 2 типов, предложить новый диагностический маркер для
оценки степени тканевой инсулинорезистентности. Кроме того, на
основании фактов, полученных в ходе исследования, удалось
предложить дифференциально-диагностический тест, позволяющий в
сложных случаях определить тип СД по динамике содержания
лейкоцитарных ЦН в ходе ИТТ.
Выводы:
1. У больных СД1 и здоровых
лиц соотношение содержания цАМФ и цГМФ лейкоцитов
периферической крови под влиянием ИТТ повышается,
а у больных СД2 исходно повышенный по сравнению с нормой
коэффициент цАМФ/цГМФ, напротив, снижается в основном за
счет разнонаправленных изменений содержания цАМФ.
2. Более высокая степень
нарастания концентрации ИРИ в ходе ИТТ у
больных СД2 по сравнению с больными СД1 и здоровыми
лицами, сочетающаяся с извращенной реакцией лейкоцитарных ЦН в
основном за счет содержания цАМФ, свидетельствует о ведущей
ролиособенностей внутриклеточного обмена
в формировании тканевой инсулинорезистентности у
этой категории больных.
3. Степень нарастания инсулинемии и выраженное уменьшение
коэффициента цАМФ/цГМФ в ходе ИТТ могут служить
признаками тканевой инсулинорезистентности.
Литература:
1. Алишева, Е.К. Методы диагностики инсулинорезистентности /
Е.К. Алишева, Е.И. Красильникова, Е.В. Шляхто // Артериальная
гипертензия. — 2002. — № 1. — С. 29-34.
2. Балаболкин, М.И. Новая классификация, критерии диагностики и
компенсации сахарного диабета / М.И. Балаболкин, Е.М. Клебанова,
В.М. Креминская // Эндокринология. — 2000. — Т. 2, № 5. — С.
33-36.
3. Васильев, В.Ю. Циклический аденозинмонофосфат — биологическая
роль и механизм действия / В.Ю. Васильев, Н.Н. Гуляев, Е.С. Северин
// Журн. Всесоюзн. хим. общ-ва им. Д.И. Менделеева. — 1995. — № 3
(20). — С. 41-45.
4. Выдрыч, А.Н. Состояние некоторых звеньев эндокринной
системы у мужчин с диабетической нефропатией / А.Н. Выдрыч, С.Б.
Шустов // Вестн. Рос. Воен.-мед. акад. — 2008. — № 1 (21). — С.
12-15.
5. Пастушенков, В.Л. Влияние инициации процессов
перекисного окисления липидов на клинико-лабораторные показатели
внутриклеточного метаболизма глюкозы у больных сахарным диабетом /
В.Л. Пастушенков, А.Н. Дрыгин, С.Б. Шустов // Мед.-биол. и
соц.-психол. пробл. безопасности в чрезв. ситуациях. — 2010. — № 1.
— С. 67-71.
6. Федоров, Н.А. Циклический гуанозинмонофосфат: метаболизм и
его биологическая роль / Н.А. Федоров // Успехи современной
биологии. — 1996. — № 4 (82). — С. 96-98.
7. Филимонова, Т.Н. Циклические нуклеотиды полиморфноядерных
лейкоцитов периферической крови при хронических заболеваниях печени
: автореф. дис. … канд-та мед. наук / Т.Н. Филимонова. —
Ставрополь. : СГМедА, 1998. — 20 с.
8. Шустов, С.Б. Клинико-лабораторные подходы к
дифференциальной диагностике сахарного диабета 1 и 2 типов / С.Б.
Шустов, А.Н. Дрыгин, В.Л. Пастушенков // Вестн. Рос. Воен.-мед.
акад. — 2010. — № 1(29). — С. 86-89.
9. Evans, J.L. Oxidative stress-activated are signaling
pathways mediators of insulin resistance and b-cell
dysfunction / J.L. Evans [et al.] // Diabetes. —
2003. — Vol. 52. — P. 1-8.
10. Kaneto, H. Role of reactive oxygen species in the
progression of type 2 diabetes and atherosclerosis / H. Kaneto, Y.
Nakatani, T. Miyatsuka // Endocrine
Journal. — 2008. — Vol. 55, № 4. — Р.
235-252.
