Роль хемокинов в воспалении
Хемокины — семейство мелких (от 8 до 10 кДа) белков, которые действуют в основном как хемоаттрактанты для определенных типов лейкоцитов. Идентифицировано около 40 разных хемокинов и 20 разных рецепторов к ним. Хемокины распределены в группы в соответствии с расположением остатков цистеина в матричных белках:
— CXC-хемокины (а-хемокины). Имеют один аминокислотный остаток, разделяющий два первых цистеиновых остатка. СХС-хемокины первично действуют на нейтрофилы. IL-8 — типичный представитель этой группы. Он секретируется активированными макрофагами, эндотелиальными клетками и вызывает активацию и хемотаксис нейтрофилов при лимитированной активности моноцитов и эозинофилов. Самые важные индукторы IL-8 — микробные продукты и другие цитокины, в основном IL-1 и TNF;
— СС-хемокины (b-хемокины). Имеют два первых смежных цистеиновых остатка. К этой группе относятся моноцитарный хемоаттрактантный белок 1 (МСР-1), эотаксин, воспалительный белок макрофагов 1а (М1Р-1а) и хемокин RANTES, экспрессируемый и секретируемый Т-клетками при активации.
СС-хемокины обычно привлекают моноциты, эозинофилы, базофилы и лимфоциты, но не нейтрофилы. Большинство хемокинов этого класса имеют перекрывающиеся эффекты, кроме эотаксина, который селективно мобилизует эозинофилы;
— С-хемокины (у-хемокины). В их структуре отсутствуют два (первый и третий) из четырех ци-стеинов. С-хемокины относительно специфичны для лимфоцитов (например, лимфотактин);
— CX3C-хемокины. Содержат три аминокислоты между двумя цистеинами. Единственным известным членом этого класса является фрактал-кин, существующий в двух формах. Клеточная белковая мембраносвязанная форма может появиться на эндотелиальных клетках под действием воспалительных цитокинов и обеспечивает сильную адгезию моноцитов и Т-клеток.
Вторая форма, растворимая, образуется при протеолизе мембраносвязанного белка и имеет потенциальную хемоаттрактантную активность в отношении тех же клеток.
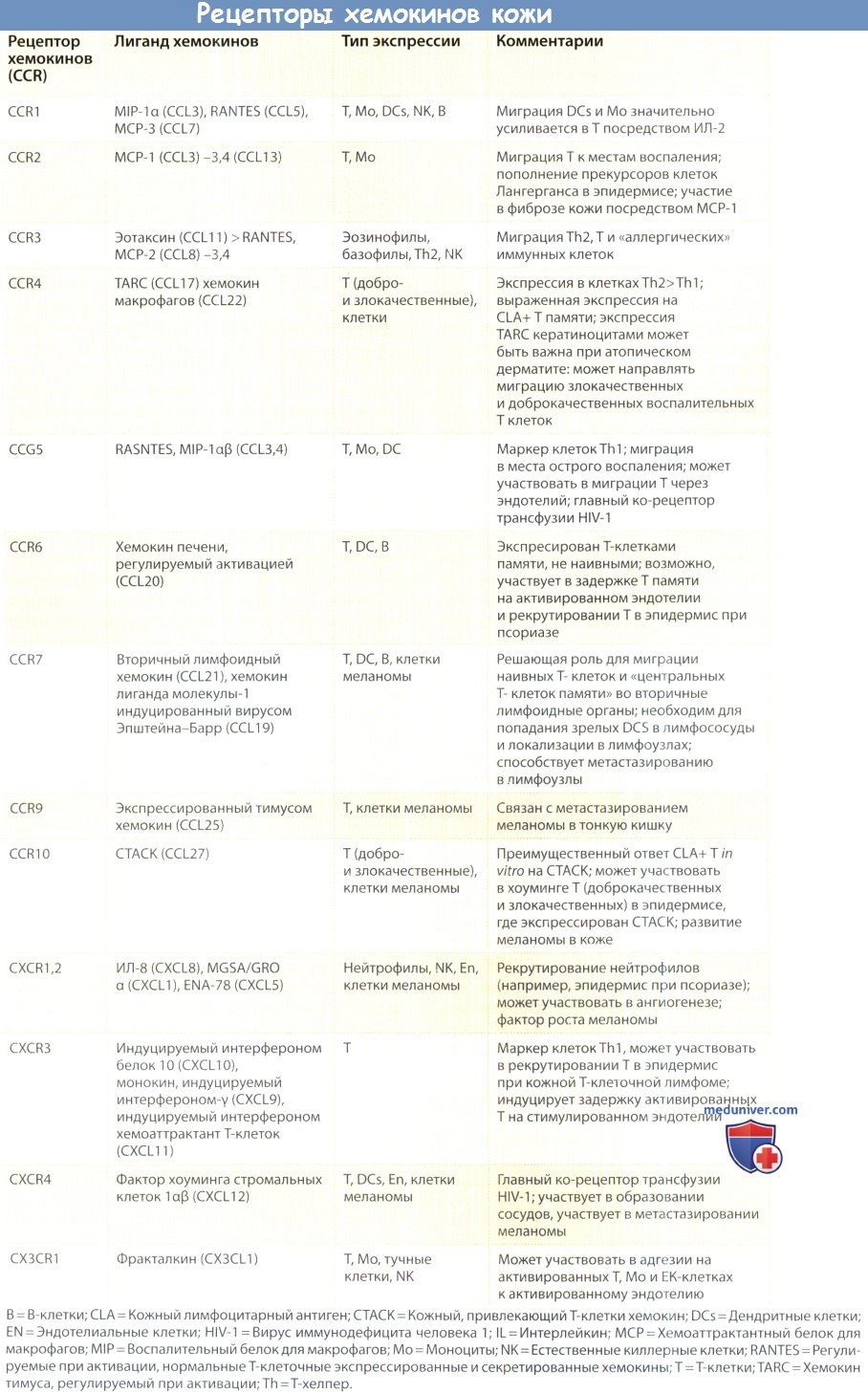
Хемокины опосредуют свои эффекты через взаимодействие с 7-трансмембранными G-белок-связанными рецепторами. Эти рецепторы (CXCR и CCR для СХС-и СС-хемокинов соответственно) высокоспецифичны, и лейкоцит обычно экспрессирует несколько типов таких рецепторов.
Определенные хемокиновые рецепторы (CXCR4, CCR5) работают как корецепторы для вирусного гликопротеина оболочки вируса иммунодефицита человека типа I и вовлечены в процессы связывания и проникновения вируса в клетку.
Хемокины выполняют две основные функции: стимулируют мобилизацию лейкоцитов в очаг воспаления и контролируют нормальную миграцию клеток в различные ткани. Некоторые хемокины образуются быстро в ответ на стимул воспаления и запускают мобилизацию лейкоцитов в очаг воспаления.
Другие хемокины образуются в тканях постоянно и ответственны за анатомическую сегрегацию различных популяций клеток в тканях. В обоих случаях хемокины могут образовываться в высоких концентрациях, прикрепляясь к протеогликанам на поверхности эндотелиальных клеток и в ВКМ.

— Рекомендуем ознакомиться со следующей статьей «Типы ферментов лизосом лейкоцитов и их функции»
Оглавление темы «Патогенез воспаления»:
- Цитокины участвующие в воспалении
- Хемокины участвующие в воспалении
- Типы ферментов лизосом лейкоцитов и их функции
- Образование нейропептидов и их функции при воспалении
- Система комплемента как плазменно-белковый медиатор воспаления
- Участие системы коагуляции и кининов как медиаторов воспаления
- Исходы острого воспаления
- Фазы острого воспаления и их морфология
- Причины хронического воспаления и его определение
- Морфология (гистология) хронического воспаления
Провоспалительные хемокины продуцируются миелоидными (моноциты, макрофаги) и эндотелиальными клетками после их активации. В очагах
воспаления в синтезе хемокинов участвуют и активированные эпителиальные клетки. Стимул к выработке хемокинов — прямое действие патогенов, распознаваемых в основном TLR, а также действие провоспалительных цитокинов (IL-1, TNFa, IL-6, IL-17 и т.д.). В этом отношении провоспалительные хемокины ничем не отличаются от других провоспалительных цитокинов. Хотя эти хемокины преимущественно индуцибельные, они могут нарабатываться заранее, связываться с глюкозаминогликанами, храниться в гранулах (в нейтрофилах, эозинофилах, цитотоксических Т-клет- ках) и выбрасываться при дегрануляции клетки. При активации лимфоциты (особенно Т-клетки) тоже секретируют хемокины. Уже упоминалось, что иммобилизация хемокинов глюкозаминогликанами межклеточного матрикса и на поверхности клеток необходима для формирования их градиента, обеспечивающего направленность миграции.
К провоспалительным хемокинам относят лиганды рецепторов CXCR1, CXCR2, CXCR3, CCR1, CCR2, CCR3 и CCR5. Хемокиновые рецепторы обычно экспрессируются конститутивно, т.е. перемещение клеток при воспалении ограничено не рецепторным аппаратом клеток, а секретируемы- ми хемокинами. Спектры реактивности рецепторов провоспалительных хемокинов обычно широки и сильно перекрываются, однако они все-таки обладают некоторым своеобразием. Это определяет разнообразие клеток, привлекаемых в очаг при различных типах воспаления (острое, хроническое, классическое макрофагальное или аллергическое эозинофильное и т.д.). При воспалении хемокины играют роль не только хемотаксических факторов. Очень важно их участие в активации лейкоцитов, особенно на этапе вовлечения их в процесс миграции.
Решающую роль в привлечении нейтрофилов в начальном периоде острого воспаления играют СХС-хемокины. Среди них к группе провоспалительных факторов относят СХС-хемокины с порядковыми номерами 1—8 (только включение в эту группу CXCL4 вызывает сомнения), взаимодействующие с CXCR1 и CXCR2. Особую подгруппу образуют 3 лиганда CXCR3, секреция которых индуцируется IFNy — MIG, IP-10 и ITAC. По ряду свойств они занимают промежуточное положение между СХС- и СС-хемокинами: их мишени не только нейтрофилы, но и моноциты, а также активированные Т-клетки и Т-клетки памяти, преимущественно ориентированные на клеточный иммунный ответ (Thl-клетки).
Самый изученный и, вероятно, самый важный среди провоспалительных хемокинов — IL-8. Он относится к СХС-хемокинам и имеет характерную третичную структуру (2 a-спирали и p-слой). Существуют варианты молекулы, различающиеся по длине (от 69 до 77 остатков; основной вариант — 72 остатка). Такие различия определяются природой протеаз, осуществляющих процессинг молекулы. Молекула IL-8 содержит 2 дисульфидные связи. В жидкой фазе она существует преимущественно в виде димера. Как и другие хемокины, IL-8 обладает сродством к глюкозаминогликанам, в том числе к гепарансульфату, присутствующему в тканях. Благодаря этому значительная часть IL-8 иммобилизируется, что очень важно для формирования градиента его концентрации в тканях.
Многие клетки способны вырабатывать IL-8, однако основные его продуценты — моноциты, макрофаги и эндотелиальные клетки. Описана секреция
IL-8 тучными и эпителиальными клетками, лимфоцитами, фибробластами и некоторыми другими клетками. Условия выработки IL-8 — активация клеток микроорганизмами и вирусами и их продуктами, провоспалительными цитокинами (IL-1p, TNFa и др.), некоторыми другими медиаторами воспаления (компоненты комплемента, кинины и т.д.) и факторами тромбообразования. Ген IL-8 входит в группу генов, активируемых при участии NF-kB и других активационных транскрипционных факторов. Хемокин выявляют в секрете клеток через 2—3 ч после активации. Эндотелиальные клетки, а также нейтрофилы могут накапливать пресинтезированный IL-8 и быстро (через 10—15 мин) выделять его при активации.
IL-8 распознают 2 рецептора — CXCR1 (связывает только IL-8) и CXCR2 (связывает также некоторые другие a-хемокины). Основные клетки, экспрессирующие эти рецепторы, и главная мишень IL-8 — нейтрофилы. Показана способность IL-8 привлекать также эозинофилы, базофилы и Т-лимфоциты. Тем не менее главная функция IL-8 состоит в обеспечении экстравазации нейтрофилов и их направленной миграции в очаг воспаления. При этом в качестве источников IL-8 выступают как макрофаги воспалительного очага, так и эндотелиальные клетки сосудов в зоне воспаления. IL-8, вырабатываемый эндотелиальными клетками, обеспечивает привлечение нейтрофилов к сосудистой стенке и активацию их интегринов, а также инициируют эмиграцию клеток из сосуда. При этом IL-8 связан с поверхностью эндотелиальной клетки через глюкозаминогликаны. С эндотелием может связываться также IL-8, диффундирующий к сосудам из очага воспаления. Прикрепившись к базальной поверхности эндотелиоцита, IL-8 подвергается трансцитозу и перемещается на апикальную поверхность клетки, обращенную в просвет сосуда. Градиент IL-8, формирующийся при его фиксации на межклеточном матриксе, обеспечивает выход нейтрофилов из сосудистого русла и миграцию этих клеток в очаг воспаления.
В очаге воспаления IL-8 продолжает проявлять свою активность. Он активирует находящиеся там нейтрофилы, способствует дегрануляции клеток, стимулирует выработку мононуклеарами цитокинов. Действие IL-8 на кислородный метаболизм выражено слабее, чем у провоспалительных цитокинов. Важный эффект IL-8 — его ангиогенное действие, особенно важное не только при развитии воспаления, но и при заживлении ран.
Аналогичную роль в привлечении и активации нейтрофилов играют другие a-хемокины. Однако детальные проявления их функциональной активности, а также «разделение труда» между ними изучены недостаточно. Уже упоминалось, что некоторые СХС-хемокины, содержащие в своем составе последовательность ELR (Glu—Leu—Arg) обладают ангиогенными свойствами, т.е. способствуют размножению эндотелиальных клеток и образованию новых сосудов в очаге воспаления. Остальные СХС-хемокины не просто лишены ангиогенной активности — они проявляют антиангиогенное действие, с чем связано их противоопухолевое действие.
Среди СС-хемокинов выделяют несколько подгрупп. К провоспалительным цитокинам относят CCL с номерами 3—6, 14—16, 18 и 23. Основная мишень для большинства этих хемокинов — моноциты; для CCL5 (RANTES, от Regulated upon activation normal T-cell expressed and secreted) — активированные Т-клетки и Т-клетки памяти. Этим факторам принадлежит ключевая роль на поздних этапах любой воспалительной реакции, а также при развитии хронического воспаления. Подгруппу аллергических хемокинов образуют CCL c номерами 1, 2, 7, 8, 11—13, 24 и 26. Большинство из них обладает способностью привлекать эозинофилы или базофилы и вызывать выброс гистамина. Аллергическим хемокинам также присуща провоспалительная активность, реализуемая через их способность привлекать и активировать моноциты. Другие подгруппы СС-хемокинов непосредственно не участвуют в развитии воспаления. Это хемокины, связанные с развитием клеток (представленные в тимусе CCL17, CCL22, CCL25), и гомеостатические хемокины (CCL19, CCL20, CCL21), ответственные за упорядоченное распределение лимфоидных и дендритных клеток во вторичных лимфоидных органах (см. раздел 3.4.2.5). Единственный представитель семейства СХ3С-хемокинов — фракталкин (синтезируется эндотелиальными клетками и связан с их мембраной) — сходен по составу клеток-мишеней и функциям с СС-хемокинами.
Спектр клеток-мишеней СС-хемокинов шире, чем у СХС-хемокинов. Способность СС-хемокинов привлекать моноциты находит отражение в названии пяти из них — хемотаксические белки моноцитов (МСР — от Monocyte chemotactic protein). Однако большинство из провоспалительных СС-хемокинов служит хемотаксическими факторами и для дендритных клеток, В-лимфоци- тов, NK-клеток, Т-клеток памяти и активированных Т-лимфоцитов (в ряде случаев СС-хемокины избирательно действуют на субклассы Т-клеток — Th1 и Th2). Наряду с хемотаксическим действием эти хемокины стимулируют провоспалительную активность моноцитов и марофагов. Этому соответствует обозначение шести СС-хемокинов как воспалительных белков макрофагов (MIP — от Macrophage inflammation protein). Способность привлекать в очаг воспаления эозинофилы дала название трем эотаксинам (CCL11, CCL24, CCL26).
Среди 20 провоспалительных хемокинов группы СС ключевая роль в инициации и развитии воспалительных процессов, обусловленных преимущественной активностью моноцитов, принадлежит двум факторам: CCL2 (MCP-1) и CCL5 (RANTES). Удаление этих факторов с помощью моноклональных антител или «выключения» соответствующих генов приводит к ослаблению воспалительного процесса и рассматривается как потенциальный терапевтический подход при некоторых воспалительных заболеваниях. Показана роль CCL2 и CCL5 в патогенезе атеросклероза и противоопухолевой защите. При аллергии защитного эффекта достигают при воздействии на хемокины CCL11 (эотаксин) и CCL5.
Из данных о спектре клеток-мишеней провоспалительных СС-хемокинов следует, что функциональная роль хемокинов проявляется не на начальных фазах острого воспаления, а в более поздние его сроки, а также при хроническом воспалении и реализации иммунологической или аллергологической составляющих воспалительной реакции. Иными словами, если роль СХС-хемокинов проявляется практически исключительно в рамках врожденного иммунитета, то СС-хемокины во многом служат факторами, интегрирующими врожденный и адаптивный иммунитет.
Интерлейкин 6, интерлейкин 8 и хемокины. Роли интерлейкина 6, интерлейкина 8 и хемокинов при воспалении.Интерлейкин 6 (IL-6) является мультифункциональным цитокином, который продуцируют как лимфоидные, так и нелимфоидные клетки и который регулирует иммунный ответ, острофазный воспалительный ответ и гемопоэз. Рецепторы для 1L-6 обнаруживаются и на лимфоидных, и на нелимфоидных клетках. Одной из основных функций IL-6 является регуляция процессов созревания антителопродуцирующих клеток из В-лимфоцитов и самой продукции иммуноглобулинов. IL-6 участвует также в активации Т-лимфоцитов. Не менее существенный вклад вносит IL-6 в регуляцию синтеза острофазных белков, сопутствующего воспалению. Биосинтез острофазных белков геиатоцитами регулируется всей группой провоспалительных цитокинов, но IL-6 отводится особая роль «гепатоцит-активирующего фактора». IL-6 может индуцировать синтез многих острофазных белков: фибриногена, al-антихимотрипсина, al-кислого гликопротеина, гаптоглобина, сывороточного амилоида A, CRP, a1-антитрипсина и а2-макроглобулина. Продукция альбумина при этом снижается. При развитии острой фазы воспаления уровень IL-6 в сыворотке крови коррелирует с уровнем CRP и с уровнем лихорадки у больного. Повышение уровня IL-6 в сыворотке крови может предшествовать подъему уровня CRP. Между провоспалительными цитокинами, для которых характерны синергидные эффекты, существуют достаточно сложные взаимнорегули-рующие отношения. В частности, IL-6 ингибирует продукцию IL-1 и TNFa, которые являются оба активными индукторами синтеза IL-6. Кроме того, IL-6 через гипоталамус-гипофизарное регуляторное звено усиливает продукцию кортизола, который, в свою очередь, действует на клетки печени, усиливая индукцию 1L-6 острофазных белков, но ингибирует экспрессию гена IL-6, как и генов других провоспалительных цитокинов.
Интерлейкин 8 и хемокиныВсе современные цитокины, основной биологической функцией которых является хемоаттрактантная активность, объединены под названием хемокины, а по структуре разделены на два семейства. Первое, с последовательностью С-Х-С, представлено прежде всего IL-8 и PF4, а также другими, менее изученными: GROa, GROp, GROy, NAP-2, ENA-78, IP-10 и GCP-2. Основными представителями второго семейства с последовательностью С-С являются МСР-1, MIP-1 и RANTES. Источниками хемокинов являются большинство клеток периферической крови и тканей. Основные биологические эффекты хемокинов связаны с их хемоаттрактантной активностью. Однако некоторые цитокины в отношении различных клеток-мишеней обладают и другими эффектами, связанными с активацией этих клеток. Еще задолго до открытия IL-8 у альвеолярных макрофагов была обнаружена способность продуцировать хемоаттрактант для нейтрофилов. В последние годы установлено, что эти наблюдения связаны преимущественно с IL-8. Так, у больных идиопатическим фиброзом легких была обнаружена повышенная экспрессия mRNA для IL-8, что коррелировало с содержанием IL-8, числом нейтрофилов в БАЖ и с тяжестью заболевания. Аналогичные наблюдения имеются в отношении МСР-1, который экспрессируется макрофагами, эпителиальными, эндотелиальными и гладкомышечными клетками легких. Высокий уровень IL-8 в легких обнаружен при остром воспалении. У больных респираторным дистресс-синдромом содержание IL-8, количество нейтрофилов коррелировало со смертностью. При муковисцидозе нейтрофильная эластаза, присутствующая в БАЖ, индуцирует продукцию IL-8 эпителиальными клетками бронхов. Хемокины также являются медиаторами аллергического воспаления. У больных БА наблюдается повышенная экспрессия IL-8 эпителиальными клетками бронхов, а повышенное наличие GM-CSF, IL-3 и IL-5 повышает чувствительность базофилов и эозинофилов больных БА к С-Х-С и С-С хемокинам. — Также рекомендуем «Интерлейкин 10, 4. Роли интерлейкина 10 и 4 при воспалении.» Оглавление темы «Воспаление легких.»: |
Understanding the Role of Chemokines and Cytokines in Experimental Models of Herpes Simplex Keratitis
Источник: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5401741/
Академический редактор: Чэнь Чжао
Герпетический кератит — заболевание роговицы, вызванное ВПГ-1. Это ведущая причина слепоты роговицы в мире. Основной молекулярный механизм до сих пор неизвестен, но экспериментальные модели помогли лучше понять лежащую в основе молекулярную патологию. Цитокины и хемокины представляют собой небольшие белки, высвобождаемые клетками, которые играют важную провоспалительную или противовоспалительную роль в модуляции процесса болезни. Цитокины, такие как IL-17, IL-6, IL-1α и IFN-γ и хемокины, такие как MIP-2, MCP-1, MIP-1α и MIP-1β, обладают провоспалительной ролью в разрушении, вызванном ВПГ, включая нейтрофил инфильтрация и воспаление роговицы, а также другие хемокины и цитокины, такие как IL-10 и CCL3, могут иметь защитную роль. Большая часть ущерба связана с инфильтрацией нейтрофилов и неоваскуляризацией. Несмотря на то, что для лучшего понимания роли этих молекул как в экспериментальных моделях, так и в роговицах человека необходимо провести еще много исследований, текущие исследования показывают, что эти молекулы обладают потенциалом для целей будущей терапии.
Герпетический кератит (HSK) является основной причиной слепоты роговицы в мире [1]. Первичная инфекция возникает после непосредственного контакта слизистой оболочки с вирусом простого герпеса-1 (HSV-1) и включает репликацию вируса в роговице [2, 3]. Затем вирус устанавливает латентность в тройничных ганглиях, что приводит к рецидивирующим инфекциям [1, 4]. Предыдущие исследования на мышиных моделях показали иммунный ответ хозяина, который включает как врожденный, так и адаптивный иммунитет, включая естественные киллерные (NK) клетки, дендритные клетки, макрофаги, нейтрофилы и Т-клетки [5, 6]. Эти клетки завербовываются на сайт и активируются высвобождением хемокинов и цитокинов [6, 7].
Цитокины представляют собой небольшие белки, высвобождаемые клетками, которые играют важную провоспалительную или противовоспалительную роль в модулировании процесса болезни. Категории цитокинов включают интерфероны, TGF-β, интерлейкины и хемокины [8]. Хемокины имеют роль хемоаттрактанта и делятся на четыре семейства, основанные на расположении цистеиновых остатков в лигандах: CXC, CC, C и CX3C [9]. Хемокины CXC обычно привлекают нейтрофилы, но не моноциты. У мышей хемокины CXC включают в себя макрофагальный воспалительный белок (MIP-2), индуцированный интерфероном белок 10 кДа (IP-10) и KC. С другой стороны, CC-хемокины привлекают моноциты, лимфоциты, NK-клетки, базофилы и эозинофилы. Примеры CC-хемокинов включают макрофагальный воспалительный белок-1α (MIP-1α) и белок хемоаттрактанта моноцитов MIP-1β (MCP-1) и регулируют при активации нормального Т-экспрессированного и предположительно секретируемого белка (RANTES) [10].
Герпетический кератит может быть разделен на доклинические (недельная постинфекция) и клинические фазы (постинфекция 10-20 дней). Инфильтрация роговицы начинается в доклинический период, но максимальная облачность не происходит до клинической фазы [11]. Иммунологическое повреждение в основном происходит из лимфоцитов CD4 + T и миграции нейтрофилов в роговицу [3]. Инфильтрация лейкоцитов в HSK является двухфазной. Среди хемокинов IP-10, MIP-2 и MCP-1 наблюдаются в течение начального периода postinfection и, скорее всего, будут способствовать первичной миграции лейкоцитов [10]. Концентрации MIP-1α и MIP-1β увеличиваются вскоре после первоначальной инфильтрации лейкоцитов. Хотя считается, что MIP-2, MCP-1, MIP-1α и MIP-1β играют важную роль в развитии клинического заболевания, KC, IP-10 и RANTES не могут быть непосредственно вовлечены в разработку HSK [10, 12]. Хотя многочисленные патологические процессы происходят одновременно после ВПГ-инфекции и влияют друг на друга, чтобы вызвать необратимое повреждение тканей и рубцевание, мы разделили этот обзор между цитокинами и хемокинами, которые вызывают инфильтрацию нейтрофилов и цитокины и хемокины, которые приводят к ангиогенезу.
В то время как многие клетки проникают в роговицу, фактический урон является результатом инвазии нейтрофилов и CD4 + Т-клеток [5, 13]. У людей ИЛ-8 действует как хемоаттрактант для нейтрофилов; однако мышам не хватает IL-8 [14]. Среди других участников, которые способствуют инфильтрации нейтрофилов, IL-17. IL-17 также действует как хемоаттрактант для нейтрофилов, играет роль в выживании нейтрофилов и заставляет клетки продуцировать молекулы, такие как оксирадикалы и металлопротеиназы, вызывающие повреждение тканей [13, 15]. В одном исследовании у мышей, у которых отсутствовал рецептор IL-17 (IL-17R), была снижена тяжесть поражения на ранних стадиях инфекции из-за отсутствия ответа на IL-17 [16]. Мыши, у которых отсутствовал IL-17R, показали незначительное повреждение эпителиального слоя, небольшой фиброз и снижение инфильтрации CD4 + Т-клеток по сравнению с мышами дикого типа, которые имели обширный фиброз стромы и потерю эпителиального слоя роговицы при инфицировании HSV-1 [13] , Suryawanshi et al. продемонстрировали в своем исследовании двухфазную регуляцию IL-17 в HSK. Первоначальная upregulation IL-17 начиналась на 2-й день после инфицирования, но до 5-го дня возвращалась к уровням преинфекции около 5-го дня; было отмечено еще одно повышение уровня IL-17 начиная с постинфекции 7-го дня. На ранней стадии γδ Т-клетки были первичными продуцентами IL-17, тогда как клетки Th17 были первичными продуцентами IL-17 во время более поздней фазы, наиболее вероятно, в ответ на повышение активности IL-6 и TGF-β (IL-6 и TGF-β заставляют CD4 + Т-клетки дифференцироваться в клетки Th17) [13]. CCL20, хемокин, также играет роль в рисовании клеток Th17 в направлении поражений, которые могут дополнительно способствовать увеличению IL-17 [13]. Инфильтрация нейтрофилов в роговице снижалась у мышей, лишенных IL-17R и у мышей, где IL-17 нейтрализовали [13]. Следовательно, ИЛ-17, скорее всего, играет важную роль в миграции нейтрофилов в HSK [13, 15]. Однако в некоторых исследованиях было высказано предположение, что увеличение миграции нейтрофилов является лишь переходным и возвращается к исходной 4-дневной постинфекции [16]. Кроме того, вирусные титры у мышей с IL-17R-дефицитом и мышей дикого типа были сопоставимы [16]. Таким образом, IL-17 не играет никакой роли в репликации вируса и только смягчает повреждение тканей; однако он играет роль в стимулировании других провоспалительных цитокинов [16].
IL-17 также индуцирует продуцирование IL-6, провоспалительного цитокина. У мышей, не имеющих IL-17R, была снижена концентрация IL-6 [15]. Staats и Lausch продемонстрировали значительное увеличение IL-1α и IL-6 в роговицах, инфицированных ВПГ, по сравнению с неинфицированными роговицами [11]. Лечение мышей обработкой антителом (для предотвращения HSK) уменьшало продукцию как IL-1α, так и IL-6 [11]. IL-6 влияет на воспаление роговицы и инфильтрацию нейтрофилов [17]. Уровни IL-6 значительно увеличиваются после инфицирования ВПГ-1 [18]. В исследовании, проведенном Fenton et al., У мышей, лишенных IL-6, была снижена непрозрачность роговицы через два дня после ВПГ-инфекции. Эти мыши также проявляли снижение воспаления роговицы и снижение набора нейтрофилов. Антитело, нацеленное на ИЛ-6 у мышей дикого типа, приводило к уменьшению воспаления роговицы [17]. Подобно воздействию IL-17, титры вирусов между мышами дикого типа и мышами с дефицитом IL-6 не были значимыми (p> 0,7). Кроме того, разница в воспалении роговицы между двумя группами была только временной, и она сравнивала друг с другом постинфекцию на 4-й день. Тем не менее, введение IL-6 с HSV-1 у мышей, лишенных IL-6, приводило к увеличению концентрации воспалительных макрофагов белок-2 (MIP-2) и MIP-1α [17]. Кроме того, мыши, лишенные IL-6, имели меньшую концентрацию MIP-2 [17]. Поскольку MIP-2 и MIP-1α являются хемоаттрактантами для нейтрофилов, снижение производства IL-6 может уменьшить инфильтрацию нейтрофилов [19]. Как показано Yan и др., Антитело, нацеленное на IL-10, увеличивает продукцию IL-6, MIP-2 и MIP-1α, но введение IL-6 не изменяет концентрацию IL-10 [20]. Таким образом, можно предположить, что ингибирование IL-10 вызывает повышенные уровни IL-6, что приводит к увеличению продуцирования MIP-2 и MIP-1α, который затем привлекает нейтрофилы и увеличивает тяжесть поражения [17, 19, 20 ].
Анти-HSV-1 gD-антитело защищает роговицу от HSK; инъекция этого антитела приводит к снижению уровней провоспалительных медиаторов, таких как MIP-2, MCP-1, MIP-1α и MIP-1β. Следовательно, можно предположить, что эти молекулы участвуют в воспалительном ответе HSK [12]. MIP-1α помогает привлекать как нейтрофилы, так и Т-клетки и продуцируется многочисленными клетками, включая нейтрофилы, макрофаги и Т-клетки. Хотя репликация вируса не изменялась между мышами дикого типа и мышами с дефицитом MIP-1α, тяжесть заболевания, измеряемая ростом новых кровеносных сосудов и инфильтрацией воспалительных клеток, была снижена у мышей, у которых отсутствовал MIP-1α. Кроме того, эти мыши с дефицитом MIP-1α также имели более низкие уровни IL-2 и IFN-γ [12].
MIP-2 является еще одним хемокином CXC, который помогает привлекать нейтрофилы к месту поражения. У мышей, инфицированных HSV-1, MIP-2 была повышающей постинфекцией. Кроме того, мыши, получавшие антитело против MIP-2, уменьшали непрозрачность роговицы и уменьшали инфильтрацию нейтрофилов [19]. MIP-2 и MIP-1α генерируются с помощью IL-1α и IL-6 [16]. Индуцирование IL-1α увеличивало уровни MIP-2 и MIP-1α, в то время как нейтрализация IL-1α приводила к снижению продуцирования MIP-2 [17, 19]. IL-17 также генерирует MIP-2 в дополнение к генерации IL-6 [16]. У мышей с дефектными рецепторами IL-17 в начале инфекции было снижено производство MIP-2 и MIP-1α [16]. Другие молекулы, модулирующие продуцирование MIP-2, включают другие хемокины, такие как моноцитарный хемоаттрактант-белок-1 (MCP-1). Уменьшение в MCP-1, хемокине CC, привело к увеличению производства MIP-2, что привело к увеличению тяжести HSK [21].
Ячейки Th17 продуцируют IL-17, который помогает наносить нейтрофилы на поражение, что приводит к повреждению тканей. IFN-γ, с другой стороны, подавляет клетки Th17 и экспрессию IL-17 [13, 16]. Раннее истощение IFN-γ увеличивает тяжесть поражения, а также приводит к тяжелому энцефалиту у мышей [13]. У мышей, лишенных IFN-γ, были повышенные уровни IL-17 (p
У мышей, инфицированных HSV-1, провоспалительные цитокины, такие как IL-2, IFN-γ и TNF-α, были усилены [22]. IL-2 может индуцировать продуцирование IFN-γ и TNF-α наряду с активированием нейтрофилов и предотвращением их апоптоза. Лечение инфицированных мышей антителами против IL-2 уменьшало миграцию нейтрофилов в ткань при одновременном развитии нейтрофильного апоптоза [3]. Аналогично, лимфотоксин-альфа (LT-α), член надсемейства TNF, продуцируемый активированными клетками CD4 + Th, также имеет провоспалительную роль у мышей. Мыши, обработанные антителами против LT-α, приводили к снижению тяжести поражений и снижению продукции других хемокинов [24].
Хотя многие из вышеуказанных цитокинов, таких как IL-17, IL-6, IL-1α и IFN-γ и хемокины, такие как MIP-2, MCP-1, MIP-1α и MIP-1β, обладают провоспалительной ролью в разрушении вызванных HSV-1, включая инфильтрацию нейтрофилов и воспаление роговицы, другие хемокины и цитокины, такие как IL-10 и CCL3, могут иметь защитную роль. В исследовании, проведенном Яном и др., ИЛ-10, цитокин, продуцируемый эпителиальными клетками роговицы мышей и фибробластами, также влиял на миграцию нейтрофилов и другое производство хемокинов и цитокинов [20]. Антитела, нейтрализующие IL-10, увеличивали продукцию IL-6, MIP-2 и MIP-1α и ухудшали тяжесть поражения вследствие инфильтрации нейтрофилов; в соответствии с этим, мыши, лишенные гена IL-10, проявили повышенную тяжесть HSK. Добавление IL-6 к IL-6-дефицитным мышам не увеличивало IL-10 [17, 20]. В соответствии с этим исследованием IL-10, скорее всего, имеет защитную роль в моделях мышей HSK [20]. Аналогичным образом, в исследовании Tumpey et al., Введение IL-10 приводило к ингибированию HSK с уменьшенной непрозрачностью роговицы. Это уменьшило риск слепоты и неоваскуляризации. У этих мышей концентрация IL-2 и IL-6 была значительно снижена, хотя никаких изменений в уровнях IL-1α не было отмечено [25]. Подобные результаты были замечены в других исследованиях, включая снижение инфильтрации нейтрофилов после введения ИЛ-10 [26]. Аналогично, CCL3, провоспалительный цитокин, показал, что он имеет защитную роль в HSK. У мышей, не имеющих CCL3, была выражена серьезность заболевания [27].
Помимо инфильтрации нейтрофилов и воспаления, другие процессы, которые приводят к повреждению тканей, включают ангиогенез. Нормальная роговица неваскулярна; однако рецидивирующие инфекции HSK приводят к неоваскуляризации, которая вызывает рубцевание и фиброз роговицы [28, 29]. С ростом новых кровеносных сосудов, воспалительные клетки имеют более легкий доступ к глазу [30]. Неоваскуляризация стимулируется фактором роста эндотелия сосудов (VEGF) [30]. МикроРНК (miRNAs) являются регуляторами генов, которые могут быть вызваны изменениями в клеточной среде. miR-132 представляет собой микроРНК, которая активируется в HSK и участвует в ангиогенезе [30]. У мышей, у которых отсутствовал рецептор IL-17, был снижен уровень miR-132, предполагающий роль IL-17 в ангиогенезе и регуляции генов [30].
Нормальная роговица имеет VEGF, но она связывается с растворимой формой рецептора VEGF 1 (sVEGFR-1), препятствуя действию VEGF в роговице для создания новых кровеносных сосудов. Дисбаланс между концентрациями VEGF и sVEGFR-1 приводит к избытку VEGF, приводящему к ангиогенезу [31]. Инфекция HSV-1 увеличивает синтез VEGF-A, мощного индуктора новых кровеносных сосудов, при уменьшении концентрации sVEFGR-1 путем получения матричных металлопротеиназ, таких как MMP-2, MMP-7 и MMP-9 [18 , 31, 32]. Эти матричные металлопротеиназы деградируют sVEGFR-1, что приводит к дисбалансу между уровнями VEGF и sVEGFR-1; это относительное увеличение концентрации VEGF приводит к неоваскуляризации [31].
В исследовании, проведенном Suryawanshi et al., HSK увеличивала экспрессию IL-17, вызывая дисбаланс между концентрациями VEGF и sVEGFR-1. ИЛ-17 стимулировал производство ИЛ-6. Вместе IL-17 и IL-6 улучшили производство VEGF-A. Кроме того, IL-17 способствовал выражению MMP-2, MMP-8 и MMP-9; эти матричные металлопротеиназы способны разрушать sVEGFR-1. В целом, исследование показало, что мыши, лишенные IL-17R, имели снижение частоты и тяжести неоваскуляризации [15]. Аналогичные результаты были обнаружены у мышей, которым дали антитела к IL-17 [15]. Дополнительные источники VEGF и MMP включают нейтрофилы. Таким образом, многие из молекул, вовлеченных в привлечение нейтрофилов к месту поражения, косвенно участвуют в неоваскуляризации роговицы [15].
Аналогично, IL-6, провоспалительный цитокин, продуцируемый клетками, инфицированными HSV-1, стимулирует неинфицированные эпителиальные клетки в роговице и фибробластах в строме для получения VEGF [14, 18]. В исследовании Biswas и др. IL-6 вводили в субконъюнктиву мыши, что приводило к увеличению продукции VEGF. Кроме того, уровни VEGF снижались дозозависимым образом, когда мышечные антитела, нейтрализующие IL-6, получали мышам [18]. Наконец, IL-1 является провоспалительным цитокином, продуцируемым инфицированными HSV-1 клетками, который индуцирует роговичные клетки для продуцирования VEGF и стимулирует ангиогенез [18, 33]. Кроме того, IL-1 увеличивает инфильтрацию нейтрофилов в роговицу вместе с концентрацией MIP-2 и IL-6 [33].
Герпетический кератит — заболевание роговицы, вызванное ВПГ-1. Это ведущая причина слепоты роговицы в мире [1]. Основной молекулярный механизм до сих пор неизвестен, но экспериментальные модели помогли лучше понять лежащую в основе молекулярную патологию. Цитокины и хемокины представляют собой небольшие белки, высвобождаемые клетками, которые играют важную провоспалительную или противовоспалительную роль в модуляции процесса болезни [8]. Цитокины, такие как IL-17, IL-6, IL-1α и IFN-γ и хемокины, такие как MIP-2, MCP-1, MIP-1α и MIP-1β, обладают провоспалительной ролью в разрушении, вызванном HSV-1 включая инфильтрацию нейтрофилов и воспаление роговицы, а также другие хемокины и цитокины, такие как IL-10 и CCL3, могут иметь защитную роль. Большая часть ущерба связана с многочисленными действиями провоспалительных молекул, начиная от инфильтрации нейтрофилов до неоваскуляризации. Хотя для лучшего понимания роли этих молекул как в экспериментальных моделях, так и в роговицах человека необходимы еще много исследований, современные исследования способствовали тому, что эти молекулы стали мишенями для будущей терапии.
Авторы заявляют, что у них нет конфликта интересов.
