Роль лизосомальных ферментов при воспалении
Содержание | Следующая статья | Предыдущая статья
О.В. Цыганкова, Л.А. Руяткина, З.Г. Бондарева
Лизосомальные ферменты играют одну из главных ролей в патофизиологии системного воспаления, в т. ч. за счет широкого представления в полиморфноядерных лейкоцитах. С детальным изучением их биогенеза могут быть связаны определенные перспективы в области изучения механизмов формирования и точек терапевтического купирования артериальной гипертонии, ишемической болезни сердца, дислипидемий. Влияние чрезвычайного раздражителя, в роли которого могут выступать гипоксия/ишемия, эндогенные продукты распада тканей или микроорганизмов, усиленный синтез глюкокортикоидов, повышение тонуса симпато-адреналовой, ренин-ангиотензин-альдостероновой систем, снижение содержания инсулина, активизация процессов оксидативного стресса, ведет к нарушению целостности лизосомальных мембран с последующим развитием цепного цитолитического процесса и целого каскада метаболически неблагоприятных событий. (Цитокины и воспаление. 2009. Т. 8, № 4. С. .)
Ключевые слова: лизосомы, ферменты, полиморфноядерные лейкоциты.
Концепция лизосомального аппарата, предложенная в 1955 году К. де Дювом, как и всякая новая идея, была использована в самых разных областях науки для обоснования важной роли этих структур в механизмах исследуемых ими явлений. Однако важнейшая роль лизосом в процессах воспаления и до сегодняшнего дня является неоспоримой. Характер и объем вторичной альтерации при воздействии флогогенного агента определяется вовлеченностью лизосомальных гидролаз. При повреждении лизосом освобождаются заключенные в них ферменты, способные расщеплять все вещества, входящие в состав клетки (белки, нуклеиновые кислоты, углеводы, липиды). Далее эти ферменты, при наличии этиологического фактора или уже без него, продолжают процесс альтерации, а также деструкции, в результате чего образуются биологически активные вещества – медиаторы воспаления. По этой причине лизосомы называют «стартовой площадкой» воспаления.
При воспалении любого генеза лабилизирующим действием на лизосомы могут обладать продукты «респираторного взрыва», следствием которого является активация процессов свободнорадикального окисления липидов, провоспалительные медиаторы (гистамин, лейкотриены, факторы агрегации тромбоцитов и др.), снижение соотношения цАМФ/цГМФ, повышенное внутриклеточное содержание кальция [20, 27, 28, 32, 49, 58]. Повышенную активацию лизосомального аппарата может вызвать и метаболический ацидоз как следствие гипоксии и гликолитических процессов, протекающих в анаэробных условиях [9, 14, 15]. Нарушение соотношения протеиназы/ингибиторы протеиназ коррелирует со степенью воспаления, приводя в крайнем случае к неконтролируемому протеолизу [1, 4, 8, 12, 25], но при этом без лизосомальных ферментов (ЛФ) невозможны процессы обновления и репарации [9, 12, 31].
Гидролитический потенциал лизосом реализуется в зависимости от функционального состояния организма, в покое — лишь частично. Под влиянием стрессорных факторов быстро увеличиваются размеры и количество лизосом в клетке с повышением проницаемости их мембран, изменяется локализация. Влияние факторов умеренной интенсивности приводит к активации лизосомального аппарата клеток без сопутствующего повреждения лизосом [14, 15, 36]. С увеличением силы и длительности раздражения нарушается структурная целостность лизосомальных мембран с выходом кислых гидролаз в цитоплазму и циркулирующую кровь и последующим развитием цепного цитолитического процесса с повреждением тканей [32, 33, 39, 44, 50].
Лизосомальная активация может быть избирательной в зависимости от силы, характера и длительности воздействия. Вероятно, это связано с различной локализацией ферментов в лизосомах (связанные с мембраной и растворимые), а также их определенной субстратной специфичностью, развернутой по времени и неодинаковой по степени выраженности. Этот процесс идет постепенно и до определенного момента обратим [11, 14, 38]. В этой связи логично, что активность лизосомальной гиперферментемии отражает динамику клинического течения патологического процесса, его прогностическое значение и уровень клеточной деструкции [40]. Подобные корреляции выявлены при атопическом дерматите: более высокая активность ЛФ, особенно в период стихания обострения, и низкие резервные возможности полиморфноядерных лейкоцитов (ПМЛ) коррелируют с его более тяжелым, непрерывно-рецидивирующим течением [8].
Лизосомы принимают участие практически во всех «стратегических» процессах жизнедеятельности клетки. В клеточном метаболизме им принадлежит центральное место, они участвуют в процессах фагоцитоза, иммуногенеза, реализации гормонального эффекта, репарации и реконструкции внутриклеточных структур, сегрегационных функциях клетки, катаболизме вне- и внутриклеточных белков, биосинтезе и секреции ряда гормонов (инсулина, соматотропина, гормонов щитовидной железы) [6, 8, 13, 14, 15, 41, 45]. В процессах оплодотворения, спермато- и оогенеза, метаморфоза, дифференцировки, деления и старения клеток, формирования лекарственной устойчивости лизосомальный аппарат также играет значимую роль [27, 51, 56]. Более того, в современных зарубежных исследованиях изучалась роль лизосомальных гидролаз, в частности, катепсина D в становлении умственных способностей, формировании интеллекта, а также его снижении [28, 37].
Существование постоянной связи лизосом с внутренней средой организма, опосредованной механизмами эндоцитоза, экзоцитоза и диацитоза, позволяет смотреть на лизосомально-вакуолярный аппарат клеток как на сложную высокоспециализированную систему организма, имеющую представительство во всех тканях. Лизосомальная система крайне динамична, что подтверждается не только ее реакцией на любые изменения гомеостаза, но и наличием сезонных ритмов активности ЛФ: повышение активности кислых гидролаз и проницаемости мембран лизосом в весенне-летнее время года и снижением указанных показателей в осенне-зимний период [20].
Интересны изменения лизосомального пейзажа в зависимости от характера питания. Активация ферментов, участвующих в деградации углеводных субстратов (кислая фосфатаза), в большей степени выражена у животных, содержащихся на углеводистом рационе. Белково-липидная диета стимулирует выработку катепсина D. Можно предположить, что принципы лечебного питания, основанные на продолжительном поступлении в организм определенных нутриентов, связаны с изменением химической структуры лизосомальных мембран, что изменяет их композицию и увеличивает проницаемость для специфического субстрата; причем эти изменения носят системный характер [14, 55].
Работа Тутельяна В.А. и др. (1993) демонстрирует правоту этой гипотезы и обосновывает необходимость соблюдения лечебной диеты, обогащенной ω-3 полиненасыщенными жирными кислотами, для коррекции нарушений обмена липидов и липопротеинов при ишемической болезни сердца (ИБС), в том числе за счет восстановления активности лизосомальных липолитических ферментов [23].
Количество уже известных ЛФ приближается к 100, причем существует ферментная гетерогенность энзимов не только в одних и тех же клетках, но и в клетках различных тканей. Например, в ПМЛ преобладают окислительно-восстановительные ферменты лизосом, внося существенный вклад в высокую бактерицидную активность лейкоцитов и макрофагов [26, 38, 52, 58] и даже принимая участие в процессах клеточной дифференцировки [30]. Кислая фосфатаза, хотя и присутствует в кардиомиоцитах, все же более характерна для интерстициальных клеток, макрофагов и лейкоцитов крови, являясь их постоянным маркерным ферментом, локализованным повсеместно: в матриксе лизосом, в их мембране и даже в цитозоле. Катепсин D — основной, если не единственный, энзим кардиомиоцитов, сконцентрированный в лизосомальном матриксе [29, 47], ДНКаза также сосредоточена в матриксе лизосом и, частично, в ядре клетки [46, 50].
Происхождение лизосомальных энзимов в сыворотке крови остается спорным. Одним из наиболее вероятных источников являются ПМЛ крови и повреждение тканей [18, 19, 56]. Нейтрофильный гранулоцит играет одну из главных ролей в системе гуморально-клеточного взаимодействия, что делает его универсальной мишенью и, соответственно, индикатором различных нарушений гомеостаза [4, 7, 11, 16, 38]. Показано, что ПМЛ и макрофаги представляют собой своеобразное депо лизосомальных гидролаз, определяющих кислород-независимую профессиональную биоцидность фагоцитов и служащих основным источником плазменных энзимов [21, 35, 49].
Лизосомальная дисфункция и соматическая патология человека
Современная цитология активно изучает нарушения биогенеза лизосом в развитии приобретенных заболеваний человека. Масса публикаций последних лет посвящена проблемам взаимосвязи катепсина D и болезни Альцгеймера, однако однозначных данных на сегодняшний день нет [28, 37]. Увеличение плазменной концентрации лизосомальных катепсинов при неопластических процессах также неоднократно упоминалось в литературе [33, 48, 59]. Лизосомальная гиперферментемия является весьма чувствительным маркером клеточного «неблагополучия» [7, 41], что может быть использовано для ранней диагностики и определения степени тяжести ряда серьезных, жизненно опасных состояний, в том числе, ДВС-синдрома [54].
Любое повышение функциональной активности ткани приводит к усилению процессов аутофагоцитоза. При гипертрофии миокарда, обусловленной различными вмешательствами, данные об активности гидролаз в сердце противоречивы, вероятно, потому, что сама гипертрофия имеет разный характер в зависимости от этиологического фактора. В исследовании Yamamoto S. et al. (2000) было выявлено повышенное количество лизосомальных структур в кардиомиоцитах ремоделированного гипертрофированного миокарда желудочков. Причем в образцах эксцентрично гипертрофированного миокарда было найдено большее количество кардиомиоцитов, содержащих деградированную ДНК, чем в образцах концентрически гипертрофированного миокарда [57].
Это может свидетельствовать о различных стадиях сердечной недостаточности, поскольку она была выраженной, вплоть до фатальной, при эксцентрической гипертрофии и незначительной при концентрической. Высокая лизосомальная и аутофагоцитарная активность, наблюдаемая в пораженных кардиомиоцитах, свидетельствует о наличии саморазрушающегося процесса цитоплазматической дегенерации, осуществляемого под контролем запрограммированного аутолиза.
Содержание | Следующая статья | Предыдущая статья

Начата подписка на 2016 год!
Обновление на книжной полке: компакт-диск Цитокины и воспаление, 2008 год.
Значение лизосом в патологии столь многогранно и существенно, что в настоящее время трудно представить патологический процесс, в который не был бы вовлечен лизосомальный аппарат клетки. Следует выделить два аспекта этой проблемы. Во-первых, вовлечение лизосом в развитие таких общих патологических процессов, как воспаление и некроз и в этом случае участие лизосом является одним из проявлений их нормальной защитной функции организма в ответ на возникновение очага инфекции. Однако развитие ряда патологий связано с нарушением структуры и функции самих лизосом. Нарушения в лизосомах являются первичным, пусковым звеном в развитии двух типов патологических процессов. Для первого из них характерно повреждение лизосомальных мембран. Каковы же обстоятельства, способствующие возникновению патологической дестабилизации лизосомальной мембраны, ведущей к выходу в клеточный матрикс кислых гидролаз? Установлено, что проницаемость лизосомальных мембран значительно увеличивается при гипоксии (недостаток кислорода), изменении кислотно-щелочного равновесия, после травм и хирургических вмешательств, голодании, при заболеваниях суставов и инфекционных заболеваниях, воздействии ионизирующей радиации и некоторых химических агентов. Последнее нашло практическое применение, в частности направленное повреждающее воздействие некоторых фармакологических агентов и ионизирующей радиации на мембраны лизосом опухолевых клеток используется при лекарственной и радиотерапии онкологических заболеваний. Из патологических состояний, связанных с повреждением лизосомальных мембран и высвобождением гидролаз, наиболее изучены болезни суставов — острый и ревматоидный артриты, подагра. При этих заболеваниях, в результате воздействия лизосомальных ферментов, наблюдается эрозия хрящей и деструкция суставов Показано, что аналогичные изменения могут быть получены у экспериментальных животных при введении в область сустава, веществ, обладающих дестабилизирующим действием на лизосомальные мембраны, например стрептолизина S. Наоборот, вещества, стабилизирующие лизосомальные мембраны (к ним относятся многие противовоспалительные препараты, например, глюкокортикостероид — кортизон), значительно уменьшают воспалительную реакцию.
К другой, сравнительно редкой группе заболеваний обусловленных нарушением функции лизосом, относят врожденные генетические нарушения в системе синтеза лизосомальных ферментов. Эти нарушения приводит к развитию так называемых лизосомальных болезней накопления. Такие болезни вызываются, главным образом, мутацией в гене, кодирующем ту или иную гидролазу, что выражается либо в полном подавлении синтеза ферментного белка, либо в синтезе белковых молекул обладающих резко сниженной биокаталитической активностью. Кроме этого генетически обусловленными могут быть нарушения при которых ферментный белок синтезируется без сигнальных участков и по этой причине не распознается транспортной системой. В результате блокируется его доставка из аппарата Гольджи в лизосомы. Нерасщепленный субстрат такой гидролазы накапливается в лизосомах, что приводит к переполнению клеток разбухшими лизосомами, клетки приобретают пенистый вид (пенистые клетки), утрачивают вследствие этого свои функциональные свойства и в конечном результате погибают, что ведет к развитию тяжелых заболеваний (напр. болезнь Тей-Сакса, Гоше, Нимана-Пика и др.), заканчивающихся во многих случаях смертельным исходом в детском возрасте.
• Протеазы:
эластазы, коллагеназы, катепсины B,
D,G,
F;
• Гидролазы
гликозидов: β-глюкуронидаза, лизоцим,
нейраминидаза;
• Гидролазы эфиров:
ДНКаза;
• Гидролазы
липидов: фосфолипаза А1
и А2,
холестеролэстеразы;
• Другие ферменты:
кислая фосфатаза.
Ферменты эндоплазматического ретикулума
Таблица 4.1.2
Ферменты
эндоплазматического ретикулума и их
локализация
Ферменты | Локализация |
Ферменты | гладкий |
ферменты | гладкий |
Ферменты, локализованные в цитозоле
• Метаболизм
углеводов: ферменты гликолиза, включая,
фосфорилазу, киназу фосфорилазы,
протеинкиназу, гликогенсинтаза,
фосфоенолпируват-карбоксикиназа,
ферменты пентозо-фосфатного пути,
малатдегидрогеназа, изоцитратдегидрогеназа;
• Обмен липидов:
ацетил-СоА-карбоксилаза, комплекс
синтазы жирных кислот;
• Обмен аминокислот
и белков: аспартатаминотрансфераза,
аланинаминотрансфераза, аргиназа,
аминоацил-т-РНК-синтетазы;
• Синтез нуклеотидов:
нуклеозидкиназа, нуклеотидкиназа.
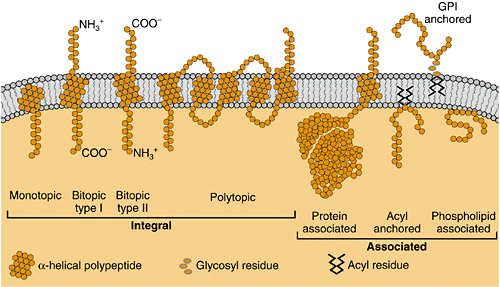
Мембранные ферменты
• Периферические
белки (легко экстрагируется из мембраны
солевым раствором).
• Интегральные
белки с небольшой частью полипептидной
цепи, закреплённой в мембране.
• Интегральный
белок с небольшой частью полипептидной
цепи, внедрённой в бислой.
• Интегральный
белок, пронизывающий липидный бислой,
(ионные трансферазы, такие как
Na,K-АТРаза,Са2+
-АТРаза).
• Белок, присоединённый
к мембране за счёт второго белка, который
находится в бислое (рис.4.3.2).

Рис. 4.1.2. Мембранные
ферменты
Уровни структурной организации ферментов в клетке
В клетке есть
ферменты разной структурной организации
– от простых мономерных до ферментов,
объединенных в ферментные ансамбли.
Ферменты по их структурной организации
можно разделить на:
1.
Мономерные
ферменты;
2. Олигомерные
ферменты (простые, построенные из
субъединиц одного типа);
3. Олигомерные
ферменты (сложные, построенные из
субъединиц разного типа);
4. Ферментные
комплексы : а) мультиферментные комплексы,
б)
мультиферментные конъюгаты;
5. Ферментные
ансамбли: а) адсорбционные,
б)
интегральные.
Значения
молекулярных масс ферментов колеблются
в широких пределах: от нескольких тысяч
до нескольких миллионов. В природе
насчитывается несколько десятков
ферментов, обладающих сравнительно
небольшими молекулами (до 50 кДа).
Большинство же ферментов представлено
белками более высокой молекулярной
массы, построенными из субъединиц
(рис.4.1.3).

a
б
в
г
Рис. 4.1.3. Модели
строения некоторых олигомерных ферментов:
а ‒ молекула глутаматдегидрогеназы,
состоящая из 6 протомеров; б ‒ молекула
РНК-полимеразы; в ‒ половина молекулы
каталазы; г ‒ молекулярный комплекс
пируватдегидрогеназы.
Так,
каталаза (252 кДа) содержит в молекуле
шесть протомеров с молекулярной массой
42 кДа каждый. Молекула фермента,
ускоряющего реакцию синтеза рибонуклеиновых
кислот (РНК-полимераза, 400 кДа), состоит
из 6 неравных субъединиц. Полная молекула
глутаматдегидрогеназы, ускоряющей
процесс окисления глутаминовой кислоты
(336 кДа), построена из 6 субъединиц с
молекулярной массой 56 кДа.
Процесс олигомеризации
придает субъединицам белков повышенную
стабильность. Связи в комплексе в
основном нековалентные, поэтому такие
ферменты легко диссоциируют на протомеры.
Способы
компоновки протомеров в мультимеры
разнообразны. Крайне важно, что достроенный
из субъединиц фермент проявляет
максимальную каталитическую активность
именно в виде мультимера: диссоциация
на протомеры резко снижает активность
фермента. Не все ферменты-мультимеры
построены исключительно из каталитически
активных протомеров. Наряду с
каталитическими в их составе отмечены
регуляторные субъединицы, как, например,
у аспартат-карбамоилтрансферазы.
Среди
ферментов-мультимеров безусловно
преобладают димеры и тетрамеры (их
несколько сотен), в меньшей мере
распространены гексамеры и октамеры
(несколько десятков) и необыкновенно
редко встречаются тримеры и пентамеры.
Молекулы
ферментов-мультимеров в ряде случаев
составлены из субъединиц двух типов,
обозначаемых условно как субъединицы
типа А
и В.
Они сходны друг с другом, но отличаются
по некоторым деталям первичной и
третичной структур. В зависимости от
соотношения протомеров типа А
и В
в мультимере последний может существовать
в виде нескольких изомеров, которые
называют изозимами. Так, при четырех
субъединицах возможны 5 изозимов:
IIIIIIIVV
AAAAAAABAABBABBBBBBB
В
настоящее время интерес к изозимам
резко повысился. Оказалось, что кроме
генетически детерминированных изозимов
существует большая группа ферментов,
обладающая множественными формами,
возникающими в результате их
посттрансляционной модификации.
Множественные формы ферментов и изозимы
в частности используются сейчас для
диагностики болезней в медицине,
прогнозирования продуктивности животных
подбора родительских пар при скрещивании
для обеспечения максимального гетерозиса
в потомстве и т. п. (более детально эти
вопросы рассмотрены в лекции 5.2).
Соседние файлы в папке Всякое
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
