Роль нейтрофилов при воспалении
Одним из подвидов гранулоцитарных лейкоцитов являются нейтрофилы. Созревают они в красном костном мозге. Как связаны между собой нейтрофилы и воспаление, какую роль они играют в защите организма?
Коротко о нейтрофильных гранулоцитах
Эти клетки белой крови достаточно крупные, имеют диаметр около 10 мкм. Свое название они получили из-за наличия в цитоплазме клетки зернистых гранул. Гранулы содержат особые антибактериальные ферменты, способные разрушать оболочку бактерий, внедрившихся при воспалении. При лабораторных исследованиях для определения количества клеток, мелкие зерна в виде пыли обрабатывают красителями, они окрашиваются в фиолетово-розовый цвет.
Зрелые нейтрофилы – большая группа, составляющая 2/3 от количества всех клеток лейкоцитов. При этом большее их количество находится в костном мозге, остальные распределяются по другим органам. И только небольшая часть (1%), достигая периферической крови, через несколько часов проникает в ткани. Продолжительность их жизни зависит от количества микроорганизмов в очаге воспаления.
Процесс образования нейтрофильных клеток лейкоцитов в костном мозге составляет примерно 5 суток. Затем они перемещаются по сосудистому руслу в течение 8–10 часов. За это время клетки, при столкновении с чужеродным агентом, уничтожают вредоносные частицы в очаге поражения.
Функции нейтрофилов при заболевании
Основная функция – защита организма при инфицировании. Нейтрофильные гранулоциты крови очень подвижны. В очаге поражения они выделяют особые ферменты, которые способствуют рассасыванию отмирающих тканей. Передвигаясь по сосудам, они находят инфицированное место, проникают сквозь стенки капилляров, поглощают и растворяют патогенные бактерии.
Для работы нейтрофилы, используют энергию, а получать ее могут даже без участия кислорода. Это дает Клетки крови возможность выполнять функции в очаге, где нарушено кровообращение. Нейтрофильные клетки лейкоцитов выделяют фермент лизосом, который способствует размягчению тканей в инфицированном очаге. Клетки захватывают вредоносные частицы и «переваривают» их.
Кроме того, они способны оказывать влияние на иммунитет. Гранулы выделяют в кровь регуляторное вещество, которое другие клетки воспринимают как сигнал для защиты организма. А также нейтрофилы содержат особые вещества, которые влияют на процесс свертывания крови.
Работа нейтрофильных лейкоцитов более всего распространяется на бактерии и грибки, на вирусы они реагируют слабо. Один нейтрофил способен уничтожить около семи микробов. Жизнь клеток продолжается от нескольких часов до нескольких суток, затем они нейтрализуются печенью и селезенкой.
Классификация нейтрофильных гранулоцитов
Исходя из формы ядра, нейтрофилы состоят из трех видов гранулоцитарных клеток: сегментоядерные, палочкоядерные и юные. В костном мозге всегда есть некоторое количество нейтрофилов. При патологических изменениях и по требованию организма происходит их выброс в кровь.
Начиная с зарождения и до полного созревания, нейтрофилы проходят шесть стадий развития. Одновременно организм может иметь клетки разных стадий созревания. Для постановки диагноза важным показателем есть соотношение четырех видов друг с другом в результатах анализов крови. По степени зрелости можно назвать следующие группы: миелоциты → метамиелоциты → палочкоядерные → сегментоядерные.
При наличии воспаления первыми начинают борьбу самые старшие клетки. Обычно их количества достаточно для нейтрализации бактерий в очаге. При серьезном воспалении функцию могут выполнять палочкоядерные, и даже совсем несозревшие клетки.
Образование полностью созревших клеток происходит только в костном мозге. Юные клетки у человека здорового в крови не присутствуют. Если болезнь приобретает осложненную форму, прежде всего, гибнут сегментоядерные клетки. При этом новые формы не успевают созревать, кровь наполняют незрелые нейтрофилы, изменяется формула лейкоцитов. Учитывая соотношение старших и молодых клеток, происходит сдвиг формулы в ту или другую сторону.
Нормы и аномалии нейтрофилов
Допустимый уровень нейтрофильных клеток у взрослых варьируют от 45 до 70% от уровня лейкоцитов. Для женщин и мужчин значения нормы практически одинаковы. Показатели отличаются у разных возрастных групп. В процессе роста у детей содержание нейтрофильных клеток изменяется. После шести лет лейкоцитарная формула у детей сравнивается с данными анализов у взрослых.
Состояние, когда нейтрофилы повышены, именуют нейтрофилией или нейтрофилез. Показатели умеренны, если литр крови содержит не более 10 миллиардов клеток, повышены, если их от 10 миллиардов до 20. Цифры от 20 до 60 свидетельствуют о тяжелой нейтрофилии. Нарушения формулы крови могут быть вызваны некоторыми патологиями:
- образование гнойного воспаления – ангина, перитонит, аппендицит, пиелонефрит, сепсис;
- отравление алкоголем или другими токсинами, действующими на костный мозг;
- разложение тканей в очаге новообразований;
- некрозы при ожоге, а также патология тканей во время инсульта или инфаркта.
Количество нейтрофилов держится выше нормы, какое-то время после патологического процесса. Чуть повышены нейтрофилы могут быть у беременных, после тяжелой физической нагрузки, а также после сытной трапезы.
Нейтропения свидетельствует о сниженном уровне нейтрофилов. Численность их колеблется от 1,5 до 0,5 миллиарда в зависимости от степени нейтропении. Такое положение наблюдается при недостаточной выработке клеток костным мозгом, гибели клеток при наличии тяжелого воспаления. Понижение нейтрофилов может быть связано с лучевой и химиотерапией, анемией или недостатком витаминов.
Некоторые рекомендации
Нейтрофилия и нейтропения не рассматриваются как заболевание. Но сдвиг формулы в одну или другую сторону, важный показатель для постановки диагноза. Лекарства для нормализации уровня нейтрофилов в крови нет. Врач должен установить причину нарушений, принять меры и назначить лечение для устранения обнаруженной патологии.
После лечения воспаления показатели сами приходят к нормальным цифрам. Если причина кроется в приеме лекарств, врач должен пересмотреть назначения, отменить неэффективные препараты или заменить другими. При недостаточном поступлении или усваивании питательных веществ, витаминов, минералов следует сбалансировать питание, начать прием витаминных и минеральных комплексов.
Нейтрофилы. Роль нейтрофилов при воспалении легких.В отсутствие воспалительного процесса нейтрофилы, в основном, находятся в кровеносном русле, где они составляют большую часть циркулирующих лейкоцитов. Однако в ответ на воспалительный стимул происходит быстрое и часто массивное перераспределение неитрофилов в поврежденные ткани. Этот процесс имеет исключительно важное значение для развития патологического процесса в легких, где транспорт нейтрофилов облегчен благодаря тонкослойному барьеру, отделяющему альвеолы от капилляров, а также секвестрации нейтрофилов в сосудах легких. Небольшая часть этих нейтрофилов уже в нормальных условиях связана с эндотелием капилляров, образуя пул быстро рекрутируемых клеток. Нейтрофилы рассматриваются как основные эффекторные клетки при остром воспалении, и их роль в противобактериальной и противогрибковой защите организма хорошо изучена. Лучше всего это может быть иллюстрировано развитием частых и тяжелых инфекций при нейтропении. Относительно недавно определено участие нейтрофилов в патогенезе хронического воспаления тканей легких, обычно приводящее к фиброзу. Период жизни нейтрофилов составляет примерно 6-8 часов в периферической крови и это, вероятно, объясняет их продукцию с удивительно высокой скоростью — 2,5 биллиона клеток в час. Так же, как другие лейкоциты, нейтрофилы происходят из общей полипотентной стволовой клетки в костном мозге. В костном мозге у взрослых содержится 2 • 1011 миелоидных предшественников, а резерв гранулоцитов составляет 6* 1011. Предшественники активно пролиферируют, а в резерв входят неделящиеся, созревающие гранулоциты. Через стадию предшественника они проходят за 4 дня (3-5 делений), а морфологическое и функциональное созревание в резерве занимает еще 5 дней. Покидая костный мозг, нейтрофилы являются полностью дифференцированными клетками, имеющими полный спектр поверхностных рецепторов и цитоплазматических гранул с продуктами секреции. Ежедневный выход из костного мозга в норме составляет 1011 гранулоцитов, но он может повышаться в несколько раз под влиянием воспалительных стимулов, которые заставляют выходить из резерва менее зрелые клетки, что проявляется «сдвигом влево», который расценивается как признак острой инфекции. Такой усиленный выход гранулоцитов из резерва могут индуцировать бактериальные липополисахариды, провоспалительные цитокины (IL-1, TNF-a), СЗа или кортикостероиды.
В сосудистом русле 5* 1011 гранулоцитов (средняя норма у взрослых) делятся на два почти равных пула: циркулирующих и пристеночных, которые временно секвестрированы в состоянии прилипания к поверхности эндотелия венул. При заборе венозной крови сосчитывается только циркулирующий пул. Динамическое равновесие двух пулов регулируется: — агентами, усиливающими пристеночное стояние путем усиления экспрессии адгезионных молекул (ICAMs), к которым относятся хемокины, IL-1, TNF-a, IFNy; Пристеночное стояние — это первый шаг к выходу из сосудов в ткани, в очаг инфекции или воспаления. Гранулоциты недолгое время проводят в крови: средний полупериод жизни 6-7 дней, а после выхода в ткани — не более двух дней. В связи с этим любое нарушение продукции гранулоцитов в костном мозге ведет к снижению уровня циркулирующих в крови гранулоцитов. Наряду с продукцией неитрофилов, крайне важным для организма является процесс удаления неитрофилов из тканей и кровотока. Среди механизмов, вовлеченных в процесс удаления неитрофилов, апоптоз, или запрограммированная гибель клетки, играет ключевую роль. Недавно было обнаружено, что старые нейтрофилы могут быть специфически обнаружены и фагоцитированы интактными альвеолярными макрофагами. Это является одним из механизмов удаления стареющих неитрофилов из респираторного тракта, которые в результате лизиса могут высвободить большое количество токсических продуктов секреции. Различные группы мембранных рецепторов были обнаружены на поверхности неитрофилов. Эти рецепторы осуществляют связь неитрофилов с их микроокружением и регулируют функциональную активность неитрофилов: адгезию, миграцию, хемотаксис, дегрануляцию и поглощение. — Также рекомендуем «Адгезия и миграция нейтрофилов при воспалении в легких.» Оглавление темы «Роль нейтрофилов и эозинофилов в воспалении легких.»: |
Эффекты воспаления. Макрофаги и нейтрофилы при воспалении
а) Воспаление. При повреждении ткани независимо от его причины (бактерии, травма, химические агенты, тепло или любое другое явление) выделяется множество веществ, вызывающих существенные вторичные изменения в окружающих неповрежденных тканях. Весь комплекс этих тканевых изменений называют воспалением.
Воспаление характеризуется:
(1) расширением местных кровеносных сосудов с последующим избыточным местным кровотоком;
(2) увеличением проницаемости капилляров, что способствует утечке большого количества жидкости в интерстициальное пространство;
(3) часто — свертыванием жидкости в интерстициальном пространстве в связи с избытком фибриногена и других белков, вытекающих из капилляров;
(4) миграцией большого числа гранулоцитов и моноцитов в ткани;
(5) отеком тканевых клеток.
К тканевым продуктам, вызывающим эти реакции, относятся гистамин, брадикинин, серотонин, простагландины, несколько разных продуктов реакции системы комплемента, продукты реакции свертывающей системы крови и множество веществ, называемых лимфокинами, которые выделяются активированными Т-клетками (частью иммунной системы). Некоторые из этих веществ мощно активируют макрофагальную систему, и в течение нескольких часов макрофаги начинают уничтожать поврежденные ткани. Но иногда макрофаги повреждают еще живые тканевые клетки.
б) «Ограждающий» эффект воспаления. Одним из первых результатов воспаления является «ограждение» области повреждения от остальных тканей. Тканевые пространства и лимфатические сосуды в воспаленной области блокируются сгустками фибрина, поэтому через небольшой промежуток времени жидкость с трудом протекает через интерстиций. Этот процесс отгораживания задерживает распространение бактерий или токсических продуктов.
Интенсивность воспалительного процесса обычно пропорциональна степени повреждения ткани. Например, когда стафилококки проникают в ткани, они выделяют смертельно опасные клеточные токсины. В результате воспаление развивается быстро, гораздо быстрее, чем сами стафилококки могут размножиться и распространиться. Следовательно, для локальной стафилококковой инфекции характерно быстрое отгораживание, предохраняющее от распространения ее по телу.
Стрептококки, напротив, не вызывают такого интенсивного локального разрушения тканей. Следовательно, процесс отгораживания развивается медленно, на протяжении многих часов, в течение которых стрептококки успевают размножиться и мигрировать. В результате стрептококки часто проявляют гораздо более выраженную тенденцию к распространению в организме и развитию смертельных состояний, чем стафилококки, несмотря на то, что стафилококки гораздо более губительны для тканей.
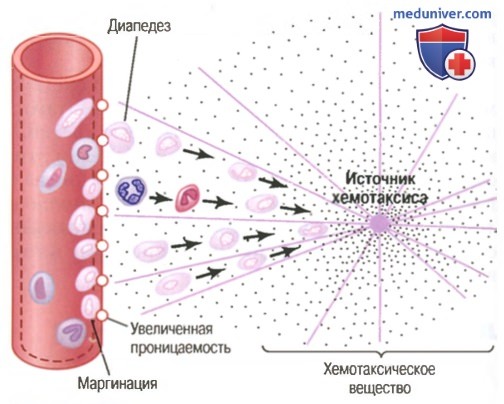
Движение нейтрофилов путем диапедеза через поры капилляров и путем хемотаксиса по направлению к области повреждения ткани
Реакции макрофагов и нейтрофилов во время воспаления
а) Тканевые макрофаги — первая «линия обороны» против инфекции. Тканевые макрофаги — первая «линия обороны» против инфекции. В течение нескольких минут после начала воспаления макрофаги, уже присутствующие в тканях, немедленно начинают свое фагоцитарное действие, будь то гистиоциты в подкожных тканях, альвеолярные макрофаги в легких, микроглия в мозге или др. При активации продуктами инфицирования и воспаления первым эффектом является быстрое увеличение каждого из макрофагов.
Затем многие из ранее неподвижных макрофагов отделяются от мест их прикрепления и становятся мобильными, формируя первую «линию обороны» против инфекции в течение примерно первого часа. Количество этих рано мобилизуемых макрофагов часто незначительно, но они спасают жизнь.
б) Вторжение нейтрофилов в воспаленную область является второй «линией обороны». В течение примерно первого часа после начала воспаления большое число нейтрофилов начинает внедряться в воспаленную область из крови. Этот процесс вызывается продуктами воспаленных тканей, которые инициируют следующие реакции:
(1) изменяют внутреннюю поверхность эндотелия капилляров, способствуя прилипанию нейтрофилов к стенкам капилляров в воспаленной области. Этот эффект, показанный на рисунке выше, называют маргинацией (или краевым стоянием лейкоцитов),
(2) ведут к разрыхлению сцеплений между эндотелиальными клетками капилляров и небольших венул, обеспечивая появление достаточно больших отверстий для прохождения нейтрофилов путем диапедеза непосредственно из крови в тканевые пространства;
(3) другие продукты воспаления вызывают хемотаксис нейтрофилов в направлении поврежденных тканей, как объяснялось ранее.
Таким образом, в течение нескольких часов после начала повреждения тканей область обильно заполняется нейтрофилами. Поскольку нейтрофилы крови — уже зрелые клетки, они готовы немедленно начать свои очистительные функции для уничтожения бактерий и удаления инородного материала.
— Также рекомендуем «Нейтрофилия. Защитные механизмы воспаления»
Оглавление темы «Клетки иммунитета. Виды иммунитета»:
1. Ретикулоэндотелиальная система. Макрофаги в лимфатических узлах
2. Альвеолярные макрофаги в легких. Клетки Купфера печени
3. Эффекты воспаления. Макрофаги и нейтрофилы при воспалении
4. Нейтрофилия. Защитные механизмы воспаления
5. Образование гноя. Эозинофилы и базофилы
6. Лейкопения. Лейкемии и его типы
7. Врожденный иммунитет. Приобретенный или адаптивный иммунитет
8. Типы приобретенного иммунитета. Лимфоциты в приобретенном иммунитете
9. Длительность жизни белых клеток крови. Нейтрофилы и макрофаги
10. Роль лимфоцитарных клонов. Происхождение клонов лимфоцитов
Нейтрофилия. Защитные механизмы воспаления
а) Резкое увеличение количества нейтрофилов в крови — нейтрофилия. В течение нескольких часов после начала острого, тяжелого воспаления количество нейтрофилов в крови возрастает иногда в 4-5 раз, т.е. от нормального количества 4000-5000 до 15000-25000 нейтрофилов в 1 мкл. Это состояние называют нейтрофилией, что означает увеличение количества нейтрофилов в крови.
Нейтрофилия вызывается продуктами воспаления, которые входят в кровоток, транспортируются к костному мозгу и там действуют на резервные нейтрофилы костного мозга, заставляя их выходить в циркулирующую кровь. Это обеспечивает возможность доставки еще большего числа нейтрофилов в воспаленную тканевую область.
б) Вторичная инвазия макрофагов в воспаленную ткань является третьей «линией обороны». Вместе с инвазией нейтрофилов моноциты поступают из крови в воспаленную ткань и увеличиваются, становясь макрофагами. Однако количество моноцитов в циркулирующей крови низкое; запас моноцитов в костном мозге также гораздо меньший, чем запас нейтрофилов. Следовательно, увеличение количества макрофагов в воспаленной ткани происходит значительно медленнее, чем нейтрофилов, и требует нескольких дней, чтобы стать эффективным.
Более того, даже после внедрения в воспаленную ткань моноциты являются еще незрелыми клетками, и нужно 8 ч или более для разбухания их до значительных размеров и развития громадного количества лизосом; только тогда они приобретают характерную для тканевых макрофагов высокую способность к фагоцитозу. Однако на протяжении периода от нескольких дней до нескольких недель макрофаги становятся преобладающими фагоцитарными клетками воспаленной области из-за значительного увеличения продукции новых моноцитов костным мозгом, что будет объяснено далее.
Как уже подчеркивалось, в сравнении с нейтрофилами макрофаги могут фагоцитировать гораздо больше бактерий (примерно в 5 раз) и значительно более крупные частицы, включая даже сами нейтрофилы и большое количество некротизированной ткани. Кроме того, макрофаги играют важную роль в инициации развития антител.
в) Увеличение продукции гранулоцитов и моноцитов костным мозгом является четвертой «линией обороны». Это происходит в связи со стимуляцией гранулоцитарных и моноцитарных клеток-предшественников костного мозга. Однако требуются 3-4 сут, прежде чем вновь сформированные гранулоциты и моноциты достигнут стадии, когда они покидают костный мозг. Если стимул из воспаленной ткани продолжает действовать, костный мозг может непрерывно производить эти клетки в огромных количествах в течение нескольких месяцев и даже лет, иногда со скоростью, в 20—50 раз превышающей норму.

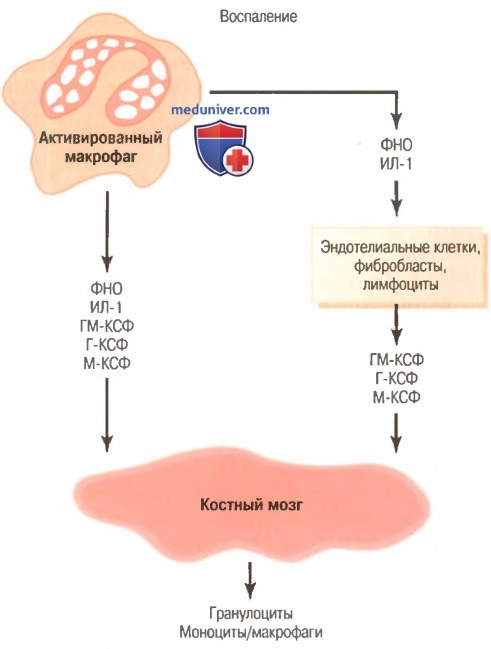
Регуляция формирования гранулоцитов и моноцитов-макрофагов костным мозгом с помощью множества факторов роста, выделяемых из активированных макрофагов в воспаленной ткани.
Г-КСФ — гранулоцитарный колониестимулирующий фактор, ГМ-КСФ — гранулоцитарно-моноцитарный колониестимулирующий фактор,
ИЛ-1 — интерлейкин-1, М-КСФ — моноритарный колониестимулирующий фактор,
ФНО — фактор некроза опухоли
г) Регуляция реакций макрофагов и нейтрофилов по принципу обратной связи. В настоящее время известно более двух дюжин факторов, участвующих в регуляции реакции макрофагов на воспаление, пять из них, как полагают, играют доминирующую роль. Они представлены на рисунке выше и включают:
(1) фактор некроза опухоли (ФНО);
(2) интерлейкин-1 (ИЛ-1);
(3) гранулоцитарно-моноцитарный колониестимулирующий фактор (ГМ-КСФ);
(4) гранулоцитарный колониестимулирующий фактор (Г-КСФ);
(5) моноцитарный колониестимулирующий фактор (М-КСФ).
Эти факторы формируются активированными макрофагальными клетками и в меньших количествах — другими клетками воспаленной ткани.
Основными стимуляторами увеличения продукции гранулоцитов и моноцитов костным мозгом являются три колониестимулирующих фактора, один из которых (ГМ-КСФ) повышает продукцию и гранулоцитов, и моноцитов; два других (Г-КСФ и М-КСФ) усиливают продукцию гранулоцитов и моноцитов, соответственно. Эта совокупность ФНО, ИЛ-1 и колониестимулирующих факторов обеспечивает мощный механизм обратной связи, который начинается с воспаления ткани и развивается до формирования большого количества защитных белых клеток крови, которые помогают удалять причину воспаления.
— Также рекомендуем «Образование гноя. Эозинофилы и базофилы»
Оглавление темы «Клетки иммунитета. Виды иммунитета»:
1. Ретикулоэндотелиальная система. Макрофаги в лимфатических узлах
2. Альвеолярные макрофаги в легких. Клетки Купфера печени
3. Эффекты воспаления. Макрофаги и нейтрофилы при воспалении
4. Нейтрофилия. Защитные механизмы воспаления
5. Образование гноя. Эозинофилы и базофилы
6. Лейкопения. Лейкемии и его типы
7. Врожденный иммунитет. Приобретенный или адаптивный иммунитет
8. Типы приобретенного иммунитета. Лимфоциты в приобретенном иммунитете
9. Длительность жизни белых клеток крови. Нейтрофилы и макрофаги
10. Роль лимфоцитарных клонов. Происхождение клонов лимфоцитов

