Роль перекисного окисления липидов при воспалении

Бронхиальная астма (БА) является глобальной проблемой здравоохранения. По оценкам ВОЗ, в мире около 300 млн. больных БА, при этом распространенность заболевания в разных странах мира колеблется от 1 до 18 % [1].
Согласно определению экспертов GINA (2014), БА — это гетерогенное заболевание, характеризующееся хроническим воспалением дыхательных путей и определяющееся историей респираторных симптомов (свистящие хрипы, кашель, заложенность в грудной клетке, одышка), которые сопровождаются вариабельной обструкцией дыхательных путей и варьируют по времени и интенсивности [2]. На современном этапе значительное внимание уделяется изучению патогенеза данного заболевания [3]. Воспаление дыхательных путей считается основной причиной повторяющихся эпизодов бронхиальной обструкции при БА, а активные формы кислорода играют ключевую роль в инициации и усилении воспалительного процесса в бронхах [4].
Существуют эндогенные (фагоцитирующие клетки, эндоплазматическтй ретикулум, пероксисомы, митохондрии и др.) и экзогенные (табачный дым, алкоголь, пестициды, тяжелые и переходные металлы, промышленное загрязнение, некоторые лекарственные препараты, радиация и др.) источники активных форм кислорода и азота. [5]. Повышенное образование свободных радикалов в сочетании с недостаточностью антиоксидантных систем приводит к развитию оксидативного стресса, который играет важную роль в развитии хронического воспаления при БА [6]. Оксиданты оказывают негативное влияние на различные классы биомолекул, инактивируют или модифицируют нуклеиновые кислоты, липиды, протеины [7]. Это связано с тем, что свободные радикалы быстро реагируют с ненасыщенными липидами мембран, способствуя образованию липидных перекисей, и окисляют восприимчивые группы белков и нуклеиновых кислот. [8]. Кроме того, активные формы кислорода и азота способствуют формированию дисбаланса в системе протеолиз-антипротеолиз, инактивируя антипротеазы [9].
Дисбаланс в оксидантно-антиоксидантной системе является фактором риска возникновения БА как у детей [10], так и у взрослых [11].
Оксиданты опосредуют множество процессов, способствующих развитию воспалительных изменений в легких (повреждение фибробластов, образование тромбоксана, снижение активности сурфактанта, ухудшение функции ресничек, повышение проницаемости эпителия) [12]. Дисбаланс в оксидантно-антиоксидантной системе приводит к возникновению следующих патофизиологических эффектов, связанных с БА: гиперсекреция слизи, повышение сосудистой проницаемости, сокращение гладкой мускулатуры [4], что обусловливает основные клинические проявления: воспаление, нарушение функции внешнего дыхания, вторичную эмфизему [8]. Кроме того, оксидативный стресс способствует десенситизации бета-адренорецепторов [7], а также формированию резистентности к глюкокортикостероидной терапии, которая обусловлена ремоделированием дыхательных путей [13]. По данным морфологических исследований легочной ткани, последствия дисбаланса в оксидантно-антиоксидантной системе связаны с гиперплазией интерстициальных клеток, гипертрофией и гиперплазией альвеолоцитов II типа, интерстициальным отеком, разрушением легочных капилляров [14]. Низкая активность антиоксидантных ферментов в сочетании с высоким уровнем свободных радикалов создает условия для рецидивирования воспаления [15].
Оксидативный стресс способствует персистенции воспалительного процесса в респираторном тракте, активируя клетки через механизмы сигнальной трансдукции и вызывая экспрессию генов цитокинов. Вследствие оксидативного стресса, ассоциированного с воспалением при бронхиальной астме, происходит активация транскрипционных факторов [16]. При этом увеличивается транскрипция генов фактора некроза опухоли-α, интерлейкинов-1, -6, -8. Цитокины способствуют нарушению баланса оксидантов/антиоксидантов, активизируют клетки воспаления [17].
При БА отмечается повышенное содержание малонового диальдегида, окиси азота, перекиси водорода [17], свободных радикалов и метгемоглобина на фоне снижения антиоксидантов (трансферрин и церулоплазмин, супероксиддисмутаза, каталаза) [18].
Установлено, что степень увеличения содержания липидных перекисей в мембранах эритроцитов зависит от интенсивности клинических симптомов БА [19], а общая антиоксидантная активность крови коррелирует с ОФВ1 [20]. Доказано, что интенсивность свободнорадикальных процессов отражает тяжесть клинических проявлений при БА, а в динамике позволяет оценить эффективность лечения [15].
В настоящее время важное значение имеют различные аспекты оптимизации терапии БА [21–31]. Применение антиоксидантов для усиления эндогенной антиоксидантной защиты или устранения избыточной продукции активных форм кислорода может быть использовано, чтобы ослабить или предотвратить воспалительную реакцию при БA [4]. Назначение антиоксидантных препаратов пациентам с бронхиальной астмой показано при недостаточной эффективности консервативной терапии, для профилактики сезонных обострений БА, лечения и профилактики острых респираторных инфекций, при наличии астматической триады. В качестве антиоксидантов применяются соединения селена, витамины С и Е, ацетилцистеин [32]. Показана клиническая эффективность лечения пациентов с БА при применении рутина, который, оказывая антиоксидантное действие, препятствует последующим патогенетическим этапам воспаления [15]. Антиоксидантным и мембраностабилизирующим свойством обладает деринат [33]. Отмечено повышение антиоксидантной активности (уровень церулоплазмина и активность каталазы) в период клинического выздоровления при использовании данного препарата в сочетании с базисной терапией БА [8]. В комплексном лечении БА применяется ацетилцистеин, антиоксидантное действие которого связано с наличием нуклеофильной тиоловой SH–группы, которая легко отдает водород, нейтрализуя свободные радикалы. Данный препарат способствует синтезу глутатиона — основной антиокислительной системы организма, что повышает защиту клеток от повреждающего воздействия свободнорадикального окисления, свойственного интенсивному воспалительному процессу [34]. Положительное воздействие на ферментативное и неферментативное звенья антиоксидантной защиты оказывает эмоксипин, что способствует уменьшению субъективных и объективных проявлений бронхиальной обструкции у больных БА [35]. По данным Фархутдинова У. Р. и соавт., применение в комплексной терапии антиоксиданта церулоплазмина способствует устранению нарушений свободнорадикального окисления, что позволяет оптимизировать терапию пациентов с БА [36].
Литература:
1. Глобальная стратегия лечения и профилактики бронхиальной астмы Global strategy for asthma management and prevention: пересмотр, 2011 г. / пер. с англ. / под ред. А. С. Белевский. М.: Российское респираторное общество, 2012. 108 с.
2. The Global Strategy for Asthma Management and Prevention, Global Initiative for Asthma (GINA) 2015. Available from: https://www.ginasthma.org/.
3. Будневский А. В. Системный подход к изучению психонейроиммунологических взаимодействий при бронхиальной астме // Системный анализ и управление в биомедицинских системах. 2005. Т. 4. № 1. С. 20–23.
4. Nadeem A, Masood A, Siddiqui N Oxidant-antioxidant imbalance in asthma: scientific evidence, epidemiological data and possible therapeutic options // Ther Adv Respir Dis. 2008. № 2(4). P.215–235.
5. Phaniendra A, Jestadi DB, Periyasamy L Free radicals: properties, sources, targets, and their implication in various diseases//Indian J Clin Biochem. 2015. № 30(1). P.11–26.
6. Al-Harbi NO et al. Oxidative airway inflammation leads to systemic and vascular oxidative stress in a murine model of allergic asthma// Int Immunopharmacol. 2015 № 26(1). Р. 237–245.
7. Nadeem A, Siddiqui N, Alharbi NO, Alharbi MM Airway and systemic oxidant-antioxidant dysregulation in asthma: a possible scenario of oxidants spill over from lung into blood // Pulm Pharmacol Ther. 2014. № 29(1). P. 31–40.
8. Ахвердиева Т. Б., Васькова Н. А., Герасимова Н. Г., Коваленко Е. Н., Зотова Л. В., Чернова О. В. «Деринат» в комплексной терапии бронхиальной астмы у детей. Режим доступа: https://rae.ru/forum2012/9/1724 (дата обращения 25.04.2015).
9. Соодаева С. К., Климанов И. А. Нарушения окислительного метаболизма при заболеваниях респираторного тракта и современные подходы к антиоксидантной терапии // АтмосферА. Пульмонология и аллергология. 2009. № 1. С. 34–38.
10. Bakkeheim E, Mowinckel P, Carlsen KH, Burney P, Carlsen KC. Altered oxidative state in schoolchildren with asthma and allergic rhinitis //Pediatr Allergy Immunol. 2011 № 22(2). Р.178–185.
11. Larkin EK et al. New risk factors for adult-onset incident asthma. A nested case-control study of host antioxidant defense // Am J Respir Crit Care Med. 2015 № 191(1). P. 45–53.
12. Adam W. DNA and 2′-deoxyguanosine damage in the horseradish-peroxidase-catalyzed autoxidation of aldehydes: the search for the oxidizing species // Free Radic. Biol. Med. 1999. V.26, № 5–6. P.566–579.
13. Sartorelli C. F., Rehder J., Neto A. C. et al. Assessment of inflammation based on the release of oxygen radicals by granulocytes in chronic uncontrolled asthma // J. Pediatr. (Rio J). 2009. № 85(2). P. 143–148.
14. Levine SA, Reinhardt JH. Biochemical pathology initiated by free radicals, oxidant chemicals and therapeutic drugs in the etiology of chemical hypersensitivity diseases // Orthomol Psychiatry. 1983. № 12. P. 166–183.
15. Новиков Ю. К. Свободнорадикальное воспаление и антирадикальная защита у больных бронхиальной астмой // Русский мед. журнал. 1997. Т.5. № 17. С. 27–31.
16. Barnes, P. J. Transcription factors in airway diseases // Lab. Invest. 2006. V.86, № 9. Р. 867–872.
17. Латышева А. Н., Смирнова С. В., Колпакова А. Ф. Бронхиальная астма и хроническая обструктивная болезнь легких: особенности системы оксидант-антиоксидант. Красноярск: Издательство КраГМУ; 2011. — 110 с.
18. Колпакова А. Ф. Влияние комбинированной терапии отечественными ингаляционными противоастматическими препаратами на оксидантно-антиоксидантный статус больных бронхиальной астмой// Терапевтический архив. 2007. № 3. С. 41–44.
19. Аматуни В. Г., Карагезян К. Г., Сафарян М. Д. Роль перекисного окисления липидов мембран (ПОЛ) и антирадикальной защиты в патогенезе бронхиальной астмы// Терапевтический архив. — 1980. — № 3.- С.96–100.
20. Yoon S. Y., Kim T. B., Baek S., Kim S., Kwon H. S., Lee Y. S. et al. The impact of total antioxidant capacity on pulmonary function in asthma patients // Int. J. Tuberc. Lung Dis. 2012. № 16(11). P.1544–1550.
21. Будневский А. В. Оптимизация терапии бронхиальной астмы: психосоматические аспекты // Системный анализ и управление в биомедицинских системах. 2005. Т. 4. № 2. С. 152–154.
22. Будневский А. В., Бурлачук В. Т., Олышева И. А. Терапевтические подходы к контролю воспаления на уровне мелких бронхов при бронхиальной астме // Российский аллергологический журнал. 2010. № 4. С. 85–94.
23. Будневский А. В., Трибунцева Л. В., Разворотнев А. В. Системный подход к анализу эффективности вакцинации больных бронхиальной астмой в муниципальном районе // Вестник новых медицинских технологий. 2013. Т. 20. № 1. С. 53–55.
24. Будневский А. В., Бурлачук В. Т., Разворотнев А. В. и др. Оптимизация лечебно-профилактической помощи больным бронхиальной астмой, проживающим в сельской местности // Системный анализ и управление в биомедицинских системах. 2012.- Т. 11, № 1. С. 9–11.
25. Гамазина М. В., Будневский А. В. Клиническая эффективность комплексной реабилитационной программы у больных бронхиальной астмой с сопутствующей язвенной болезнью желудка и (или) двенадцатиперстной кишки // Научно-медицинский вестник Центрального Черноземья. 2008. № 32. С. 33–39.
26. Ермолова А. В., Будневский А. В. Бронхиальная астма и метаболический синдром: возможности достижения контроля над заболеванием и улучшения качества жизни // Врач-аспирант. 2013. Т. 61. № 6.2. С. 319–325.
27. Олышева И. А., Бурлачук В. Т., Будневский А. В. и др. Немедикаментозные методы терапии в достижении контроля бронхиальной астмы // Справочник врача общей практики. 2014. № 2. С. 45.
28. Провоторов В. М., Будневский А. В. Психологические аспекты организации и проведения занятий в «астма-школе» // Пульмонология. 2000. № 4. С. 63–67.
29. Каменюк Е. В., Будневский А. В., Разворотнев А. В. и др. Системный подход к управлению лечебно-диагностическим процессом при бронхиальной астме // Вестник новых медицинских технологий. 2012. № 3. С. 83–84.
30. Трибунцева Л. В., Будневский А. В., Разворотнев А. В. Системный подход к управлению терапией больных бронхиальной астмой // Врач-аспирант. 2012. № 1.2 (5). С.338.-342.
31. Будневский А. В. Возможности контроля над бронхиальной астмой: роль малых дыхательных путей / А. В. Будневский, В. Т. Бурлачук, И. А. Олышева, Е. В. Токмачев // Пульмонология. 2011. № 2. С. 101–108.
32. Лечение клинико-патогенетических вариантов бронхиальной астмы. Available at: https://genmed.ru/med_b2_83_03.html
33. Деринат. Available at: https://evropharm.ru/products/derinat-1–5-percent-5ml-amp-h-5.aspx
34. Зайцева О. В. Рациональный выбор муколитической терапии в лечении болезней органов дыхания у детей // Русский медицинский журнал. 2009. Т. 17. № 19. С. 1217–1222.
35. Лапик С. В., Жмуров В. А., Попова Т. В. Эмоксипин в лечении бронхиальной астмы. Пульмонология. 2000. № 1. С. 62–65.
36. Фархутдинов У. Р., Фархутдинов Ш. У. Эффективность церулоплазмина у больных бронхиальной астмой // Терапевтический архив. 2012. № 12. С. 45–48.
Основные термины (генерируются автоматически): активная форма кислорода, бронхиальная астма, оксидантно-антиоксидантная система, GINA, антиоксидантное действие, бронхиальная обструкция, воспалительный процесс, хроническое воспаление.
Причины воспаления пародонта. Перекисное окисление липидов (ПОЛ) и его роль
Лейкоциты, адгезировавшиеся на эндотелии сосудов, начинают генерировать целый ряд цитотоксических соединений, что приводит к образованию свободных радикалов. Все эти соединения разрушают эндотелий, увеличивая его проницаемость. Последнее непосредственно приводит к периваскулярному отеку, способствуя тяжелым ишемическим расстройствам в тканях.
Происходящее вследствие первичного воспалительного ответа ухудшение трофики тканей пародонта, в свою очередь, вызывает еще большее нарушение кислородного питания тканей и изменение энергетического процесса, обеспечивающего жизнеспособность клеток. Ухудшение микроциркуляции при пародонтите усугубляется тем, что ПОЛ снижает антиагрегационную способность тканей пародонта. Образуются лейкоцитарно-тромбоцитарные агрегаты, которые блокируют микроциркуляторное русло, включая даже относительно крупные артериолы. Это усугубляет ишемию тканей, способствует дальнейшему развитию отека.
В результате накопления высокотоксичных продуктов в основном веществе и всех структурах соединительной ткани нарастает кислотность среды, нарушается созревание остеобластов и активируется функция остеокластов.
В здоровом организме соотношение между свободнорадикальным окислением и антиоксидантной защитой оптимальное. Хроническое течение ВЗП и нарастающие при этом гипоксия и поражение ферментных систем клеток способствуют постепенному падению антиоксидантной активности тканей — фактически последнего наиболее устойчивого механизма защиты.
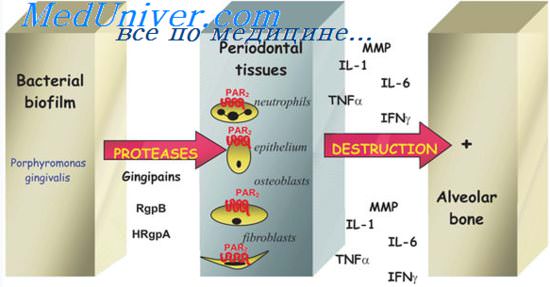
При заболеваниях пародонта необходима оптимизация взаимодействия свободнорадикального окисления и антиоксидантной защиты. Поэтому при профилактике пародонтита патогенетически обосновано применение антиоксидантов и антигипоксантов: токоферол, аскорбиновая кислота, мексидол, которые ингибируют свободнорадикальное окисление.
Перекисное окисление липидов (ПОЛ) — это свободнорадикальный процесс, протекающий на полиненасыщенных жирных кислотах с образованием активных форм кислорода.
Источники активных форм кислорода:
• оксидантные реакции;
• оксигеназные реакции;
• комплексирование кислорода;
• образование синглетного кислорода;
• образование активных форм кислорода фагоцитирующими клетками;
• реакция аутоокисления гемоглобина;
• реакция протеолиза;
• окисление эндогенных катехоламинов. Наиболее активные формы радикалов кислорода:
• супероксидный анионрадикал 02;
• перекись водорода;
• гидроксильный радикал ОН.
АОС — это весь комплекс процессов, включающих систему генерации радикалов кислорода и липидных гидроперекисей.
Состояние процессов свободнорадикального окисления липидов в ротовой жидкости и десневой крови оценивают по активности АОС и ПОЛ. Скрининговым методом для оценки состояния процессов ПОЛ и АОС является индуцированная биохемилюминесценция, при которой происходит каталитическое разложение перекиси водорода ионами металла с переменной валентностью — двухвалентного железа.
Данные биохемилюминесцентного анализа продемонстрировали, что показатели антиоксидантной активности не зависят от степени тяжести заболевания, но имеют сильную зависимость от активности процессов воспаления в пародонте. Так, у большинства пациентов с хроническим генерализованным пародонтитом показатели антиоксидантной активности находились в пределах нормы, тогда как у лиц с БПП были снижены. Это свидетельствует об истощении АОС при длительных активных воспалительно-деструктивных процессах в тканях пародонта.
— Также рекомендуем «Фосфатидилинозиты. Влияние и обмен фосфатидилинозитов»
Оглавление темы «Диагностика и лечение воспалений парадонта»:
1. Причины воспаления пародонта. Перекисное окисление липидов (ПОЛ) и его роль
2. Фосфатидилинозиты. Влияние и обмен фосфатидилинозитов
3. Цитологическое исследование пародонта. Техника цитологии пародонта
4. Функциональное исследование пародонта. Реопародонтография
5. Лазерная допплеровская флоуметрия (ЛДФ). Оценка кровотока в пародонте
6. Допплерография пародонта. Ультразвуковая остеометрия — эхоостеометрия
7. Прогнозирование течения пародонтита. Прогноз лечения воспаления пародонта
8. Начальное лечение заболеваний пародонта. Виды местной анестезии в стоматологии
9. Антибиотики при лечении парадонтита. Производные имидазола при парадонтите
10. Антисептики при парадонтите. Местное лечение парадонтита
РАЗДЕЛ 8. ОБМЕН ЛИПИДОВ
VII. Перекисное окисление липидов, роль в патогенезе повреждений клетки
Кислород, необходимый организму для функционирования ЦПЭ и многих других реакций, является одновременно и токсическим веществом, если из него образуются так называемые активные формы.
К активным формам кислорода относят:
ОН• — гидроксильный радикал;
О2• — супероксидный анион;
Н2O2 — пероксид водорода.
Активные формы кислорода образуются во многих клетках в результате последовательного одноэлектронного присоединения 4 электронов к 1 молекуле кислорода. Конечный продукт этих реакций — вода, но по ходу реакций образуются химически активные формы кислорода. Наиболее активен гидроксильный радикал, взаимодействующий с большинством органических молекул. Он отнимает от них электрон и инициирует таким образом цепные реакции окисления. Эти свободнорадикальные реакции окисления могут выполнять полезные функции, например, когда клетки белой крови с участием активных форм кислорода разрушают фагоцитированные клетки бактерий. Но в остальных клетках свободнорадикальное окисление приводит к разрушению органических молекул, в первую очередь липидов, и, соответственно, мембранных структур клеток, что часто заканчивается их гибелью. Поэтому в организме функционирует эффективная система ингибирования перекисного окисления липидов (ПОЛ).
А. Источники активных форм кислорода
ЦПЭ как источник активных форм кислорода
Утечка электронов из ЦПЭ и непосредственное их взаимодействие с кислородом — основной путь образования активных форм кислорода в большинстве клеток.
Кофермент Q в ЦПЭ принимает от доноров последовательно по одному электрону, превращаясь в форму семихинона (рис. 8-55) — КоQН• (см. раздел 6).
Этот радикал может непосредственно взаимодействовать с кислородом, образуя супероксидный анион О2•, который, в свою очередь, может превращаться в другие активные формы кислорода:
![]()
Рис. 8-55. Реакции последовательного восстановления убихинона в дыхательной цепи.

Реакции, катализируемые оксидазами и оксигеназами
Многие оксидазы — ферменты, непосредственно восстанавливающие кислород, образуют пероксид водорода — Н2O2. Оксидазы образуют пероксид водорода по схеме:
O2 + SН2 —> S + Н2O2, где SН2 — окисляемый субстрат.
Примеры таких оксидаз — оксидазы аминокислот, супероксид дисмутаза, оксидазы, локализованные в пероксисомах. Оксидазы пероксисом окисляют, в частности, жирные кислоты с очень длинной углеродной цепью (более 20 углеродных атомов) до более коротких, которые далее подвергаются β-окислению в митохондриях.
Монооксигеназы, например, цитохром Р450, включающий один атом кислорода в окисляемую молекулу, и диоксигеназы, включающие оба атома кислорода, также служат источниками активных форм кислорода.
Пероксид водорода химически не очень активен, но способствует образованию наиболее токсичной формы кислорода — гидроксильного радикала (ОН•) по следующей реакции:
Fе2+ + Н2O2 —>Fе3+ + ОН- + ОН•.
Наличие в клетках Fе2+ или ионов других переходных металлов увеличивает скорость образования гидроксильных радикалов и других активных форм кислорода. Например, в эритроцитах окисление иона железа гемоглобина способствует образованию супероксидного аниона.
Б. Перекисное окисление липидов
Реакции перекисного окисления липидов (ПОЛ) являются свободнорадикальными и постоянно происходят в организме. Свободнорадикальное окисление нарушает структуру многих молекул. В белках окисляются некоторые аминокислоты. В результате разрушается структура белков, между ними образуются ковалентные «сшивки», всё это активирует протеолитические ферменты в клетке, гидролизующие повреждённые белки. Активные формы кислорода легко нарушают и структуру ДНК. Неспецифическое связывание Fе2+молекулой ДНК облегчает образование гидроксильных радикалов, которые разрушают структуру азотистых оснований. Но наиболее подвержены действию активных форм кислорода жирные кислоты, содержащие двойные связи, расположенные через СН2-группу. Именно от этой СН2-группы свободный радикал (инициатор окисления) легко отнимает электрон, превращая липид, содержащий эту кислоту, в свободный радикал.
ПОЛ — цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее распространение перекисного окисления.
Стадии перекисного окисления липидов
1) Инициация: образование свободного радикала (L•)

Инициирует реакцию чаще всего гидроксильный радикал, отнимающий водород от СН2-групп полиеновой кислоты, что приводит к образованию липидного радикала.
2) Развитие цепи:
![]()
Развитие цепи происходит при присоединении O2, в результате чего образуется липопероксирадикал LOO• или пероксид липида LOOH.
ПОЛ представляет собой свободнорадикальные цепные реакции, т.е. каждый образовавшийся радикал инициирует образование нескольких других.
3) Разрушение структуры липидов

Конечные продукты перекисного окисления полиеновых кислот — малоновый диальдегид и гидропероксид кислоты.
4) Обрыв цепи — взаимодействие радикалов между собой:

Развитие цепи может останавливаться при взаимодействии свободных радикалов между собой или при взаимодействии с различными антиоксидантами, например, витамином Е, который отдаёт электроны, превращаясь при этом в стабильную окисленную форму.
В. Повреждение клеток в результате перекисного окисления липидов
Активные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон за счёт образования гидропероксидов жирных кислот в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. Активация перекисного окисления характерна для многих заболеваний: дистрофии мышц (болезнь Дюшенна), болезни Паркинсона, при которых ПОЛ разрушает нервные клетки в стволовой части мозга, при атеросклерозе, развитии опухолей. Перекисное окисление активируется также в тканях, подвергшихся сначала ишемии, а затем реоксигенации, что происходит, например, при спазме коронарных артерий и последующем их расширении.
Такая же ситуация возникает при образовании тромба в сосуде, питающем миокард. Формирование тромба приводит к окклюзии просвета сосуда и развитию ишемии в соответствующем участке миокарда (гипоксия ткани). Если принять быстрые лечебные меры по разрушению тромба, то в ткани восстанавливается снабжение кислородом (реоксигенация). Показано, что в момент реоксигенации резко возрастает образование активных форм кислорода, которые могут повреждать клетку. Таким образом, даже несмотря на быстрое восстановление кровообращения, в соответствующем участке миокарда происходит повреждение клеток за счёт активации перекисного окисления.
Изменение структуры тканей в результате ПОЛ можно наблюдать на коже: с возрастом увеличивается количество пигментных пятен на коже, особенно на дорсальной поверхности ладоней. Этот пигмент называют липофусцин, представляющий собой смесь липидов и белков, связанных между собой поперечными ковалентными связями и денатурированными в результате взаимодействия с химически активными группами продуктов ПОЛ. Этот пигмент фагоцитируется, но не гидролизуется ферментами лизосом, и поэтому накапливается в клетках, нарушая их функции.
ПОЛ происходит не только в живых организмах, но и в продуктах питания, особенно при неправильном приготовлении и хранении пищи. Прогоркание жиров, образование более тёмного слоя на поверхности сливочного масла, появление специфического запаха у молочных продуктов — всё это признаки ПОЛ. В продукты питания, содержащие ненасыщенные липиды, обычно добавляют антиоксиданты — вещества, ингибирующие ПОЛ и сохраняющие структуру компонентов пищи.
Г. Системы защиты клеток от активных форм кислорода
Ферменты антиоксидантного действия
К ферментам, защищающим клетки от действия активных форм кислорода, относят супероксиддисмутазу, каталазу и глутатионпероксидазу. Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450 и пероксисом особенно велико. Супероксиддисмутаза (СОД) превращает супероксидные анионы в пероксид водорода:
2 О2• + 2 Н+ —> Н2О2 + О2.
Изоферменты СОД находятся и в цитозоле и в митохондриях и являются как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода при утечке электронов из дыхательной цепи.
СОД — ицдуцируемый фермент, т. е. синтез его увеличивается, если в клетках активируется перекисное окисление.
Пероксид водорода, который может инициировать образование самой активной формы ОН•, разрушается ферментом каталазой:
2 Н2О2 —> 2 Н2О + О2.
Каталаза находится в основном в пероксисомах, где образуется наибольшее количество пероксида водорода, а также в лейкоцитах, где она защищает клетки от последствий «респираторного взрыва» (см. раздел 6).
Глутатионпероксидаза — важнейший фермент, обеспечивающий инактивацию активных форм кислорода, так как он разрушает и пероксид водорода и гидропероксиды липидов. Он катализирует восстановление пероксидов с помощью трипептида глутатиона (y-глутамилцистеинилглицин). Сульфгидрильная группа глутатиона (GSН) служит донором электронов и, окисляясь, образует дисульфидную форму глутатиона, в которой 2 молекулы глутатиона связаны через дисульфидную группу.
Н2O2 + 2 GSH —> 2 Н2O + G-S-S-G.
Окисленный глутатион восстанавливается глутатионредуктазой:
GS-SG + NADPH + Н+ —> 2 GSH + NADP+.
Глутатионпероксидаза, которая восстанавливает гидропероксиды липидов в составе мембран, в качестве кофермента использует селен (необходимый микроэлемент пищи). При его недостатке активность антиоксидантной защиты снижается.
Витамины, обладающие антиоксидантным действием
Витамин Е (α-токоферол) — наиболее распространённый антиоксидант в природе — является липофильной молекулой, способной инактивировать свободные радикалы непосредственно в гидрофобном слое мембран и таким образом предотвращать развитие цепи перекисного окисления. Различают 8 типов токоферолов, но α-токоферол наиболее активен.
Витамин Е отдаёт атом водорода свободному радикалу пероксида липида (ROO•), восстанавливая его до гидропероксида (ROOH) и таким образом останавливает развитие ПОЛ (рис. 8-56).
Рис. 8-56. Механизм антиоксидантного действия витамина Е. Витамин Е (α-токофероп) ингибирует свободнорадикальное окисление путём отдачи электрона, что приводит к инактивации радикала липида, а витамин Е превращается в стабильный, полностью окисленный токоферолхинон.

Свободный радикал витамина Е, образовавшийся в результате реакции, стабилен и не способен участвовать в развитии цепи. Наоборот, радикал витамина Е непосредственно взаимодействует с радикалами липидных перекисей, восстанавливая их, а сам превращается в стабильную окисленную форму — токоферолхинон.
Витамин С (аскорбиновая кислота) также является антиоксидантом и участвует с помощью двух различных механизмов в ингибировании ПОЛ. Во-первых, витамин С восстанавливает окисленную форму витамина Е и таким образом поддерживает необходимую концентрацию этого антиоксиданта непосредственно в мембранах клеток. Во-вторых, витамин С, будучи водорастворимым витамином и сильным восстановителем, взаимодействует с водорастворимыми активными формами кислорода — O2•, Н2O2, ОН• и инактивирует их.
β-Каротин, предшественник витамина А, также обладает антиоксидантным действием и ингибирует ПОЛ. Показано, что растительная диета, обогащённая витаминами Е, С, каротиноидами, существенно уменьшает риск развития атеросклероза и заболеваний ССС, подавляет развитие катаракты — помутнения хрусталика глаза, обладает антиканцерогенным действием. Имеется много доказательств в пользу того, что положительное действие этих компонентов пищи связано с ингибированием ПОЛ и других молекул и, следовательно, с поддержанием нормальной структуры компонентов клеток.
