Схема развития процесса воспаления
Воспаление — это защитная реакция организма и его тканей в ответ на повреждение. Цель этой реакции заключается в восстановлении поврежденной ткани или ограничении этого повреждения, а также в удалении повреждающего фактора, например бактерий или чужеродных частиц.
Причинами воспаления могут быть: микроорганизмы: бактерии, вирусы, грибы или паразиты; чужеродные частицы (чужеродные белки, например пыльца; частицы асбеста или кристаллы кремния); разрушение ткани с образованием продуктов ее распада, например, в результате механических травм (порезов, колотых ран, ссадин или попадания инородных тел), действия химических веществ, таких как кислоты или щелочи, физических факторов (холода, тепла, излучения [ультрафиолетового, рентгеновского, радиоактивного]); эндогенные причины — распад опухолевых клеток, кровоизлияния, аутоиммунные реакции или кристаллы веществ, выпадающих в осадок в организме (мочевая кислота, оксалаты кальция, фосфаты кальция и холестерин).
Острое воспаление само по себе проявляется как местная реакция с симптомами, известными еще с античных времен: боль (dolor), припухлость (tumor), покраснение (rubor) и жар (calor). Кроме того, воспаление может сопровождаться системными реакциями (ответ острой фазы воспаления).
Примером острой воспалительной реакции служит быстрая активация тучных клеток прроисходящая в тканях или их аналогов в крови, а также базофильных лейкоцитов, или базофилов. По этому механизму развиваются в основном реакции гиперчувствительности I типа.
Если организм ранее контактировал с антигеном (при развитии гиперчувствительности антиген называют аллергеном), например содержащимся в яде пчел, В-клетки уже будут сенсибилизированы к этому аллергену (в кооперации с Тh2-клетками). Образовавшиеся из В-клеток плазматические клетки выделяют IgE, который соединяется с Fcε-рецепторами тучных клеток. При повторном контакте с антигеном вновь образованные IgE связываются с антигеном своими Fab-фрагментами. Это играет важную роль для последующего взаимодействия тучных клеток с аллергеном, объединенным с несколькими молекулами IgE (связь с антителом), причем особенно эффективны крупные антигены, которые способны повторно взаимодействовать с различными частями молекул (поливалентность) (например, паразиты с несколькими связанными гаптенами).
Образование связи между антителами и антигеном запускает процесс высвобождения из тучных клеток вторичных мессенджеров (цГМФ, инозитолфосфата, ионов Са2+), которые вызывают быструю дегрануляцию тучных клеток, т. е. экзоцитоз с высвобождением медиаторов воспаления и хемокинов, депонированных в этих гранулах (гистамин. IL-8, эотаксин, фактор хемотаксиса нейтрофилов [NCF] и др.). Ионы Са2+ также активируют фосфолипазу А2, которая высвобождает из фосфолипидов клеточной мембраны арахидоновую кислоту. Это вещество служит субстратом для других важных медиаторов воспаления, а именно простагландинов (Е2 и др.) и лейкотрие-нов (С4, D4 и Е4, которые вместе называются медленно реагирующей субстанцией анафилаксии [SRS-A], а также лейкотриен В4). Из мембраны тучных клеток выделяется еще один важный медиатор воспаления и вещество, участвующее в реакциях гемостаза, -эфир фосфолипидной природы — фактор активации тромбоцитов (PAF).
При дальнейшем развитии воспалительной реакции из нейтрофилов, эозинофилов и макрофагов выделяются лейкотриены и PAF. Последний также высвобождается из тромбоцитов. Это усиливает воспалительную реакцию и обусловливает вовлечение системы гемостаза в процесс воспаления. Названные клетки вовлекаются в очаг воспаления хемокинами (хемотаксис). Эотаксин, PAF и лейкотриен В4 действуют на эозинофилы (и Th2-клетки) подобно хемоаттрактантам. В силу того, что PAF активирует и тучные клетки, эти два типа клеток действуют совместно.
Нейтрофилы и моноциты вовлекаются в очаг воспаления лейкотриеном В4, компонентом комплемента С5a, NCF, TNF-a, IL-1, И-4и некоторыми хемокинами, например IL-8.
Гистамин, PAF, лейкотриены С4, D4 и Е4 действуют совместно с остальными медиаторами (PGE2, брадикинином) и вызывают: 1) расширение сосудов (артериол), 2) повышение парацеллюлярной проницаемости эндотелия и 3) стимуляцию ноцицепторов.
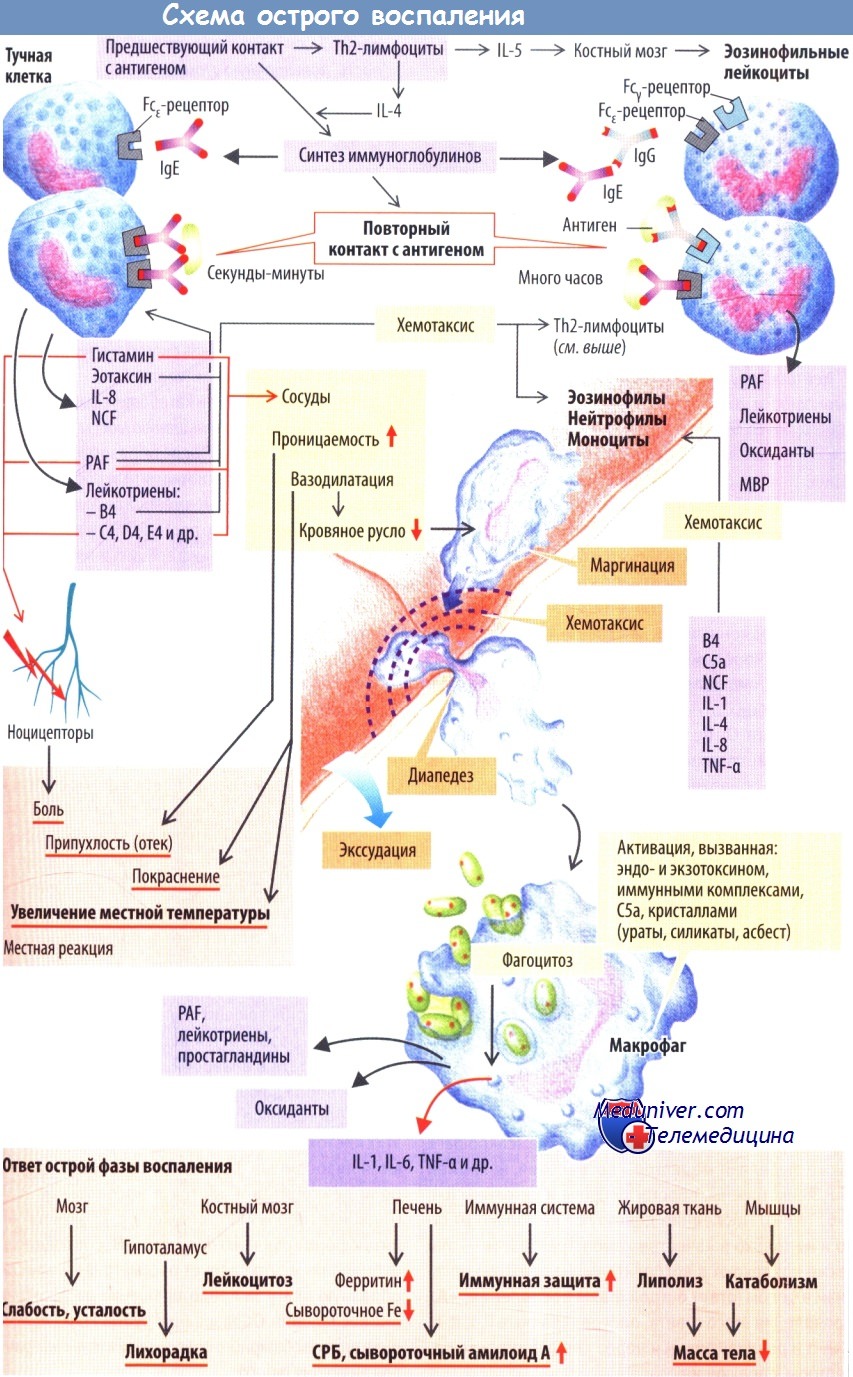
Расширение сосудов обусловливает покраснение воспаленной ткани и повышение ее температуры. Вазодилатация также приводит к замедлению кровотока, что дает возможность лейкоцитам после воздействия хемоаттрактантов перемещаться из осевого потока ближе к эндотелию. Эндотелиальные клетки, активированные в очаге воспаления различными веществами, в т. ч. IL-4 (из Th2-клеток), экспрессируют на своей поверхности, обращенной в просвет сосуда, селектины. Эти селектины, по сути являющиеся молекулами клеточной адгезии, вызывают перемещение лейкоцитов по поверхности эндотелия и активируют другие молекулы адгезии (интегрины, ICAM-1, VCAM).
Это дает возможность лейкоцитам прикрепляться к сосудистой стенке (маргинация). Увеличение проницаемости эндотелия (потеря контактов между эндотелиальными клетками) позволяет лейкоцитам выходить из сосудов во внесосудистое пространство (диапедез). Кроме того, в интерстициальное пространство выходит жидкость, содержащая большое количество белков (воспалительный экссудат), вследствие чего развивается отек. В тяжелых случаях из сосудов выходят даже эритроциты (геморрагическое воспаление). Наконец, возникает боль, вследствие которой человек осознает наличие патологического процесса и рефлекторно стремится защитить воспаленный участок (например, конечность).
Нейтрофилы, мигрировавшие в очаг воспаления, и макрофаги, дифференцировавшиеся из мигрировавших в этот очаг моноцитов, начинают фагоцитировать патогены, вызвавшие воспаление, и переваривать их с помощью лизосом. «Аппетит» фагоцитов усиливается после опсонизации патогенов IgG или компонентом комплемента СЗb.
При воспалении активируется также система комплемента. Это происходит либо классическим путем в присутствии комплексов антиген — антитело, либо более медленным, так называемым альтернативным путем через менее специфичное связывание с клетками, инфицированными бактериями или вирусами. В обоих случаях образуется С3b-компонент комплемента. Он не только опсонизирует антигены, ной вызывает полимеризацию других компонентов (С5—С9) на поверхности клеток, атакованных патогеном, с образованием мембраноатакующего комплекса, который запускает лизис патогена. Помимо этого система комплемента способна разрушать частицы вирусов и комплексы антиген — антитело. Побочные продукты активации системы комплемента (СЗа, С4а и С5а, так называемые анафилаксины) действуют в качестве хемоаттрактантов и активируют макрофаги.
Макрофаги активируются главным образом экзо- и эндотоксинами патогенов, комплексами антиген — антитело, С5а, различными кристаллами, а также при фагоцитозе. В результате их активации высвобождаются оксиданты, такие как О2-, ОН-, О2 и Н2О2, повреждающие патогены. Макрофаги также выделяют медиаторы воспаления, например PAF, лейкотриены, простагландины и цитокины IL-1, IL-6, TNF-α. Последние действуют не только мест-но и не только в качестве хемоаттрактантов — они также вовлекают в воспалительную реакцию организм в целом (ответ острой фазы воспаления). Проявления этого ответа, опосредованные IL-1, IL-6, TNF-a и реализующиеся через специфические рецепторы, следующие:
— воздействие на нейроны, ответственные за медленный сон, вызывает заторможенность, сонливость, повышенную утомляемость, усталость; — установочная точка терморегуляции смещается на более высокий уровень, развивается лихорадка;
— стимулируется высвобождение лейкоцитов из костного мозга с развитием лейкоцитоза; стимулируется функция печени, что проявляется усилением захвата гепатоцитами железа и образованием так называемых белков острой фазы (С-реактивный белок [СРБ] и сывороточный амилоид А);
— стимулируется иммунная система (в частности, усиливается выработка антител); запускаются липолиз и катаболические процессы, способствующие уменьшению массы тела. Заживление ткани. После образования грануляционной ткани, богатой клетками (макрофагами и др.) и характеризующейся выраженной васкуляризацией, тромбоцитарный фактор роста (PDGF) и другие медиаторы стимулируют пролиферацию и миграцию фибробластов.
Они продуцируют гликозаминогликаны, которые набухают и откладываются в ткани в виде коллагеновых волокон. Кроме того, образуются новые волокно коллагена, благодаря сокращению которых сближаются края раны.
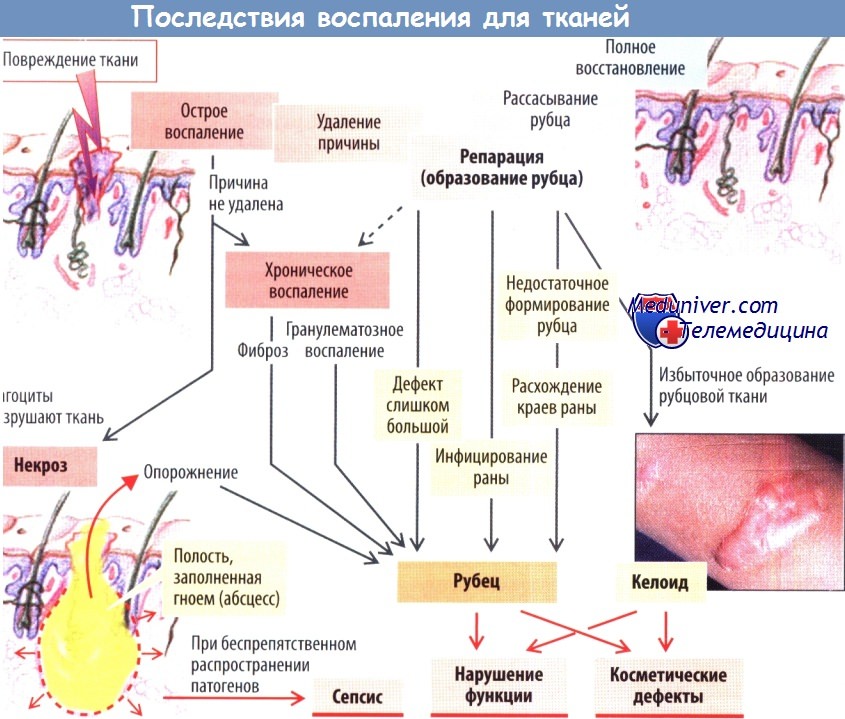
В итоге в месте повреждения коллагеновые волокна (рубец) замещаются новой тканью (от лат. restitutio ad integrum — полное восстановление). Однако такое замещение поврежденной ткани характерно лишь для небольших по размеру и неинфицированных ран. При наличии вторичного воспаления (обусловленного наличием инородных тел в ране или ее инфицированием) заживление раны затягивается во времени, усиливается защитный ответ макрофагов. Это требует дополнительной энергии (повышение температуры). Синхронно активированная система гемостаза способствует окклюзии сосудов в прилегающих областях; в результате недостатка О2 развивается дефицит АТФ; из-за накопления лактата в анаэробных условиях снижается pH. Высвобождающиеся оксиданты также повреждают собственные клетки организма.
При гибели этих клеток во внеклеточное пространство выделяются лизосомные ферменты, способствующие гибели лейкоцитов и клеток в воспаленной ткани. Подобная гибель клеток (некроз) может приводить к формированию абсцесса с последующий рубцеванием, что следует рассматривать как своеобразную плату за предотвращение распространения воспаления. Образование рубца также происходит в случае обширного повреждения ткани (например, при зияющих ранах).
Нарушения процесса заживления ран возникают в случае дисбаланса между процессами воспаления и заживления (при хроническом воспалении, например при бронхите курильщика или в случае алкогольного поражения печени). Образование слишком больших количеств коллагена вызывает фиброзирующее воспаление (в частности при циррозе печени). В случаях с избыточен образованием грануляционной ткани развивается гранулематозное воспаление (при туберкулезе, также при воспалении, вызванном инородными телами).
При дефектах качественных характеристик рубцовой тккани (например, в случае нарушения процесса синтеза коллагена поддействием глюкокортикоидов и образования поперечныхсвязей между волокнами коллагена при дефиците витамина С) локальное напряжение в области раны может способствовать ее повторному открытию (например, расхождение краев раны после абдоминальных хирургических вмешательств). Рубцы в области лица оставляют косметические дефекты, особенно при избыточном рубцевании (келоидные рубцы). В некоторых случаях рубцы могут вызывать серьезные функциональные расстройства: рубцы роговицы сопровождаются расстройствами зрения, рубцы в области клапанов сердца вызывают стенозы или регургитацию крови, рубцы в брюшной полости нередко бывают причиной спаечной болезни.
Если локализовать воспаление, вызванное патогенами, невозможно, они распространяются по всему организму, обычно по лимфатической системе, с развитием сепсиса. Такое происходит, например, при внезапном попадании патогенов на большую поверхность брюшины (при разрыве толстой кишки, вскрытии абсцесса).

— Рекомендуем ознакомиться со следующей статьей «Схема развития аллергии — рекции гиперчувствительности первого типа»
Оглавление темы «Патофизиология в схемах»:
- Схема развития мегалобластной анемии (В12-дефицитной анемии, анемии дефицита фолиевой кислоты)
- Схема развития анемии при нарушении синтеза гемоглобина
- Схема развития железодефицитной анемии
- Схема развития гемолитической анемии
- Схема организации иммунной системы человека
- Схема развития воспаления
- Схема развития аллергии — рекции гиперчувствительности первого типа
- Схема развития аллергической рекции второго типа (цитотоксического)
- Схема развития аллергической рекции третьего типа (иммунокомплексного)
- Схема развития аллергической рекции четвертого типа (замедленного)
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 30 июля 2020; проверки требуют 5 правок.
Воспаление (лат. inflammatio) — это комплексный, местный и общий патологический процесс, возникающий в ответ на повреждение (alteratio) или действие патогенного раздражителя и проявляющийся в реакциях, направленных на устранение продуктов, а если возможно, то и агентов повреждения (exudatio и др.) и приводящий к максимальному восстановлению в зоне повреждения (proliferatio).
Воспаление — защитно-приспособительный процесс.
Воспаление свойственно человеку и животным, в том числе низшим животным и одноклеточным организмам в упрощённом виде[1]. Механизм воспаления является общим для всех организмов, независимо от локализации, вида раздражителя и индивидуальных особенностей организма.
История[править | править код]
Уже в древние времена внешние признаки воспаления описал римский философ и врач Авл Корнелий Цельс (ок. 25 до н. э. — ок. 50 н. э.):
- лат. rubor — краснота (местное покраснение кожных покровов или слизистой).
- tumor — опухоль (отёк).
- calor — жар (повышение местной температуры).
- dolor — боль.
- functio laesa — нарушение функции.
В конце XIX столетия И. И. Мечников считал, что воспаление — это приспособительная и выработанная в ходе эволюции реакция организма и одним из важнейших её проявлений служит фагоцитоз микрофагами и макрофагами патогенных агентов и обеспечение таким образом выздоровления организма. Но репаративная функция воспаления была для И. И. Мечникова сокрыта. Подчеркивая защитный характер воспаления, он в то же время полагал, что целительная сила природы, которую и представляет собой воспалительная реакция, не есть еще приспособление, достигшее совершенства. По мнению И. И. Мечникова, доказательством этого являются частые болезни, сопровождающиеся воспалением, и случаи смерти от них[2].
Большой вклад в изучение воспаления внесли Джон Хантер (1728—1794), Франсуа Бруссе (1772—1838), Фридрих Густав Якоб Генле (1809—1885), Симон Самуэль (1833—1899), Юлиус Фридрих Конхайм (1839—1884), Алексей Сергеевич Шкляревский, (1839—1906), Рудольф Вирхов (1821—1902), Пауль Эрлих (1854—1915), Илья Ильич Мечников (1845—1916).
Этиология[править | править код]
Патогенные раздражители (повреждающие факторы) по своей природе могут быть:
- Физическим — травма (механическое повреждение целостности ткани), отморожение, термический ожог.
- Химическими — щелочи, кислоты (соляная кислота желудка), эфирные масла, раздражающие и токсические вещества (алкоголь (спирты) и некоторые лекарственные препараты[3], см. Токсические гепатиты).
- Биологическими — возбудители инфекционных заболеваний: животные паразиты, бактерии, вирусы, продукты их жизнедеятельности (экзо- и эндотоксины). Многие возбудители вызывают специфические воспаления, характерные только для определённого вида инфекции (туберкулёз, лепра, сифилис). К биологическим повреждающим факторам также относят иммунные комплексы, состоящие из антигена, антитела и комплемента, вызывающие иммунное воспаление (аллергия, аутоимунный тиреодит, ревматоидный артрит, системный васкулит). При аллергии не указан следующий механизм неинфекционного воспалительного ответа. Не берется во внимание, что любая аллергическая реакция приводит к повреждению тканей. Что при определенных условиях, когда происходит сенсибилизация организма больного (выработка иммуноглобулина Е) и прикрепление его на внутренней поверхности кровеносных сосудов будущих органов-мишеней, которые повреждаются аллергическими реакциями немедленного типа в результате выхода «медиаторов воспаления». (Аллергология и иммунология: национальное руководство под ред. Р.М. Хаитова, Н.И. Ильиной.- М. ГЭОТАР-МЕДИА, 2009.-656 с.- ISBN 978-5- 9704-0903-9/
Клиника и патогенез[править | править код]
Клинические симптомы воспаления:
- Покраснение (гиперемия).
- Местное повышение температуры (гипертермия).
- Отёк (ацидоз способствует диссоциации солей и распаду белков, что приводит к повышению осмотического и онкотического давления в повреждённых тканях, приводящему к отёкам).
- Боль.
- Нарушение функции.
Процесс воспаления делят на три основных стадии:
- Альтерация — повреждение клеток и тканей.
- Экссудация — выход жидкости и клеток крови из сосудов в ткани и органы.
- Пролиферация (или продуктивная стадия) — размножение клеток и разрастание ткани, в результате чего и происходит восстановление целостности ткани (репарация).
Альтерация[править | править код]
Альтерация (позднелат. alteratio, изменение[4]) — стадия начала воспаления. Патогенный раздражитель, воздействуя на ткани организма, вызывает первичную альтерацию — повреждение и последующий некроз клеток. Из лизосом погибших клеток (в том числе гранулоцитов) высвобождаются многочисленные ферменты (влияющие на белки и пептиды, липиды, углеводы, нуклеиновые кислоты), которые изменяют структуру и нарушают нормальный обмен веществ окружающей очаг воспаления соединительной ткани и сосудов (вторичная альтерация).
В зоне первичной альтерации интенсивность метаболизма снижена, так как функции клеток нарушены, а в зоне вторичной альтерации повышена, в основном за счёт обмена углеводов (в том числе гликолиза полисахаридов). Повышается потребление кислорода и выделение углекислоты, однако потребление кислорода превышает выделение углекислоты, так как окисление не всегда проходит до окончательного образования углекислого газа (нарушение цикла Кребса). Это приводит к накоплению в зоне воспаления недоокисленных продуктов обмена, имеющих кислую реакцию: молочной, пировиноградной, L-кетоглутаровой и др. кислот. Нормальный уровень кислотности ткани с pH 7,32—7,45 может повышаться до уровня 6,5—5,39 (при остром гнойном воспалении), возникает ацидоз[5].
На месте повреждения расширяются сосуды, вследствие чего увеличивается кровоснабжение, происходит замедление кровотока и как следствие — покраснение, местное повышение температуры, затем увеличение проницаемости стенки капилляров ведёт к выходу лейкоцитов, макрофагов и жидкой части крови (плазмы) в место повреждения — отёк, который в свою очередь сдавливая нервные окончания вызывает боль и всё вместе — нарушение функции. Воспаление регулируют медиаторы воспаления — гистамин, серотонин, непосредственное участие принимают цитокины — брадикинин, калликреин (см. Кинин-калликреиновая система), IL-1 и TNF, система свёртывания крови — фибрин, фактор Хагемана, система комплемента, клетки крови — лейкоциты, лимфоциты (Т и В) и макрофаги. В повреждённой ткани усиливаются процессы образования свободных радикалов.
Механизмы возникновения воспаления[править | править код]
Митохондриально-зависимый механизм[править | править код]
Из-за повреждения клеток при травме, митохондриальные белки и мтДНК попадают в кровоток. Далее эти митохондриальные молекулярные фрагменты (DAMPs) распознаются Толл-подобными (TLRs) и NLR рецепторами. Основным NLR-рецептором участвующим в процессе является рецептор NLRP3. В нормальном состоянии белки NLRP3 и ASC (цитозольный адаптерный белок) связаны с ЭПР, при этом белок NLRP3 находится комплексе с белком TXNIP. Активация рецепторов приводит к их перемещению в перинуклеарное пространство, где под действием активных форм кислорода, вырабатываемых поврежденными митохондриями, белок NLRP3 высвобождается из комплекса.[6] Он вызывает олигомеризацию белка NLRP3 и связывание ASC и прокаспазы-1, образуя формирование белкового комплекса называемого NLRP3 инфламмасомой. Инфламмасома вызывает созревание провоспалительных цитокинов, таких как IL-18 и IL-1beta и активирует каспазу-1. (3) Провоспалительные цитокины также могут запускать NF-kB пути воспаления, повышая длительность и уровень воспаления. Также для активации NLRP3 инфламмасомы необходима пониженная внутриклеточная концентрация K+, что обеспечивание калиевыми каналами митохондрий.
Механизм возникновения воспаления через NF-κB сигнальный путь[править | править код]
Классификация[править | править код]
По продолжительности:
- Острое воспаление — длится несколько минут или часов.
- Подострое — несколько дней или недель.
- Хроническое — длится от нескольких месяцев до пожизненного с моментами ремиссии и обострения.
По выраженности реакции организма:
- Нормоэргическое воспаление — адекватная реакция организма, соответствующая характеру и силе воздействия патогенного раздражителя.
- Гиперэргическое — значительно повышенная реакция.
- Гипоэргическое (от гипоэргия[4]) и аноэргическое — слабая или отсутствующая реакция (у пожилых людей (старше 60-ти), при недостаточном питании и авитаминозе[7], у ослабленных и истощённых людей).
По локализации:
- Местное воспаление — распространяется на ограниченный участок ткани или какой-либо орган.
- Системное — распространяется на какую-либо систему организма (систему соединительной ткани (ревматизм), сосудистую систему (системный васкулит)[7]).
Формы воспаления[править | править код]
- Альтеративное воспаление (в настоящее время отвергается)
- Экссудативное воспаление
- Серозное
- Фибринозное
- Дифтеритическое
- Крупозное
- Гнойное
- Гнилостное
- Геморрагическое
- Катаральное — с обильным выделением слизи или мокроты.
- Смешанное
- Пролиферативное воспаление
- Гранулематозное воспаление
- Межуточное (интерстициальное) воспаление
- Воспаление с образованием полипов и остроконечных кондилом
- Воспаление вокруг животных-паразитов и инородных тел (холангит, урертрит, киста)
- Специфическое воспаление — развивается при таких заболеваниях как туберкулёз, сифилис, лепра, сап, склерома[8].
Диагностика[править | править код]
Клинический анализ крови: увеличивается скорость оседания эритроцитов (СОЭ), лейкоцитоз, изменяется лейкоцитарная формула.
Биохимический анализ крови: при остром воспалении повышается количество C-реактивного белка (белок острой фазы), α- и β-глобулинов, при хроническом воспалении — γ-глобулинов; снижается содержание альбуминов[9].
Терминология[править | править код]
Термины воспалений чаще всего являются латинскими существительными третьего склонения греческого происхождения, состоящие из корневого терминоэлемента, обозначающего название органа, и суффикса -ītis (-ит). Примеры: gaster (греч. желудок) + -ītis = gastrītis (гастрит — воспаление слизистой желудка); nephros (греч. почка) + -ītis = nephrītis (нефрит)[10].
Исключения составляют устоявшиеся старые названия воспалительных заболеваний: пневмония (греч. pneumon, лёгкое), ангина — воспаление миндалин, панариций — воспаление ногтевого ложа пальца и др[1].
Так как воспаление — это естественная реакция здоровой ткани на повреждение, его не совсем уместно называть «патологическим» процессом. Термин «патологический» будет оправдано применять только к отклонениям от нормального протекания реакции защиты, которые не приводят к нужному конечному результату[11].
См. также[править | править код]
- Гомеостаз
- Инфламмасома
Примечания[править | править код]
- ↑ 1 2 Пауков, Хитров, 1989, с. 98.
- ↑ А.И. Струков, В.В. Серов. Патологическая Анатомия. — 5-е издание. — 2010. — С. 169. — 848 с. — ISBN 978-5-904090-63-0.
- ↑ Серов, Пауков, 1995, с. 506.
- ↑ 1 2 Советский энциклопедический словарь / Гл. ред. А.М. Прохоров. — 4-е изд. — М.: Советская энциклопедия, 1988. — 1600 с.
- ↑ Тель, Лысенков, 2007.
- ↑ Mitochondria: Sovereign of inflammation?.
- ↑ 1 2 Барышников, 2002, с. 58.
- ↑ Пауков, Хитров, 1989, с. 106—112.
- ↑ Пауков, Хитров, 1989, с. 105.
- ↑ Городкова Ю.И. Латинский язык. — М.: Кнорус, 2015. — С. 124—125. — 256 с.
- ↑ Шилов В. Н. (2006) Молекулярные механизмы структурного гомеостаза. Москва, издательство «Интерсигнал». 286 с., с. 238.
Литература[править | править код]
- Пальцев М. А., Аничков Н. М. Патологическая анатомия. Учебник для медицинских вузов (В 2 т.). — М.: Медицина, 2001 (1-е изд.), 2005 (2-е изд.), 2007 (3-е изд.).
- Пауков В.С., Хитров Н.К. Патология. — Учебник для мед. училищ. — М.: Медицина, 1989. — С. 98—112. — 352 с.
- Тель Л.З., Лысенков С.П., Шарипова Н.Г., Шастун С.А. Патофизиология и физиология в вопросах и ответах. — 2 том. — М.: Медицинское информационное агентство, 2007. — С. 66—75. — 512 с.
- Воспаление. Руководство для врачей / Под ред. В.В. Серова, В.С. Паукова. — М.: Медицина, 1995. — 640 с.
- Барышников С.Д. Лекции по анатомии и физиологии человека с основами патологии. — М.: ГОУ ВУНМЦ, 2002. — С. 57—64. — 416 с.
- Атаман А.В. Патологическая физиология в вопросах и ответах. — Учеб. пособие. — К.: Вища школа, 2000. — С. 133—147. — 608 с.
Видео[править | править код]
- «Воспаление» — Центрнаучфильм (Объединение учебных фильмов), 1980 г.
Ссылки[править | править код]
- Воспаление и иммунитет // ImmunInfo.ru
