Система комплемента в воспалении


Система комплемента — комплекс белков, постоянно присутствующих в крови, которые выполняют ряд важнейших функций. На данный момент комплекс насчитывает более трех десятков белковых молекул, среди которых основные белки — С1, С2, …, С9, а также ряд белков-регуляторов. Комплемент принято относить к факторам врожденного иммунитета, выполняющим защитную функцию, однако при определенных обстоятельствах сбой работы системы комплемента может стать звеном патогенеза некоторых заболеваний.
Вначале разберем механизмы работы системы комплемента, после чего рассмотрим их клиническое значение.
Активация системы комплемента
Существует три пути активации данной системы: классический, альтернативный и лектиновый. Все они приводят к ключевому событию: формированию С3-конвертазы.
В классическом варианте комплемент активируется через IgG и IgM, которые формируют иммунные комплексы с антигенами. Комплекс С1 (состоящий из q, r и s субъединиц) связывается с Fc-фрагментом иммуноглобулина. Происходит активация C1, комплекс приобретает протеолитическую активность и активирует C4 и C2. Последние формируют ключевой ферментативный комплекс — С3-конвертазу.
При альтернативном пути активация комплемента происходит без участия антител. Инициируют его поверхностные молекулы микробов и их внеклеточные структуры — например, углеводороды, полисахариды и т. д. С3 в клетках постоянно (даже когда нет активации системы комплемента) претерпевает диссоциацию на С3а и С3b, но в очень малых количествах.
Когда в клетке появляется инициирующий фактор (предположим, это бактерия), С3b связывается с ее поверхностными молекулами. К этому комплексу присоединяются другие молекулы-регуляторы: фактор В, фактор D, пропердин. Так появляется еще одна форма С3-конвертазы.
Лектиновый путь активируется через лектин, связывающий маннозу (фактор врожденного иммунитета — MBL) или группу лектинов Ficolin, которые связывают молекулы на поверхности патогенов — дрожжей, бактерий, паразитов и вирусов. MBL и Ficolin постоянно циркулируют в крови в виде MBL-ассоциированного комплекса (MASP). Когда MASP связывается с вышеназванными молекулами, комплекс претерпевает изменения конформации и активирует уже знакомый путь C4 и C2, что приводит к формированию С3-конвертазы, как и в классическом случае.
Итак, вне зависимости от пути активации различия оканчиваются на формировании ключевого фермента — С3-конвертазы. Последняя расщепляет С3 на два фрагмента: С3а и С3b. Отметим, что С3b выполняет функцию опсонина, С3а — анафилотоксин, способный воздействовать на тучные клетки с высвобождением гистамина.
Однако С3b также способен присоединиться к С3-конвертазе и модифицировать ее, превратив в С5-конвертазу. Этот фермент проделывает то же самое с С5, образуя С5а и С5b. По аналогии, С5а — анафилотоксин, С5b — опсонин.
И снова С5b присоединяется к С5-конвертазе, вовлекая в каскад С6–С9 с формированием т. н. мембраноатакующего комплекса (MAC) [1].
.
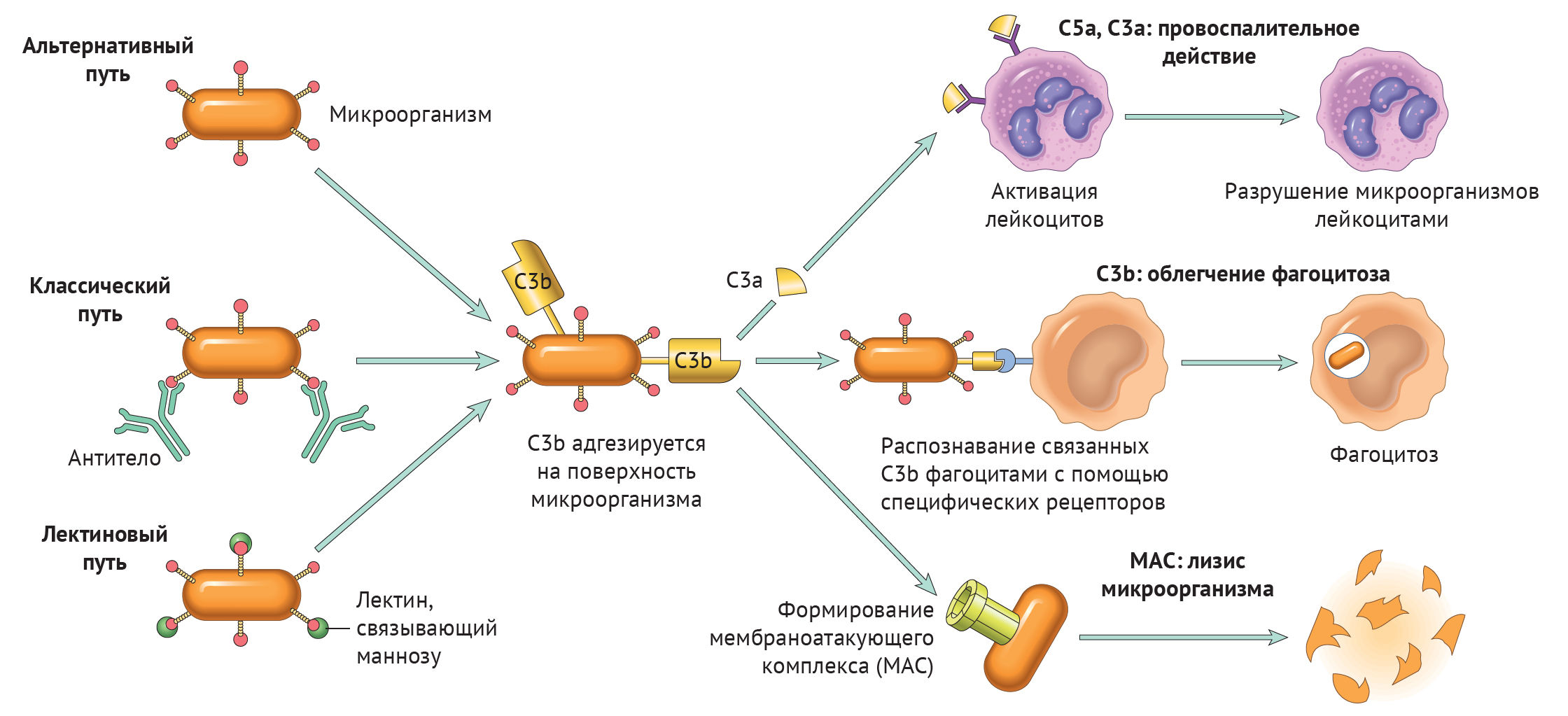
Рисунок 1
Любой из трех путей активации системы комплемента приводит к формированию С3-конвертазы, которая расщепляет С3-компонент на С3а и С3b. Последний участвует в опсонизации патогенов и облегчает таким образом фагоцитоз, а также инициирует каскад формирования МАС. С3а вместе с С5а (и в меньшей степени С4а) — побочные продукты реакций, которые обладают провоспалительным действием («Robbins Basic Pathology», 10nd ed — 2018, p 76).
Таким образом, систему комплемента можно разделить на три функциональные группы: анафилотоксины, опсонины и мембраноатакующий комплекс — МАС.
.

Анафилотоксины
К ним относятся С3а, С4а и С5а. В целом, их роль сводится к провоспалительному действию, что выражается в повышении проницаемости сосудов микроциркуляторного русла (МЦР), вазоконстрикции. В нейтрофилах, эозинофилах и макрофагах анафилотоксины инициируют респираторный взрыв, в базофилах и тучных клетках — высвобождение гистамина. Кроме того, анафилотоксины регулируют синтез эозинофильного катионного белка, адгезию и хемотаксис эозинофилов [2].
В здоровом организме роль анафилотоксинов по большому счету этим и ограничивается. Однако в случае реакций гиперчувствительности данные молекулы могут стать ключевым звеном патогенеза. Одним из наиболее ярких примеров является бронхиальная астма.
Эпителий и гладкомышечные клетки дыхательных путей содержат рецепторы к анафилотоксинам — C3aR и C5aR. При аллергических реакциях происходит активация системы комплемента, который в свою очередь активирует иммунокомпетентные клетки (ИКК), среди которых — нейтрофилы, эозинофилы, макрофаги, дендритные клетки. Последние под влиянием стимула (например, аллергена) способны в свою очередь вновь активировать комплемент — так замыкается порочный круг.
Помимо поддержания системного воспаления, анафилотоксины ответственны и за ремоделирование дыхательных путей. Под их влиянием происходит гиперплазия мерцательного эпителия и гладкомышечных клеток, неоваскуляризация и фиброзирование паренхимы [3,4].
Также анафилотоксины играют важную роль в патогенезе синдрома системного воспалительного ответа (SIRS). При сепсисе, когда микробы в больших количествах попадают в кровоток, происходит системная активация цитокинов, хемокинов и, конечно, системы комплемента. Повышение концентрации анафилотоксинов при сепсисе, к слову, считается неблагоприятным прогностическим фактором [5].
В случае с сепсисом и SIRS анафилотоксины становятся звеном патогенеза. Наибольшая роль в данной ситуации принадлежит С5а. Предположительно, избыточный синтез этого белка приводит к дисфункции нейтрофилов, апоптозу лимфоидных клеток, способствует развитию кардиомиопатий, ДВС-синдрома и полиорганной недостаточности.
В связи с этим постепенно разрабатываются препараты, ингибирующие синтез С5а. На биологических моделях было показано, что блокада данного фактора действительно улучшает прогноз при сепсисе и SIRS [6].
МАС
Данный комплекс может формироваться на поверхности грамотрицательных бактерий и напрямую участвовать в их уничтожении (более всего действие МАС направлено против Neisseria). Описаны также случаи образования МАС на поверхности грамположительных бактерий, паразитов и мембране собственных клеток. Состоит он из последних 5 белков комплемента: С5 — С9.
Специфического рецептора, инициирующего образование комплекса, нет. Белки комплемента адгезируются на наружной поверхности клеточной стенки бактерии, после чего комплекс приобретает ферментативную активность и перфорирует мембрану. Нарушается концентрация ионов и воды — клетка погибает [7].
Недавние исследования показывают, что у МАС имеется и провоспалительное — «сублитическое» — действие. При образовании комплекса на поверхности нейтрофилов или макрофагов происходит локальная утечка провоспалительных медиаторов, а в случае атаки мезангиальных клеток и микроглии — высвобождение цитокинов. Также МАС вызывает образование инфламмасомы путем активации Nod-подобного рецептора [8].
Не допустить образование МАС на собственных клетках помогает рецептор CD59. Генетический дефект CD59 приводит к появлению пароксизмальной ночной гемоглобинурии [7]. А поскольку МАС способен поддерживать системное воспаление, он также вовлекается в патогенез различных воспалительных заболеваний (см. ниже).
Возрастная макулярная дегенерация
Возрастная макулярная дегенерация (ВМД) — основная причина слепоты у пациентов старше 50 лет в цивилизованных странах. В макуле (как и во всей сетчатке) происходят дистрофически-дегенеративные процессы, вследствие чего нарушается способность фокусировать свет в определенной точке, в результате исчезает ясность и четкость зрения. Существует две формы ВМД: влажная (быстро прогрессирующая, экссудативная) и сухая (атрофическая форма). Иногда выделяют рубцовую форму, которая скорее является завершающей стадией заболевания.
Одним из ключевых звеньев этиопатогенеза ВМД является дефект фактора комплемента H — одного из основных регуляторов системы комплемента. Функция его заключается в ингибировании С3-конвертазы (если точнее — является кофактором для протеазы, которая осуществляет катализ С3-конвертазы). Существует несколько форм гена фактора Н, один из наиболее известных — Y402H, который существенно повышает риск развития ВМД. Есть и другие, более редкие варианты [9].
В случае влажной формы ВМД происходит неоваскуляризация сетчатки — аномальное разрастание сосудов под действием VEGF (фактор роста эндотелия сосудов). В опытах было показано, что высвобождение VEGF и неоваскуляризация невозможны без действия MAC [10].
Также в обоих вариантах ВМД важная роль приписывается локальному хроническому воспалению под воздействием системы комплемента. Установлена взаимосвязь между активацией комплемента (особенно по альтернативному пути) и риском развития ВМД [10].
Разумеется, эти данные невозможно было проигнорировать, вследствие чего начали разрабатывать ингибиторы факторов системы комплемента для предотвращения ВМД. На данный момент существуют и моноклональные антитела (анти-фактор D, Экулизумаб), и рекомбинантный фактор Н, и антагонисты различных белков системы комплемента, но пока ни один из них не рекомендован для лечения ВМД [10].
Болезнь Альцгеймера
Воспалительный процесс в нервной ткани сегодня рассматривается как основное патогенетическое звено в развитии БА и других нейродегенеративных заболеваний. Также существуют данные, что прием противовоспалительных препаратов (НПВС) существенно снижает риск развития БА [11].
Однако помимо воспалительных цитокинов, важная роль в развитии локального воспаления принадлежит и системе комплемента. В ликворе пациентов с болезнью Альцгеймера обнаруживается повышенная концентрация С3 в сравнении со здоровыми пациентами. Также активность системы комплемента у пациентов с БА существенно выше [12].
Наследственный ангионевротический отек
НАО — редкое и потенциально фатальное заболевание, этиологическим фактором которого является генетический дефект (НАО 1 типа) или дисфункция (НАО 2 типа) ингибитора С1-компонента комплемента (iС1). В норме iС1 — регулятор, который блокирует весь путь активации системы комплемента. При его дефиците происходит гиперактивация начальных компонентов комплемента, следствием чего является повышение проницаемости сосудов, что приводит к различным отекам.
Проявляется НАО в основном в возрасте после 20 лет отеками конечностей, реже — шеи и лица, которые длятся 1–3, максимум — 7 дней, после чего самостоятельно проходят. Сначала пациент может их даже не замечать, однако со временем частота и выраженность отеков нарастают, может происходить отек слизистой ЖКТ, что проявляется болью, тошнотой, иногда — клиникой острого живота. Наиболее опасен отек гортани, который может сопровождаться асфиксией.
Но ситуация с лечением не так уж и плоха. Ингибитор С1 можно вводить внутривенно для профилактики приступов, для купирования — подкожно [13,14].
Пароксизмальная ночная гемоглобинурия
ПНГ — редкое заболевание, в основе которого лежит клональная экспансия гемопоэтических клеток с мутацией PIGA. Результатом данной мутации является недостаточность ГФИ-заякоренных белков, а именно — CD55 и CD59 (гликозилфосфатидилинозитол или ГФИ-якорь — гликопептид, присоединяющийся к белкам в процессе посттрансляционных модификаций).
Проявляется заболевание гемолитической анемией, костномозговой недостаточностью, тромбофилией.
В норме CD55 ингибирует С9-компонент и предотвращает формирование МАС, а CD59 — ингибирует образование С3-конвертазы и предотвращает протеолиз С3-компонента.
Патогенез начинается с внутрисосудистого гемолиза, который происходит ввиду дефицита CD55. На поверхности эритроцитов с мутацией формируется С3-конвертаза, которая запускает дальнейший синтез МАС. Образование последнего ничего не сдерживает из-за дефекта CD59. МАС перфорирует мембрану эритроцита, и клетка погибает.
Все клинические проявления — гемоглобинурия, анемия (апластическая), тромбоз/эмболия, гастроинтестинальные и неврологические симптомы, так или иначе, являются следствием данного механизма [15,16].
В качестве лечения используется трансплантация гемопоэтических клеток, гемотрансфузии, симптоматическая и поддерживающая терапия. Также достаточно перспективным является использование ингибиторов системы комплемента, например, Экулизумаба (Солириса), который, по данным некоторых публикаций, устраняет все значимые симптомы заболевания [15].
Однако по данным Кохрейна, доказательную базу Экулизумаба нельзя назвать достаточной [17].
Атипичный гемолитико-уремический синдром
Для АГУС характерными симптомами являются гемолитическая анемия, тромбоцитопения и почечная недостаточность с уремией. Этиологией данного заболевания могут быть различные генетические дефекты регуляторов системы комплемента.
Зачастую это мутация CFH, отвечающего за экспрессию уже знакомого читателю фактора Н. Таких мутаций существует более 80, они могут быть наследственными или спорадическими. Также встречаются мутации генов, ответственных за фактор В, С3-компонент комплемента, тромбомодулин и др. [18].
В лечении АГУС также может быть использован экулизумаб [19], однако и здесь ощущается нехватка доказательной базы. В основном же терапия АГУС осуществляется с помощью гемотрансфузий/плазмообмена, диализа, почечной трансплантации — и снова ни одна из названных процедур не способна избавить пациента от болезни [18]. Таким образом, наиболее перспективна разработка ингибиторов системы комплемента и проведение РКИ с их участием.
Помимо перечисленных заболеваний, система комплемента принимает непосредственное участие в патогенезе аутоиммунных кожных заболеваний [20], воспалительных заболеваний почек [21], разнообразных аллергических и аутоиммунных заболеваний.
Разработка ингибиторов комплемента уже сегодня является перспективным направлением, а некоторые препараты данной группы (экулизумаб) уже могут применяться в ряде случаев.
Источники:
- J. V. Sarma and P. A. Ward, ‘The complement system’, Cell Tissue Res., vol. 343, pp. 227–235, 2011.
- J. Kohl, ‘Anaphylatoxins and infectious and non-infectious inflammatory diseases’, Mol. Immunol., vol. 38, no. 2–3, pp. 175–187, 2001.
- M. A. Khan, A. M. Assiri, and D. C. Broering, ‘Complement mediators: Key regulators of airway tissue remodeling in asthma’, J. Transl. Med., vol. 13, no. 1, pp. 1–9, 2015.
- Y. Laumonnier, A. V. Wiese, J. Figge, and C. Karsten, ‘Regulation and function of anaphylatoxins and their receptors in allergic asthma’, Mol. Immunol., vol. 84, pp. 51–56, 2017.
- C. E. Hack et al., ‘Elevated plasma levels of the anaphylatoxins C3a and C4a are associated with a fatal outcome in sepsis’, Am. J. Med., vol. 86, no. 1 C, pp. 20–26, 1989.
- R. S. Hotchkiss, L. L. Moldawer, S. M. Opal, K. Reinhart, I. R. Turnbull, and J.-L. Vincent, ‘Sepsis and septic shock’, Nat. Rev. Dis. Prim., vol. 2, no. 16045, pp. 1–47, 2017.
- C. Bayly-Jones, D. Bubeck, and M. A. Dunstone, ‘The mystery behind membrane insertion: A review of the complement membrane attack complex’, Philos. Trans. R. Soc. B Biol. Sci., vol. 372, no. 1726, 2017.
- B. P. Morgan, ‘The membrane attack complex as an inflammatory trigger’, Immunobiology, vol. 221, no. 6, pp. 747–751, 2016.
- E. C. Schramm, S. J. Clark, M. P. Triebwasser, S. Raychaudhuri, J. M. Seddon, and J. P. Atkinson, ‘Genetic variants in the complement system predisposing to age-related macular degeneration: A review’, Mol. Immunol., vol. 61, no. 2, pp. 118–125, 2014.
- R. Troutbeck, S. Al-Qureshi, and R. H. Guymer, ‘Therapeutic targeting of the complement system in age-related macular degeneration: A review’, Clin. Exp. Ophthalmol., vol. 40, no. 1, pp. 18–26, 2012.
- P. L. McGeer, J. Rogers, and E. G. McGeer, ‘Inflammation, antiinflammatory agents, and Alzheimer’s disease: The last 22 years’, Handb. Infect. Alzheimer’s Dis., vol. 54, pp. 11–15, 2017.
- H. Krance, C. W. Yi, and Z. Huiyan, ‘The complement cascade in Alzheimer ’ s disease : a systematic review and meta-analysis’, Mol. Psychiatry, 2019.
- K. Bork et al., ‘Guideline: Hereditary angioedema due to C1 inhibitor deficiency: S1 Guideline of the German Society for Angioedema (Deutsche Gesellschaft für Angioödeme, DGA), German Society for Internal Medicine (Deutsche Gesellschaft für Innere Medizin, DGIM), German S’, Allergo J. Int., vol. 28, no. 1, pp. 16–29, 2019.
- H. Longhurst et al., ‘Prevention of hereditary angioedema attacks with a subcutaneous C1 inhibitor’, N. Engl. J. Med., vol. 376, no. 12, pp. 1131–1140, 2017.
- A. Kumar, ‘Paroxysmal Nocturnal Hemoglobinuria’, Blood, vol. 124, no. 18, pp. 1462–1470, 2014.
- C. Parker et al., ‘Diagnosis and management of paroxysmal nocturnal hemoglobinuria’, Rev. Transl. Hematol., vol. 106, no. 12, pp. 3699–3709, 2005.
- A. J. Martí-Carvajal, V. Anand, A. F. Cardona, and I. Solà, ‘Eculizumab for treating patients with paroxysmal nocturnal hemoglobinuria’, Cochrane Database Syst. Rev., vol. 2013, no. 2, 2013.
- M. Progress, ‘Atypical Hemolytic–Uremic Syndrome’, N. Engl. J. Med., 2010.
- C. M. Legendre et al., ‘Terminal complement inhibitor eculizumab in atypical hemolytic-uremic syndrome’, N. Engl. J. Med., vol. 368, no. 23, pp. 2169–2181, 2013.
- G. Edwards, G. F. H. Diercks, M. A. J. Seelen, B. Horvath, M. B. A. Van Doorn, and J. Damman, ‘Complement activation in autoimmune bullous dermatoses: A comprehensive review’, Front. Immunol., vol. 10, no. JUN, pp. 1–8, 2019.
- K. Koåcielska-Kasprzak, D. Bartoszek, M. Myszka, M. Åabińska, and M. Klinger, ‘The complement cascade and renal disease’, Arch. Immunol. Ther. Exp. (Warsz)., vol. 62, no. 1, pp. 47–57, 2014.
Комплемент представляет собой систему взаимосвязанных плазменных белков, играющих существенную роль в развитии иммунных и воспалительных реакций. Состоит по меньшей мере из 18 белков, в том числе из 9 компонентов собственно комплемента, обозначаемых буквой С с соответствующим номером — от С1 до С9. Некоторые компоненты состоят из нескольких отдельных фракций.
В здоровом организме система комплемента сама по себе неактивна. «Классический путь» ее активирования начинается чаще всего с взаимодействия Clq и иммунных комплексов (конкретно с взаимодействия фракции Clq и фрагмента Fc антитела, входящего в состав иммунного комплекса). Активаторами классического пути могут быть также агрегированный IgG, С-реактивный белок, некоторые вирусы, протеолитические ферменты в достаточной концентрации (плазмин, калликреин, трипсин). Затем происходит последовательное активирование остальных компонентов комплемента в следующем порядке: С1, С4, С2, С3, С5, С6, С7, С8, С9.
Ключевым пунктом считается активирование С3, который содержится в плазме в наибольшем количестве (1200 мкг/мл) и появление в результате этого активирования его важнейшего продукта расщепления С3а, который в свою очередь активирует следующие звенья системы.
Биологические эффекты, оказываемые системой комплемента, зависят от того, насколько далеко зашло ее активирование, и включают усиление фагоцитоза иммунных комплексов и бактерий, увеличенный выход ферментов из лизосом, стимуляцию гистаминообразования и дегрануляцию тучных клеток, повышение синтеза простагландинов и проницаемости капилляров, усиление хемотаксиса нейтрофилов и макрофагов, увеличение иммунного прилипания клеток, нейтрализацию ряда вирусов, сокращение гладких мышц, генерацию супероксидных радикалов, стимуляцию В-клеток.
При полном активировании всей системы комплемента наступает лизис тех клеток, на которых фиксирован активированный комплекс С56789 (схема 1.1). Таким образом, эти эффекты могут вызывать острое или хроническое воспаление, а также серьезно влиять на уже развившиеся воспалительные процессы. Массированное активирование комплемента способно вызывать угрожающий жизни синдром диссеминированного внутрисосудистого свертывания (ДВС).

Схема 1.1. Биологические эффекты активирования комплемента.
Помимо классического пути, существует так называемый альтернативный путь активирования комплемента, начинающийся с активации сразу СЗ, т. е. минуя предшествующую активацию С1, С4 и С2. При этом процесс начинается с взаимодействия С3 и циркулирующих в крови особых белков D, В и Р (пропердин). Активаторами данного пути бывают бактериальные токсины, зимозан, агрегированный IgM, яд кобры и т. д. Кроме того, в процессе классического активирования комплемента один из продуктов расщепления С3—СЗb образует с белком В комплекс, который активирует С3, а тем самым и в целом альтернативный путь (схема 1.2).
Роль комплемента в развитии воспалительного процесса при ревматических заболеваниях особенно убедительна для ревматоидного артрита. Так, у больных серопозитивным ревматоидным артритом в синовиальной жидкости воспаленных суставов снижено содержание общей активности комплемента и ряда его конкретных компонентов — С1, С4, С2, С3, а также двух белков его альтернативного пути — Р и В. Это снижение следует считать результатом повышенного потребления комплемента из-за образования иммунных комплексов, так как одновременно обнаруживались продукты расщепления С4, СЗ и В.
Таким образом, можно полагать, что при данном заболевании происходит активирование комплемента обоими путями — классическим и альтернативным. Достоверное участие комплемента в развитии синовита подтверждается присутствием в синовиальной жидкости также конкретных хемотаксических факторов С5а и С5, 6, 7, а в нейтрофилах суставной полости — иммуноглобулинов в сочетании с Clq, С4 и С3.
При электронной микроскопии изменения мембраны синовиальных клеток больных очень напоминают изменения, полученные в эксперименте в результате полной активации комплемента.
Ранее полагали, что активация комплемента может быть ответственна за острое и подострое суставное воспаление при ревматоидном артрите. Позже было установлено, что продукты системы

Схема 1.2. Классический и альтернативный пути активирования комплемента.
Общие эффекторные реакции обоих путей активирования комплемента способны влиять также на функции лимфоцитов и макрофагов, имеющих существенное значение в развитии хронического иммунного воспаления. Обращает внимание, что врожденный дефицит некоторых компонентов комплемента предрасполагает к развитию некоторых соединительнотканных и инфекционных заболеваний. Так, дефицит С1, С4 и особенно С2 относительно часто сочетается с системной красной волчанкой (СКВ), нефритом, хроническими артритами у детей и васкулитом. Лица с дефицитом «завершающих» компонентов (С5—8) особенно склонны к развитию гонококковой и менингококковой инфекции.
Сопоставление трех рассмотренных биологических систем генерации воспаления позволяет выделить в них ряд общих функциональных компонентов. В каждой из этих систем имееются распознающие белки, факторы проницаемости, хемотаксические факторы и регулирующие вещества. Белками, распознающими адекватный для данной системы пусковой агент, являются Clq—для классического и С3b — для альтернативного пути активирования комплемента, фактор Хагемана — для сопряженной кинингенерирующей, свертывающей и фибринолитической системы, IgE — для системы тучных клеток.
Веществами, повышающими проницаемость сосудов, соответственно являются С3а и С5а, брадикинин, гистамин и SRSA. Они способствуют поступлению в воспаленную область плазменных белков, облегчающих и повышающих дальнейшую генерацию медиаторов воспаления. Выраженными хемотаксическими свойствами в системе комплемента обладают С5а и С5, 6, 7, в системе фактора Хагемана — калликреин, в системе тучных клеток — белковые, липидные и пептидные стимуляторы хемотаксиса нейтрофилов и эозинофилов. Вследствие влияния этих факторов в очаг воспаления привлекаются прежде всего нейтрофилы, играющие огромную роль в дальнейшем поддержании воспаления и в реализации воспалительного повреждения тканей.
Повышение активности одной из систем может приводить к активированию остальных. В частности, С3а, С5а и брадикинин стимулируют выделение гепарина, а плазмин активирует комплемент.
Особый интерес привлекают регулирующие («модулирующие») факторы рассмотренных систем генерации воспаления. Они не только демонстрируют сложность и взаимозависимость этих систем между собой и с другими медиаторами воспаления, но и трудность суждения о каждой из них, исходя только из оценки ее частных показателей. Обращает также внимание, что некоторые из регулирующих факторов действуют по принципу обратной связи.
Так, эффект гистамина усиливается рядом простагландинов. В то же время гистамин по механизму отрицательной обратной связи тормозит освобождение из тучных клеток новых количеств гистамина, что позволяет регулировать его биологические эффекты. Аналогичным образом гистамин стимулирует выделение надпочечниками адреналина, чье сосудосуживающее влияние противодействует его собственному сосудорасширяющему эффекту. К этому следует добавить, что в эксперименте гистамин угнетает проявления кожных иммунных реакций замедленного типа, a in vitro — клеточную цитотоксичность, пролиферацию лимфоцитов (в том числе Т-супрессоров под влиянием конконаваллина А) и продукцию ими лимфокинов.
В кининобразующей системе регулирующую роль выполняют комплекс антитромбин III-гепарин, b2-макроглобулин и a1-антитрипсин, угнетающие активность фактора Хагемана, плазмина и калликреина. Активность брадикинина тормозится кининазой 1, обеспечивающей его эффект преимущественно в местах образования. Если повышенные количества попадают в общий кровоток, то они инактивируются в легких тем же ферментом, который переводит неактивный ангиотензин I в активный ангиотензин II. Последний вызывает генерализованную сосудосуживающую реакцию и стимулирует выделение в кровь альдостерона, т. е. обеспечивает эффекты, противодействующие вазодилатационному влиянию брадикинина.
В системе комплемента для классического пути контролирующую роль играют ингибитор Cl-эстеразы (C1INH) и белок, связывающийся с С4, а для альтернативного пути — белки Н и I, влияющие на активность альтернативной С3-конвертазы. Своеобразно также, что комплемент, который наиболее часто активируется иммунными комплексами, может, напротив, приводить к растворению отложенных в тканях иммунных комплексов. Последние становятся при этом биологически инертными и постепенно катаболизируются.
Для реализации данного феномена требуется избыток комплемента; непосредственное повышение растворимости иммунных комплексов осуществляет СЗb. Все изложенное подчеркивает многоступенчатую и разветвленную взаимосвязь систем, вызывающих и (или) регулирующих воспаление. Очевидно также, что определение активности или содержания одного либо нескольких компонентов этих систем (что, как правило, практикуется в клинических условиях) отнюдь не всегда свидетельствует об однозначном суммарном эффекте функционирования всей системы в целом.
Важнейшая роль клеточных элементов в развитии острого и хронического воспаления заслуживает специального рассмотрения.
Опубликовал Константин Моканов
