Стимуляторы и ингибиторы репаративной стадии воспаления
2.1.10. Механизмы развития пролиферации в очаге воспаления
Пролиферация является завершающей фазой развития воспаления, обес-печивающей репаративную регенерацию тканей на месте очага аль-
терации. Пролиферация развивается с самого начала воспаления наряду с яв-лениями альтерации и экссудации.
При репаративных процессах в очаге воспаления регенерация клеток и фиброплазия достигаются как активацией процессов пролиферации, так и ог-раничением апоптоза клеток. Размножение клеточных элементов начинается по периферии зоны воспаления, в то время как в центре очага могут еще про-грессировать явления альтерации и некроза. Полного развития пролиферация соединительнотканных и органоспецифических клеточных элементов дости-гает после «очистки» зоны повреждения от клеточного детрита и инфекци-онных возбудителей воспаления тканевыми макрофагами и нейтрофилами. В связи с этим следует отметить, что процессу пролиферации предшествует формирование нейтрофильного и моноцитарного барьеров, которые форми-руются по периферии зоны альтерации.
Восстановление и замещение поврежденных тканей начинается с выхода из сосудов молекул фибриногена и образования фибрина, который формиру-ет своеобразную сетку, каркас для последующего клеточного размножения. Уже по этому каркасу распределяются в очаге репарации быстро образую-щиеся фибробласты. Деление, рост и перемещение фибробластов возможны только после их связывания с фибрином или коллагеновыми волокнами. Эта связь обеспечивается особым белком – фибронектином. Размножение фиб-робластов начинается по периферии зоны воспаления, обеспечивая формиро-вание фибробластического барьера. Хемотаксис, активация и пролиферация фибробластов осуществляются под воздействием:
1. Факторов роста фибробластов.
2. Тромбоцитарного фактора роста.
3. Цитокинов — ФНО, ИЛ-1.
4. Кининов.
5. Тромбина.
6. Трансформирующего фактора роста b.
Сначала фибробласты не зрелые и не обладают достаточной синтетиче-ской активностью. Созреванию предшествует внутренняя структурно-функциональная перестройка фибробластов: гипертрофия ядра и ядрышка, гиперплазия ЭПС, повышение содержания ферментов, особенно щелочной фосфатазы, неспецифической эстеразы, b-глюкуронидазы. Только после пе-рестройки фибробласты начинают синтезировать коллаген, эластин, коллаге-нассоциированные белки и протеогликаны. Коллагеногенез стимулируется следующими биологически активными веществами — ФНО, ИЛ-1, ИЛ-4, фак-тором роста фибробластов, тромбоцитарным фактором роста.
Интенсивно размножающиеся фибробласты продуцируют кислые муко-полисахариды – основной компонент межклеточного вещества соединитель-ной ткани (гиалуроновую кислоту, хондроитинсерную кислоту, глюкозамин, галактозамин). При этом зона воспаления не только инкапсулируется, но и начинаются постепенная миграция клеточных и бесклеточных компонентов соединительной ткани от периферии к центру, формирование соединитель-нотканного остова на месте первичной и вторичной альтерации.
Наряду с фибробластами размножаются и другие тканевые и гематоген-ные клетки. При разрушении базальных мембран сосудов в зоне альтерации происходит миграция клеток эндотелия по градиенту ангиогенных факторов. Просвет новообразующегося капилляра формируется путем слияния внекле-точных пространств соседних эндотелиоцитов. Вокруг новообразующихся капилляров концентрируются тучные клетки, макрофаги, нейтрофилы, кото-рые освобождают биологически активные вещества, способствующие про-лиферации капилляров.
Важнейшими факторами, стимулирующими ангиогенез, являются:
1. Факторы роста фибробластов (основной и кислый).
2. Сосудистый эндотелиальный фактор роста.
3. Трансформирующие факторы роста .
4. Эпидермальный фактор роста.
Фибробласты вместе с вновь образованными сосудами создают грануля-ционную ткань. Это, по существу, молодая соединительная ткань, богатая клетками и тонкостенными капиллярами, петли которых выступают над по-верхностью ткани в виде гранул.
Основными функциями грануляционной ткани являются: защитная – пре-дотвращение влияния факторов окружающей среды на очаг воспаления и ре-паративная – заполнение дефекта и восстановление анатомической и функ-циональной полноценности поврежденных тканей.
Формирование грануляционной ткани не строго обязательно. Это зависит от величины и глубины повреждения. Грануляционная ткань обычно не раз-вивается при заживлении ушибленных кожных ранок или мелких поврежде-ний слизистой оболочки (Кузин М.И., Костюченок Б.М. и соавт., 1990). Гра-нуляционная ткань постепенно превращается в волокнистую ткань, называе-мую рубцом. В рубцовой ткани уменьшается количество сосудов, они запус-тевают, уменьшается количество макрофагов, тучных клеток, снижается ак-тивность фибробластов. Небольшая часть клеточных элементов, распола-гающаяся среди коллагеновых нитей, сохраняет активность. Предполагают, что сохранившие активность тканевые макрофаги принимают участие в рас-сасывании рубцовой ткани и обеспечивают формирование более мягких руб-цов.
Параллельно с созреванием грануляций происходит эпителизация раны. Она начинается в первые часы после повреждения, и уже в течение первых суток образуются 2-4 слоя клеток базального эпителия. Скорость эпителиза-ции обеспечивается следующими процессами: миграцией, делением и диф-ференцировкой клеток. Эпителизация небольших ран осуществляется, в ос-новном, за счет миграции клеток из базального слоя. Раны более крупные эпителизируются за счет миграции и митотического деления клеток базаль-ного слоя, а также дифференцировки регенерирующего эпидермиса. Новый эпителий образует границу между поврежденным и подлежащим слоем, он препятствует обезвоживанию тканей раны, уменьшению в ней электролитов и белков, а также предупреждает инвазию микроорганизмов.
В процессе пролиферации участвуют и органспецифические клеточные элементы органов и тканей. С точки зрения возможностей пролиферации ор-ганспецифических клеточных элементов все органы и ткани могут быть рас-классифицированы на три группы:
К первой группе могут быть отнесены органы и ткани, клеточные элемен-ты которых обладают активной или практически неограниченной пролифе-рацией, достаточной для полного восполнения дефекта структуры в зоне воспаления (эпителий кожи, слизистых оболочек дыхательных путей, слизи-стой желудочно-кишечного тракта, мочеполовой системы; гемопоэтическая ткань и др.).
Ко второй группе относятся ткани с ограниченными регенерационными способностями (сухожилия, хрящи, связки, костная ткань, периферические нервные волокна).
К третьей группе относятся те органы и ткани, где органоспецифические клеточные элементы не способны к пролиферации (сердечная мышца, клетки ЦНС). Основными факторами, регулирующими процессы пролиферации и дифференцировки клеток в очаге воспаления, являются:
1. Факторы роста, продуцируемые макрофагами, лимфоцитами, тромбо-цитами, фибробластами и другими клетками, стимулированными в зоне вос-паления. К ним относятся:
— факторы роста эпидермиса (стимулятор пролиферации и созрева-ния эпителия, стимулятор ангиогенеза);
— трансформирующий фактор роста- (стимулятор ангиогенеза);
— трансформирующий фактор роста- (хемоаттрактант фибробла-стов, стимулятор синтеза коллагена, фибронектина, ангиогенеза, ингибитор протеолиза);
— тромбоцитарный фактор роста (стимулятор миграции, пролифе-рации и синтеза белка в клетках-мишенях, обладает провоспалительным эф-фектом);
— фактор роста эндотелиоцитов;
— фактор роста фибробластов кислый и основной (стимуляторы пролиферации всех клеток сосудистой стенки);
— колониестимулирующие факторы (гранулоцитарный и макрофа-гальный стимуляторы дифференцировки, пролиферации и функциональной активности клеток гранулоцитарного и моноцитарного ряда) — цитокины (ФНО, ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7) , продуцируемые Т- и В-лимфоцитами, мононуклеарами, тучными клетками, фибробластами, эндоте-лиоцитами, обеспечивают хемотаксис, фиброгенез, ингибируют апоптоз, стимулируют процессы пролиферации в очаге воспаления. Ингибиторами роста для некоторых клеток служат те же цитокины, которые стимулируют пролиферацию других – это ФНО, трансформирующий фактор роста и - интерферон (Зайчик А.Ш., Чурилов Л.П., 1999);
— фактор роста нервов (стимулятор пролиферации, роста, морфоге-неза симпатических нейронов, эпителиальных клеток). Ростовые факторы, взаимодействуя с рецепторами на клетках- мишенях, могут непосредственно стимулировать синтез ДНК в клетках или подготавливать внутриклеточные рецепторы и ферменты к митотической деятельности.
2. Пептид гена, родственного кальцитонину, стимулирует пролифе-рацию эндотелиальных клеток, а субстанция Р индуцирует выработку ФНО в мак-рофагах.
3. Простагландины группы Е потенцируют регенерацию путем усиления кровоснабжения.
4. Кейлоны и антикейлоны, продуцируемые различными клетками, дейст-вуя по принципу обратной связи, могут активировать и угнетать митотиче-ские процессы в очаге воспаления (Бала Ю.М., Лифшиц В.М., Сидельникова В.И., 1988).
5. Полиамины (путресцин, спермидин, спермин), обнаруживаемые во всех клетках млекопитающих, жизненно необходимы для роста и деления клеток.
Они обеспечивают стабилизацию плазматических мембран и суперспи-ральной структуры ДНК, защиту ДНК от действия нуклеаз, стимуляцию транскрипции, метилирование РНК и связывание ее с рибосомами, актива-цию ДНК-лигаз, эндонуклеаз, протеинкиназ и многие другие клеточные про-цессы. Усиленный синтез полиаминов, способствующих пролиферативным процессам, отмечается в очаге альтерации (Березов Т.Т., Федорончук Т.В., 1997).
6. Циклические нуклеотиды: цАМФ ингибирует, а цГМФ активирует про-цессы пролиферации.
Заживление раны.
Морфологически процесс заживления раны может протекать различно, в зависимости от анатомического субстрата поражения, степени инфицирован-ности, общего состояния организма, характера лечебных мероприятий (Ку-зин М.И., Костюченок Б.М. и соавт., 1990). Однако в любом случае течение раневого процесса отражает один из классических типов заживления:
1. Заживление первичным натяжением.
2. Заживление вторичным натяжением.
3. Заживление под струпом.
Заживление раны первичным натяжением. Такой тип заживления харак-теризуется сращением краев раны без видимой промежуточной ткани, путем соединительнотканной организации раневого канала. Заживление первичным натяжением является наиболее экономичным видом заживления. Для зажив-ления первичным натяжением необходимы следующие условия:
1. Небольшая зона повреждения.
2. Плотное соприкосновение краев раны.
3. Сохранение жизнеспособности краев раны.
4. Отсутствие очагов некроза и гематомы.
5. Асептичность раны.
Морфологическая картина заживления первичным натяжением проявля-ется умеренной гиперемией, отеком тканей в стенках раны, пролиферацией фибробластов и новообразованием капилляров путем эндотелизации каналов и щелей в сгущающемся фибрине (аутохтонный механизм) от одного края раны к противоположному. На 6-8-й день грануляционная ткань прочно со-единяет стенки раны, и в этот период прекращается эпителизация. В хирур-гической практике заживление первичным натяжением возможно в двух слу-чаях: при небольших размерах раны (края отстают не более 10 мм друг от друга), а также при хирургических вмешательствах, заканчивающихся нало-жением швов. Местные изменения в области раны выражены незначительно (отечность краев, гиперемия, инфильтрация, боль). К общим проявлениям относится повышение температуры тела, которая постепенно снижается к 3-м суткам после операции. Изменения морфологического состава крови вы-ражены незначительно или отсутствуют. Иногда отмечаются нейтрофильный лейкоцитоз и увеличение СОЭ до 20 мм/ч. На 5-6-е сутки эти показатели обычно нормализуются.
Заживление раны вторичным натяжением происходит при обширных по-вреждениях тканей, при наличии в ране нежизнеспособных тканей, гематомы и при развитии инфекции в ране. Любой из этих факторов ведет к заживле-нию вторичным натяжением. При различных вариантах течения заживления вторичным натяжением речь идет о заживлении гнойной раны, то есть о за-живлении через нагноение и гранулирование. На 5-6-е сутки после альтера-ции, после отторжения некротизированных клеток в ране появляются ост-ровки грануляций, которые, постепенно разрастаясь, заполняют всю полость раны. Изменения характера грануляций всегда объективно отражают ослож-нения заживления, которые могут наступить под влиянием местных и общих факторов. Реорганизация рубца проявляется активной эпителиизацией раны. Эпителий нарастает на поверхность грануляций в виде голубовато-белой каймы очень медленно. Помимо эпителизации заживлению способствует фе-номен раневой контракции — равномерного концентрического сокращения краев и стенок раны. Этот феномен объясняется появлением в грануляцион-ной ткани в период регенерации фибробластов, обладающих способностью к сокращению.
Заживление раны под струпом характерно для незначительных повреж-дений (ссадины, царапины, небольшие по площади ожоги 1-й и 2-й степени). Раневой процесс начинается свертыванием излившейся крови или только лимфы, которая подсыхает с образованием струпа. Под ним происходит бы-страя регенерация эпидермиса, и струп затем отторгается. Весь процесс длится 3-7 дней. Если заживление под струпом происходит без осложнений, то рана заживает первичным натяжением; если под струпом начинается на-гноение, то заживление идет по типу вторичного натяжения. В ряде случаев может развиться вялотекущее флегмонозное поражение жировой клетчатки, окружающей рану. В такой ситуации необходимы хирургическая обработка раны и удаление струпа (Кузин М.И., Костюченок Б.М. и соавт., 1990).
предыдущий раздел | содержание| следующий раздел
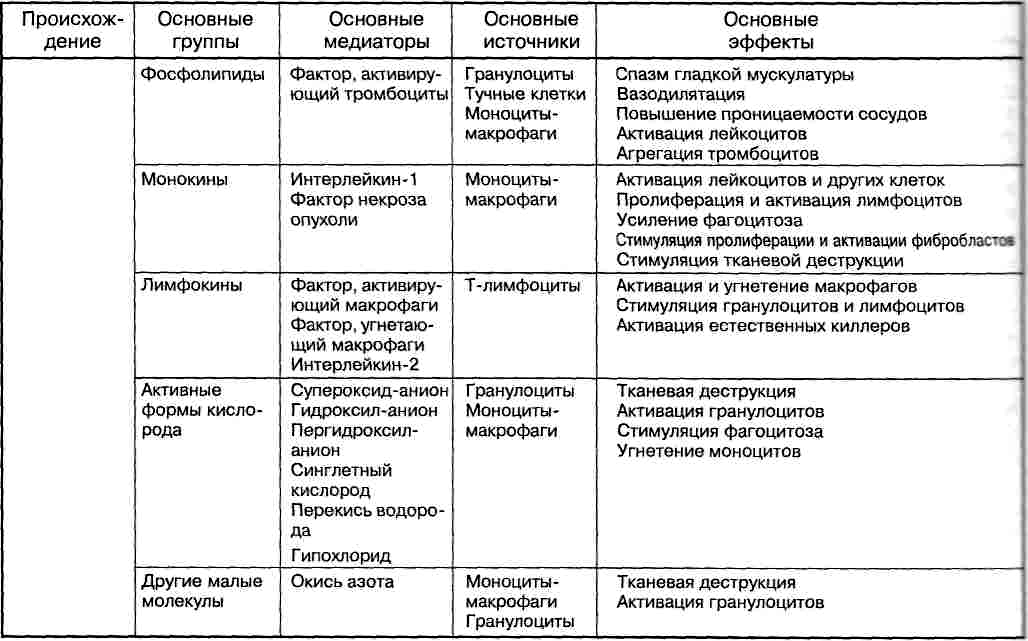
Пролиферация
(proliferatо
от лат. proles
-потомство, ferre
— создавать).
Под воспалительной
пролиферацией понимают размножение
местных
клеточных элементов в очаге воспаления.
Пролиферация
развивается с самого начала воспаления
наряду с явлениями альтерации и
экссудации, но становится преобладающей
в более поздний период процесса, по мере
стихания экссудативно-инфильтративных
явлений. Первоначально она в большей
мере выражена на периферии очага.
Важнейшим условием прогрессирования
пролиферации является эффективность
очищения очага воспаления от
микроорганизмов или другого вредного
агента, продуктов альтерации тканей,
погибших лейкоцитов (раневое очищение).
Ведущая роль в этом отводится макрофагам
— гематогенного (моноциты) и тканевого
(гистиоциты) происхождения.
Раневое очищение
происходит главным образом путем
внеклеточной деградации поврежденной
ткани, а также за счет фагоцитоза.
Оно осуществляется под регуляторным
влиянием цитокинов с помощью таких
ферментов, как протеогликаназа,
коллагеназа, желатиназа. Активация
этих ферментов может происходить под
воздействием активатора плазминогена,
высвобождаемого при участии цитокинов
из мезенхи-мальных клеток. Простагландины,
высвобождаясь вместе с ферментами,
могут, со своей стороны, индуцировать
протеиназы и вносить свой вклад
в процессы деградации. Элиминируя
останки
лейкоцитов и разрушенных тканей,
макрофаги устраняют один из важнейших
источников собственной хемотаксической
стимуляции и подавляют дальнейшее
развитие местной лейкоцитарной
реакции. По мере очищения очага воспаления
количество макрофагов убывает из-за
снижения поступления их из крови. Из
очага они уносятся восстанавливающимся
током лимфы в регионарные лимфоузлы,
где погибают. Лимфоциты частью погибают,
частью превращаются в плазматические
клетки, продуцирующие антитела, и затем
постепенно элиминируются.
Пролиферация
происходит главным образом за счет
мезенхимальных элементов стромы, а
также элементов паренхимы органов. В
ней участвуют камбиальные,
адвентициальные, эндотелиальные клетки.
В результате дифференцировки стволовых
клеток соединительной ткани -полибластов
— в очаге появляются эпителиоидные
клетки, фибробласты и фиброциты.
Основными клеточными элементами,
ответственными за репаративные процессы
в очаге воспаления, являются фибробласты.
Они продуцируют основное межклеточное
вещество — гликозаминогликаны, а также
синтезируют и секретируют волокнистые
структуры — коллаген, эластин, ретикулин.
В свою очередь, коллаген является главным
компонентом рубцовой ткани.
Процесс пролиферации
находится под сложным гуморальным
контролем. Решающее значение здесь
имеют опять-таки макрофаги. Они являются
основным источником фактора роста
фибробластов — термолабильного белка,
стимулирующего пролиферацию фибробластов
и синтез коллагена. Макрофаги также
усиливают привлечение фибробластов
в очаг воспаления. Важную роль в этом
играет секретируемый макрофагами
фибронектин, а также интерлейкин-1.
Макрофаги стимулируют пролиферацию
эндотелиальных и гладкомышечных клеток,
базальной мембраны и, таким образом,
образование микрососудов. Угнетение
или стимуляция системы мононуклеарных
фагоцитов соответственно ослабляет
или усиливает развитие грануляционной
ткани в очаге гнойного воспаления.
В свою очередь,
макрофаги опосредуют регуляторное
влияние на фибробласты и пролиферацию
Т-лимфоцитов. Последние же активируются
протеиназами, образующимися в очаге
воспаления в результате распада
ткани. Протеиназы могут оказывать
непосредственное влияние как на
макрофаги, так и на фибробласты. Макрофаги
и лимфоциты могут высвобождать моно- и
лимфокины, не только стимулирующие, но
и угнетающие фибробласты, выступая в
качестве истинных регуляторов их
функций.
Фибробласты зависят
также от тромбоцитарного фактора роста,
являющегося термостабильным белком
с высоким содержанием цистеина и м.м.
30000Д. В качестве других факторов роста
для фибробластов называют соматотропин,
соматомедины, инсулиноподобные пептиды,
инсулин, глюкагон.
Важную роль в
пролиферативных явлениях играют кейлоны
— термолабильные гликопротеины с м.м.
40000Д, являющиеся ингибиторами клеточного
деления. Механизм действия состоит
в инактивации ферментов, участвующих
в редупликации ДНК. Одним из основных
источников кейлонов являются
сегментоядерные нейтрофилы. По мере
снижения количества нейтрофилов в очаге
воспаления уменьшается содержание
кейлонов, что приводит к ускорению
деления клеток. По другим предположениям,
при воспалении сегментоядерные нейтрофилы
практически не вырабатывают кейлоны
и усиленно продуцируют антикейлоны
(стимуляторы деления); соответственно,
деление клеток ускоряется, пролиферация
усиливается.
Другие клетки и
медиаторы могут модулировать
репаративный процесс, воздействуя на
функции фибробластов, макрофагов и
лимфоцитов. Существенное значение в
регуляции репаративных явлений имеют
также реципрокные взаимоотношения
в системе коллаген — коллагеназа,
стромально-паренхиматозные взаимодействия
(Д.Н. Маянский).
Пролиферация
сменяется регенерацией. Последняя
не входит в комплекс собственно
воспалительных явлений, однако
непременно следует им и трудно от них
отделима. Она состоит в разрастании
соединительной ткани, новообразовании
кровеносных сосудов, в меньшей степени
— в размножении специфических элементов
ткани.
При незначительном повреждении ткани
происходит
относительно полная ее регенерация.
При образовании дефекта он заполняется
вначале грануляционной тканью —
молодой, богатой сосудами, которая
впоследствии замещается соединительной
тканью с образованием рубца.
К
стимуляторам и ингибиторам репаративной
стадии воспаления относятся: фактор
роста, раневые гормоны, трофогены. На
этой стадии постепенно прекращаются
разрушительные процессы и сменяются
созидательными процессами. Прежде всего
— это размножение клеток и возмещение
возникшего ранее дефекта новообразованными
клетками. Одновременно с размножением
клеток и даже несколько опережая его,
идет процесс
активного погашения воспалительного
процесса, что проявляется ингибицией
ферментов, дезактивацией воспаления,
расщеплением и выведением токсических
продуктов.
Активность клеток воспаления тормозится
разными механизмами. Что касается
ингибиторов,
то в этом отношении важнейшую роль
играет α2-макроглобулин
(α2-М).
Этот белок имеет широкий спектр действия.
Он является главным ингибитором
кининообразующих ферментов крови и
таким образом устраняет их влияние:
расширение и повышение проницаемости
сосудов. Кроме того, он ингибирует
большинство протеиназ из лейкоцитов,
в том числе коллагеназу и эластазу и
тем самым предохраняет от разрушения
элементы соединительной ткани. Наконец,
макроглобулин α2-М
может связываться с мембранами нейтрофилов
и таким образом тормозить их реакцию
на СЗа и С5а (хемотаксис). В контроль за
воспаление включаются и другие ингибиторы,
в том числе альфа-антихимотрипсин
(α1-АХ),
который тормозит катепсин I и химотрипсин.
Антитромбин III и α2-антиплазмин
ингибируют сериновые ферменты и являются
главными ингибиторами системы коагуляции,
фибринолиза и комплемента.
Стимуляторы и
ингибиторы репаративной стадии воспаления
Пролиферация находится под контролем
многих рецепторов:
1) Фибробласты
синтезируют проколлаген и, в то же время,
секретируют коллагеназу, расщепляющую
коллаген. Между этими процессами
существует взаимодействие по типу
ауторегуляции. Нарушение этой регуляции
приводит к развитию склеропатий.
2) Фибропектин
(фибробласты) детерминирует миграцию,
пролиферацию и адгезию клеток
соединительной ткани.
3) Фактор стимуляции
фибробластов (микрофаги), увеличивает
размножение их и адгезивные свойства.
4) Лимфокины и
монокины, ингибируют пролиферацию
фибробластов и образование коллагена.
5) Простагландины
группы Е могут потенциировать рост
через усиление кровоснабжения в
пролиферирующей ткани.
6) Кейлоны —
тканеспецифические ингибиторы,
антикейлоны — стимуляторы пролиферации,
взаимодействуют по типу обратной связи
7) Глюкокортикоиды
тормозят регенерацию, тормозят секрецию
коллагена СТГ, минералокортикоиды
стимулируют регенерацию.
8) цАМФ — ингибирует
(митоз) пролиферацию, цГМФ — стимулирует
пролиферацию.
Продукты повреждения
ткани являются стимулирующими регенерацию
(протеазы, полипептиды, низкомолекулярные
белки), раздражители для размножения
клеток («раневые гормоны»), продукты
распада лейкоцитов «трефоны» (от греч.
trephos — питаю), десмоны, витамины С и А.
Избыток ведет к
продуктивному воспалению.
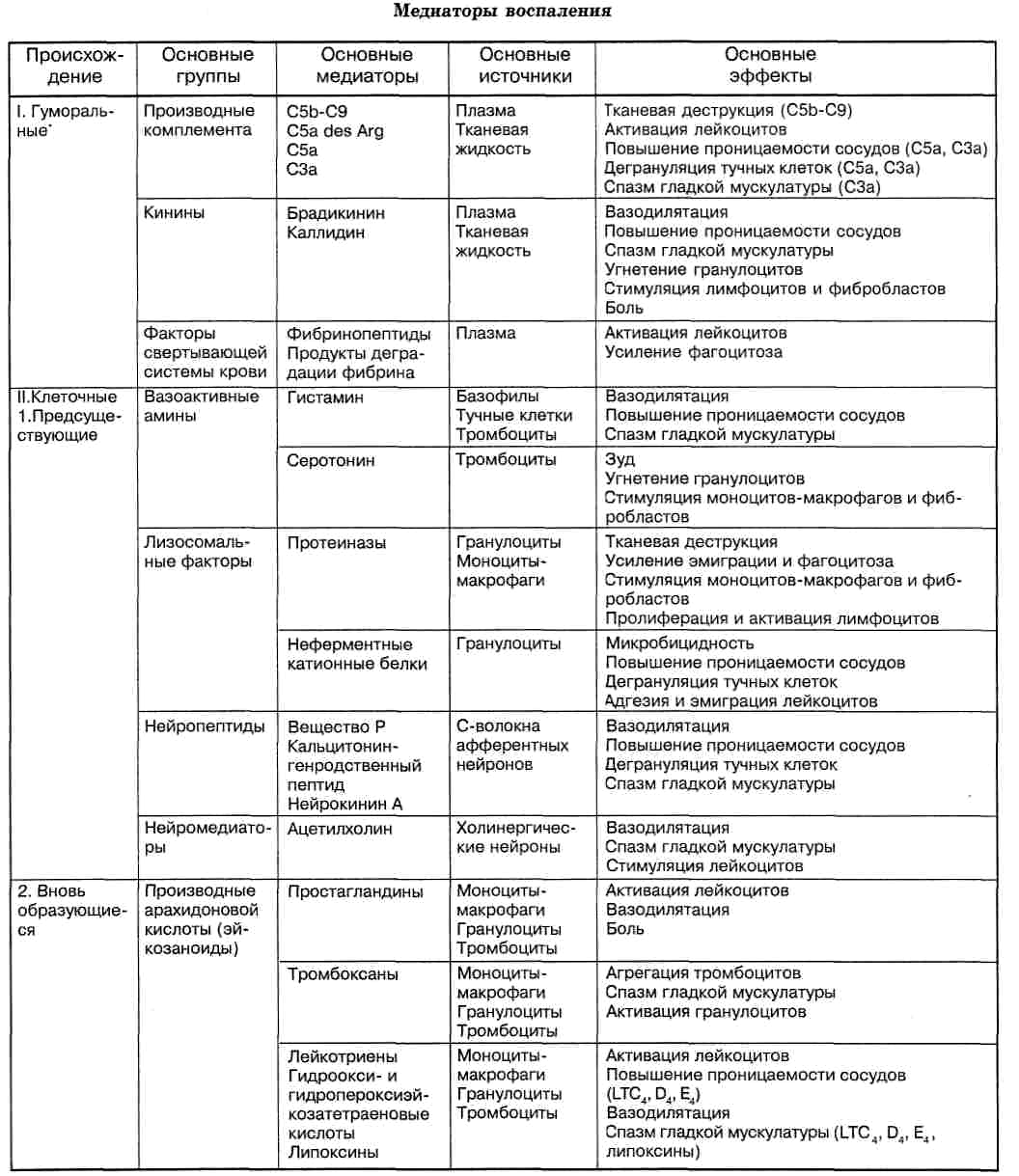

Клетки | ||
Название | Вырабатываемые | Участие |
Макрофаги: | Интерлейкин-1, | Фагоцитоз |
фиксированные | ферменты | Кооперация |
подвижные | интерферон | |
печеночные | фрагменты | |
легочные | простагландины | |
селезеночные | ингибиторы | |
Тучные | Гистамин, | Выработка |
Нейтрофилы | Фактор | Хемотаксис, |
Эозинофилы | Гистаминаза, | Деградация |
Тромбоциты | Простагландины, | Агрегация, |
Лимфоциты | Интерлейкины, | Иммунитет, |
Фибробласты | Коллаген, | Миграция, |
Медиаторы | ||
Название | Оказываемое | Происхождение |
Клеточные | ||
Гистамин | Местное | Гранулы |
Серотонин | Спазм | Тромбоциты, |
Лизосомальные | Вторичная | Гранулоциты, |
Катионные | Повышение | Нейтрофильные |
Продукты | ||
Простагландины | Проницаемость | Арахидоновая |
Тромбоксан | Агрегация | Тромбоциты |
Простациклин | Дезагрегация | Эндотелиоциты |
Лейкотриены | Хемотаксис, | Лейкоциты |
Гуморальные | ||
Кинины | Расширение | α2-глобулины |
Система | Хемотаксис, | Плазма |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
