Воспаление и иммунный ответ

Оглавление темы «Селезенка. Лимфатические узлы. Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Механизмы, контролирующие иммунную систему.»: Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Ранний защитный воспалительный ответ.Ранний защитный воспалительный ответ призван препятствовать внедрению и распространению возбудителя, по возможности быстро удалять его из организма. Ранний защитный воспалительный ответ разыгрывается в течение первых 4 сут после внедрения возбудителя. Ранний защитный ответ против внедрившихся в организм патогенных микроорганизмов обеспечивается факторами врожденного иммунитета, к которым относятся фагоцитирующие клетки крови и тканей, естественные киллеры, циркулирующие в крови белковые молекулы, обладающие защитными свойствами (компоненты системы комплемента и др.), а также межклеточные медиаторы — цитокины. Ранний воспалительный ответ стимулирует последующий специфический иммунный ответ, влияет на его форму, способствуя развитию наиболее эффективного против конкретного микроорганизма специфического иммунного ответа.
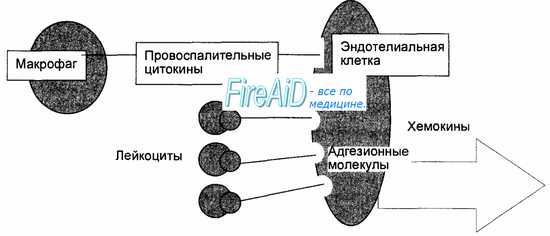
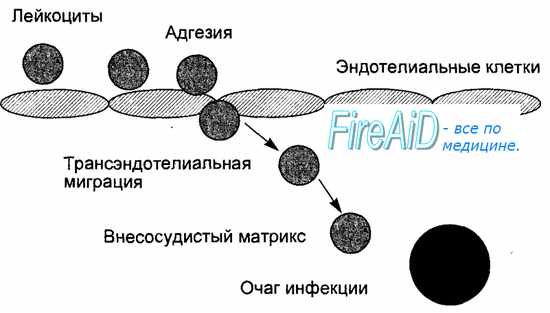
Ранний воспалительный ответ начинается с привлечения лейкоцитов из кровяного русла в очаг инфекции с последующей их активацией для удаления возбудителя (рис. 8.6). Мобилизация лейкоцитов в очаг инфекции стимулируется провоспалительными цитокинами, а опосредуется адгезионными молекулами на поверхности лейкоцитов и эндотелиальных клеток, а также молекулами хемокинов и их рецепторами. Провоспалительные цитокины (туморнекротизирующий фактор—ТНФ, интерлейкин-1 — ИЛ-1) продуцируются и секретируются макрофагами при фагоцитозе возбудителя. Под действием этих цитокинов на поверхности эндотелиальных клеток, появляются адгезионные молекулы вначале для нейтрофилов, а затем для моноцитов и лимфоцитов, ответственные за прилипание лейкоцитов к эндотелию сосудов. Кроме того, активированные цитокинами эндотелиальные клетки продуцируют хемокины, достигающие высокой концентрации на уровне очага инфекции (рис. 8.7). Этим обеспечивается прочная адгезия лейкоцитов к эндотелиальным клеткам с последующей их трансэндотелиальной миграцией и выходом в ткани в направлении очага инфекции (см. рис. 8.6). Таким образом, ранний воспалительный ответ проявляется инфильтрацией очага инфекции фагоцитирующими клетками, где эти клетки получают дополнительные сигналы активации от микробных продуктов и компонентов (липополисахарид клеточной стенки бактерий), от компонентов активированной системы комплемента и от провоспалительных цитокинов, в том числе, от гамма-интерферона, продуцируемого и секретируемого активированными естественными киллерами. Активированные фагоцитирующие клетки приобретают повышенную способность убивать захваченных микробов, что способствует удалению возбудителя. Активированные под влиянием провоспалительных цитокинов эндотелиальные клетки продуцируют молекулы вазодилататоров, под действием которых усиливается местный кровоток, повышается проницаемость сосудов для макромолекул фибриногена, который, покидая сосуды, превращается в фибрин, что способствует ограничению очага инфекции. В случае попадания в организм небольшого количества низковирулентных возбудителей ранний воспалительный ответ подавляет очаг инфекции.
Удаление из кровяного русла попавших в кровь единичных бактериальных клеток является функцией системы комплемента. Большая часть компонентов комплемента синтезируются гепатоцитами и мононуклеарными фагоцитами. Компоненты комплемента (С1, С2, СЗ, С4, С5, С6, С7, С8, С9, факторы В и D) содержатся в крови в неактивной форме. При попадании в кровяное русло бактерий на их поверхности каскад ферментативных реакций ведет к последовательной активации компонентов системы комплемента («альтернативный путь активации») с формированием мембран-атакующего комплекса (С5—С9), вызывающего лизис бактерий. В процессе активации системы комплемента накапливаются фрагменты, которые опосредуют разные биологические эффекты: привлечение лейкоцитов в очаг инфекции или воспаления (хемотаксис) — фрагмент С5а, усиление фагоцитоза (опсонизацию) — СЗb, индукцию синтеза и секреции медиаторов воспаления — С3а, С5а. (При развитии специфического иммунного ответа и появлении в кровяном русле комплексов антиген—антитело другой каскад ферментативных реакций ведет к активации системы комплемента — «классический путь активации») — Также рекомендуем «Представление антигена. Распознавание антигена. Взаимодействие Т-хелперов ( Тh1 ) с антигенпредставляющими клетками.» |
Как устроен иммунитет: Объясняем по пунктам
Наш организм непрерывно меняется, но при этом очень «любит» постоянство и может нормально работать только при определенных параметрах своей внутренней среды. Например, нормальная температура тела колеблется между 36 и 37 градусами по Цельсию. Вспомните последнюю простуду и то, как плохо вы себя чувствовали, стоило температуре подняться всего на полградуса. Такая же ситуация и с другими показателями: артериальным давлением, рН крови, уровнем кислорода и глюкозы в крови и другими. Постоянство значений этих параметров называется гомеостазом, а поддержкой его стабильного уровня занимаются практически все органы и системы организма: сердце и сосуды поддерживают постоянное артериальное давление, легкие — уровень кислорода в крови, печень — уровень глюкозы и так далее.
Иммунная же система отвечает за генетический гомеостаз. Она помогает поддерживать постоянство генетического состава организма. То есть ее задача — уничтожать не только все чужеродные организмы и продукты их жизнедеятельности, проникающие извне (бактерии, вирусы, грибки, токсины и прочее), но также и клетки собственного организма, если «что-то пошло не так» и, например, они превратились в злокачественную опухоль, то есть стали генетически чужеродными.
Как клетки иммунной системы уничтожают «врагов»?
Чтобы разобраться с этим, сначала нужно понять, как иммунная система устроена и какие бывают виды иммунитета.
Иммунитет бывает врожденным (он же неспецифический) и приобретенным (он же адаптивный, или специфический). Врожденный иммунитет одинаков у всех людей и идентичным образом реагирует на любых «врагов». Реакция начинается немедленно после проникновения микроба в организм и не формирует иммунологическую память. То есть, если такой же микроб проникнет в организм снова, система неспецифического иммунитета его «не узнает» и будет реагировать «как обычно». Неспецифический иммунитет очень важен — он первым сигнализирует об опасности и немедленно начинает давать отпор проникшим микробам.
Однако эти реакции не могут защитить организм от серьезных инфекций, поэтому после неспецифического иммунитета в дело вступает приобретенный иммунитет. Здесь уже реакция организма индивидуальна для каждого «врага», поэтому «арсенал» специфического иммунитета у разных людей различается и зависит от того, с какими инфекциями человек сталкивался в жизни и какие прививки делал.
Специфическому иммунитету нужно время, чтобы изучить проникшую в организм инфекцию, поэтому реакции при первом контакте с инфекцией развиваются медленнее, зато работают гораздо эффективнее. Но самое главное, что, один раз уничтожив микроба, иммунная система «запоминает» его и в следующий раз при столкновении с таким же реагирует гораздо быстрее, часто уничтожая его еще до появления первых симптомов заболевания. Именно так работают прививки: когда в организм вводят ослабленных или убитых микробов, которые уже не могут вызвать заболевание, у иммунной системы есть время изучить их и запомнить, сформировать иммунологическую память. Поэтому, когда человек после вакцинации сталкивается с реальной инфекцией, иммунная система уже полностью готова дать отпор, и заболевание не начинается вообще или протекает гораздо легче.
Кто отвечает за работу различных видов иммунитета?
- Костный мозг. Это центральный орган иммуногенеза. В костном мозге образуются все клетки, участвующие в иммунных реакциях.
- Тимус (вилочковая железа). В тимусе происходит дозревание некоторых иммунных клеток (Т-лимфоцитов) после того, как они образовались в костном мозге.
- Селезенка. В селезенке также дозревают иммунные клетки (B-лимфоциты), кроме того, в ней активно происходит процесс фагоцитоза — когда специальные клетки иммунной системы ловят и переваривают проникших в организм микробов, фрагменты собственных погибших клеток и так далее.
- Лимфатические узлы. По своему строению они напоминают губку, через которую постоянно фильтруется лимфа. В порах этой губки есть очень много иммунных клеток, которые также ловят и переваривают микробов, проникших в организм. Кроме того, в лимфатических узлах находятся клетки памяти — это специальные клетки иммунной системы, которые хранят информацию о микробах, уже проникавших в организм ранее.
Таким образом, органы иммунной системы обеспечивают образование, созревание и место для жизни иммунных клеток. В нашем организме есть много их видов, вот основные из них.
- Т-лимфоциты. Названы так, потому что после образования в костном мозге дозревают в вилочковой железе — тимусе. Разные подвиды Т-лимфоцитов отвечают за разные функции. Например, Т-киллеры могут убивать зараженные вирусами клетки, чтобы остановить развитие инфекции, Т-хелперы помогают иммунной системе распознавать конкретные виды микробов, а Т-супрессоры регулируют силу и продолжительность иммунной реакции.
- B-лимфоциты. Название их происходит от Bursa fabricii (сумка Фабрициуса) — особого органа у птиц, в котором впервые обнаружили эти клетки. В-лимфоциты умеют синтезировать антитела (иммуноглобулины). Это специальные белки, которые «прилипают» к микробам и вызывают их гибель. Также антитела могут нейтрализовывать некоторые токсины.
- Натуральные киллеры. Эти клетки находят и убивают раковые клетки и клетки, пораженные вирусами.
- Нейтрофилы и макрофаги умеют ловить и переваривать микробов — осуществлять фагоцитоз. Кроме того, макрофаги выполняют важнейшую роль в процессе презентации антигена, когда макрофаг знакомит другие клетки иммунной системы с кусочками переваренного микроба, что позволяет организму лучше бороться с инфекцией.
- Эозинофилы защищают наш организм от паразитов — обеспечивают антигельминтный иммунитет.
- Базофилы — выполняют главным образом сигнальную функцию, выделяя большое количество сигнальных веществ (цитокинов) и привлекая этим другие иммунные клетки в очаг воспаления.
Как клетки иммунной системы отличают «своих» от «чужих» и понимают, с кем нужно бороться?
В этом им помогает главный комплекс гистосовместимости первого типа (MHC-I). Это группа белков, которая располагается на поверхности каждой клетки нашего организма и уникальна для каждого человека. Это своего рода «паспорт» клетки, который позволяет иммунной системе понимать, что перед ней «свои». Если с клеткой организма происходит что-то нехорошее, например, она поражается вирусом или перерождается в опухолевую клетку, то конфигурация MHC-I меняется или же он исчезает вовсе. Натуральные киллеры и Т-киллеры умеют распознавать MHC-I рецептор, и как только они находят клетку с измененным или отсутствующим MHC-I, они ее убивают. Так работает клеточный иммунитет.
Но у нас есть еще один вид иммунитета — гуморальный. Основными защитниками в этом случае являются антитела — специальные белки, синтезируемые B-лимфоцитами, которые связываются с чужеродными объектами (антигенами), будь то бактерия, вирусная частица или токсин, и нейтрализуют их. Для каждого вида антигена наш организм умеет синтезировать специальные, подходящие именно для этого антигена антитела. Молекулу каждого антитела, также их называют иммуноглобулинами, можно условно разделить на две части: Fc-участок, который одинаков у всех иммуноглобулинов, и Fab-участок, который уникален для каждого вида антител. Именно с помощью Fab-участка антитело «прилипает» к антигену, поэтому строение этого участка молекулы зависит от строения антигена.
Как наша иммунная система понимает устройство антигена и подбирает подходящее для него антитело?
Рассмотрим этот процесс на примере развития бактериальной инфекции. Например, вы поцарапали палец. При повреждении кожи в рану чаще всего попадают бактерии. При повреждении любой ткани организма сразу же запускается воспалительная реакция. Поврежденные клетки выделяют большое количество разных веществ — цитокинов, к которым очень чувствительны нейтрофилы и макрофаги. Реагируя на цитокины, они проникают через стенки капилляров, «приплывают» к месту повреждения и начинают поглощать и переваривать попавших в рану бактерий — так запускается неспецифический иммунитет, но до синтеза антител дело пока еще не дошло.
Расправляясь с бактериями, макрофаги выводят на свою поверхность разные их кусочки, чтобы познакомить Т-хелперов и B-лимфоцитов со строением этих бактерий. Этот процесс называется презентацией антигена. Т-хелпер и B-лимфоцит изучают кусочки переваренной бактерии и подбирают соответствующую структуру антитела так, чтобы потом оно хорошо «прилипало» к таким же бактериям. Так запускается специфический гуморальный иммунитет. Это довольно длительный процесс, поэтому при первом контакте с инфекцией организму может понадобиться до двух недель, чтобы подобрать структуру и начать синтезировать нужные антитела.
После этого успешно справившийся с задачей B-лимфоцит превращается в плазматическую клетку и начинает в большом количестве синтезировать антитела. Они поступают в кровь, разносятся по всему организму и связываются со всеми проникшими бактериями, вызывая их гибель. Кроме того, бактерии с прилипшими антителами гораздо быстрее поглощаются макрофагами, что также способствует уничтожению инфекции.
Есть ли еще какие-то механизмы?
Специфический иммунитет не был бы столь эффективен, если бы каждый раз при встрече с инфекцией организм в течение двух недель синтезировал необходимое антитело. Но здесь нас выручает другой механизм: часть активированных Т-хелпером В-лимфоцитов превращается в так называемые клетки памяти. Эти клетки не синтезируют антитела, но несут в себе информацию о структуре проникшей в организм бактерии. Клетки памяти мигрируют в лимфатические узлы и могут сохраняться там десятилетиями. При повторной встрече с этим же видом бактерий благодаря клеткам памяти организм намного быстрее начинает синтезировать нужные антитела и иммунный ответ запускается раньше.
Таким образом, наша иммунная система имеет целый арсенал различных клеток, органов и механизмов, чтобы отличать клетки собственного организма от генетически чужеродных объектов, уничтожая последние и выполняя свою главную функцию — поддержание генетического гомеостаза.
Эта форма иммунного ответа предназначена для защиты от внутриклеточных патогенов, локализующихся в цитоплазматических гранулах — микроорганизмов, фагоцитированных клетками, но не разрушенных из-за недостатка адекватных эффекторных механизмов или их блокады патогенами. Типичные представители таких патогенов — различные виды микобактерий, а также многие простейшие (например, лейшмании, хламидии), риккетсии, плазмодии, грибы (кандиды) и др.
Клеточный иммунный ответ воспалительного типа осуществляется в 4 этапа (рис. 3.109).
- Презентация дендритными клетками антигена CD4+ Т-лимфоци- там, приводящая к их активации.
- Развитие хелперных Т-лимфоцитов типа ТЫ.
- Презентация антигена макрофагами ранее сформировавшимся Т-хелперам (ТЫ-типа), их взаимная активация и выделение цитокинов.
- Активация цитолиза в фагосомах макрофагов.
За реализцию этой формы защиты отвечают Thl-клетки и макрофаги. Thl-клетки формируются на этапе запуска иммунного ответа и отвечают за специфическую составляющую реакции (распознавание антигена и направление реакции на его носителя). Макрофаги выступают в качестве эффекторных клеток. Начальный этап реакции против внутриклеточных патогенов, локализованных в фаголизосомах, осуществляется так же, как при запуске любой формы иммунного ответа: дендритные клетки, захватившие патоген или его фрагмент, презентируют антигенный пептид CD4+ Т-клеткам, которые активируются, пролиферируют и дифференцируются в хелперные Т-лимфоциты. Уже на этапе распознавания антигена происходит ориентация дифференцировки CD4+ Т-лимфоцитов в хелперы Thl-типа, которая затем поддерживается цитокинами, продуцируемыми дендритными клетками — IL-12, IFNy (см. раздел 2.5.5.5).

Рис. 3.109. Схема развития клеточного иммунного ответа воспалительного типа
Активирующее взаимодействие Thl-клеток с макрофагами
Этот этап характерен именно для воспалительного иммунного ответа. Он состоит во взаимодействии специфических TM-клеток с макрофагами, которые содержат на своей поверхности молекулы MHC-II, несущие пепидный фрагмент антигена. При взаимодействии формируется иммунный синапс. В результате генерируются активирующие сигналы, направленные как в ТЫ-клетку, так и в макрофаг. В TW-лимфоцит сигналы поступают через молекулы TCR/CD4 и CD28. В результате этой повторной стимуляции Т-клетки (первая стимуляция была вызвана презентацией антигена дендритной клеткой) происходит усиление выработки цитокинов, важных для реализации последующих событий (в частности IFNy и TNFa).
Стимуляция макрофага при взаимодействии с TW-клеткой реализуется с помощью двух механихмов (рис. 3.110). Один из них — контактный — через костимулирующую молекулу CD40, с которой связывается ее лиганд CD154. CD40 спонтанно экспрессируется макрофагами, тогда как ее лиганд появляется на поверхности TM-клеток в результате активации при формировании иммунного синапса. В передаче сигнала от молекулы CD40 участвуют адапторные факторы TRAF-1, TRAF-2, TRAF-6. В результате происходят активация фактора NF-kB и запуск Rac-зависимой ветви MAP-каскада, завершающейся формированием транскрипционного фактора с-Jun. Второй механизм активации опосредуется IFNy. При связывании этого цитокина с рецептором включается сигнальный путь, вовлекающий киназы Jak1 и Jak2, транскрипционный фактор STAT1, а также дополнительные пути с участием MAP-каскада.
Результат активации макрофагов — экспрессия многочисленных генов, приводящая к повышению содержания на поверхности клетки молекул MHC-I и особенно MHC-II, сборке NADPH-оксидазы, активации ферментов окислительного метаболизма. Наиболее специфичное проявление ответа макрофагов на стимулирующее действие IFNy — экспрессия гена индуцибельной NO-синтазы. Именно NO и его производные, такие

Рис. 3.110. Активация макрофагов Т-хелперами. Показаны механизмы воздействия Thl-клеток на макрофаги (контактный и опосредованный цитокинами), а также индуцируемые Т-клетками проявления активации макрофагов
как пероксинитрит (ОО*NO), вызывают гибель микобактерий и других внутриклеточных патогенов, сохранявшихся и даже размножавшихся в фагосомах. Все эффекты IFNy, в том числе способность индуцировать образование NO-синтазы, усиливаются TNFa, продуцируемым как Th1- клетками, так и самими макрофагами. Эффективность действия цитокинов, вырабатываемых TM-клетками, существенно повышается в связи с сосредоточением их секреции в области контакта с макрофагами. Это, кроме того, уменьшает активацию посторонних клеток и их повреждение. Для обеспечения этой ориентированной секреции необходима поляризация клеток в ходе формирования иммунного синапса.
Особого внимания заслуживает взаимодействие цитокинов IL-12 и IFNy при воспалительном иммунном ответе (рис. 3.111). Экспрессия IL-12 в макрофагах индуцируется при связывании PAMP с TLR. Экспрессия гена IL12 — один из результатов сигнального пути, вовлекающего адапторный белок MyD88 и транскрипционный фактор NF-kB. IL-12 играет решающую роль в индукции дифференцировки TM-клеток и стимулирует выработку этими клетками IFNy, один из важнейших эффектов которого — усиление выработки макрофагами IL-12. Таким образом, эти цитокины вместе с рецепторами и сигнальными путями, ответственными за экспрессию их генов, образуют единую функциональную систему, которой принадлежит ключевая роль в реализации воспалительной формы клеточного иммунного ответа. Дефекты в любом звене этой системы приводят к развитию иммунодефицитов, сопровождающихся повышенной чувствительностью к микобактериям и другим патогенам, в ответ на которые вовлечены ТЫ-клетки и макрофаги.
Воспалительная составляющая Thl-клеточного иммунного ответа
В отличие от цитотоксического иммунного ответа, не связанного очевидным образом с воспалительной реакцией, иммунный ответ, опосредованный TW-клетками, полностью реализуется в ее рамках. Запуск ответа происходит по классической схеме. В очаге инфицирования (обычно в

Рис. 3.111. Роль интерферона у в дифференцировке и реализации функций Т-хел- перов. Интерферон у, продуцируемыйклеткамиврожденногоиммунитета, определяет направление развития адаптивного иммунного ответа, в ходе которого он также секретируется Thl-клетками и активирует основные эффекторы воспалительной формы клеточного ответа — макрофаги
барьерных тканях) дендритные клетки поглощают патоген или его фрагмент и транспортируют его в региональный лимфатический узел или иные вторичные лимфоидные органы. Дифференцировавшиеся специфические ХЫ-клетки поступают в рециркуляцию. Подобно цитотоксическим Т-лимфоцитам, они утрачивают мембранные молекулы, направляющие их миграцию в лимфоидные органы (CD62L, CCR7) и приобретают обычные свойства эффекторных клеток, включая усиленную экспрессию мембранных интегринов (LFA-1, VLA-4) и рецепторов для хемокинов, секретируе- мых в очагах воспаления и барьерных тканях (для Thl-клеток — CXCR3, CCR5, CCR2 и др.).
Оказавшись в очагах инфицирования, Thl-клетки в кооперации с макрофагами осуществляют реакции, описанные выше. В результате взаимодействия этих клеток, особенно действия IFNy, происходит максимально выраженная активация макрофагов. Эта активация результативна с точки зрения защиты от внутриклеточных патогенов, но деструктивна для окружающих тканей. Активированные макрофаги выделяют весь спектр своих секреторных продуктов. Он включает разнообразные провоспалительные факторы и факторы бактерицидности. К последним относят активные формы кислорода, их галоидные производные, оксид азота и его дериваты, ферменты и т.д. Среда в окружении таких клеток закисляется. Поскольку контакт макрофагов с Thl-клетками к этому моменту прекращается, секреция уже не носит ориентированного характера. Выделяемые молекулы выступают как факторы внеклеточной
микробицидности и одновременно вызывают повреждение окружающих нормальных клеток организма. Таким образом, продукты Th1-клеток дополнительно усиливают воспалительную реакцию, в то же время придавая ей специфичность в отношении конкретных возбудителей.
Вариант воспаления, реализуемый с участием Th1-клеток, называют иммунным воспалением, а сам Th1-клеточный иммунный ответ носит название воспалительного клеточного иммунного ответа. В рамках этой формы иммунного ответа особенно ярко проявляется соотношение факторов врожденного и адапативного иммунитета: эффекторным механизмом служит типичная реакция врожденного иммунитета — фагоцитоз, однако он усиливается и приобретает специфичность в отношении конкретных антигенов благодаря вовлечению в реакцию клеток адаптивного иммунитета.
Гранулема

При неэффективном клеточном ответе воспалительного типа, т.е. в случаях, когда разрушения и переваривания внутриклеточных патогенов не происходит, формируется гранулема (рис. 3.112). Гранулема представляет собой морфологическую структуру округлой формы, в центре которой расположены инфицированные макрофаги, а также клеточный детрит и патогены, освободившиеся в результате разрушения макрофагов. Вследствие слияния макрофагов образуются гигантские многоядерные клетки. Некоторые макрофаги претерпевают морфологические изменения, приобретая фенотип так называемых эпителиоидных клеток. Периферическая часть гранулемы образована активированными макрофагами, лишенными патогенов, и Т-лимфоцитами (преимущественно TM-клетками). Т-клетки постоянно
перемещаются, причем эта подвижность важна для сохранения структурной целостности гранулемы. Формирование гранулемы сопряжено с деструкцией ткани и нарушением функционирования большого участка пораженных органов (например, легких при туберкулезе), что делает ее патологическим образованием. С другой стороны, гранулема представляет способ изоляции патогена, с уничтожением которого иммунная система не справляется, и в этом смысле выступает как защитное приспособление организма.
Эффекторные реакции, опосредованные ТН2-клетками
^2-клетки участвуют в эффекторных реакциях, направленных на защиту от многоклеточных паразитов. Эти реакции изучены пока крайне мало. При этом, подобно TM-клеткам, ^2-лимфоциты вовлекают в защитную реакцию клетки миелоидного ряда. В отличие от реакций, опосредованных TW-клетками, эти клетки представлены не макрофагами, а эозинофилами и тучными клетками.
Роль ^2-клеток в этих процессах в значительной степени состоит в секреции цитокинов: IL-4, IL-5, IL-13, IL-9, IL-3 и GM-CSF. Каждый из них в той или иной степени участвует во взаимодействии с исполнительными клетками. Основную роль при этом играет IL-5. Этот цитокин служит фактором выживания эозинофилов, поддерживает их развитие и привлекает эти клетки в очаг поражения. Эозинофилы инфильтрируют ткань вокруг паразита и выделяют продукты своих гранул, из которых главный белок эозинофилов (MBP), пероксидаза эозинофилов (EPO) и катионный белок эозинофилов (ECP) обладают цитопатогенной активностью в отношении клеток гельминтов и других макропаразитов.
Вспомогательную роль в подобных реакциях играют антитела класса IgE. Полагают, что этот минорный класс иммуноглобулинов, известный как ключевой фактор аллергии немедленного типа, предназначен для осуществления антипаразитарной защиты. Помимо прямого блокирующего действия на паразитов, IgE способен «армировать» макрофаги, связываясь с высокоаффинными FceRI-рецепторами на их поверхности, что придает прицельность действию макрофагов и служит дополнительным фактором их активации.