Воспаление механизм воспаления тучные клетки
Тучные клетки (мастоциты) и идентичные им базофилы периферической крови и костного мозга в ответ на ряд стимулов выделяют значительное количество медиаторов воспаления. Эти медиаторы имеют несомненное физиологическое значение, способствуя ограничению или устранению вредных факторов, воздействующих на организм.
Однако роль медиаторов тучных клеток в патологии человека представляется более яркой (возможно, потому, что их защитные функции недостаточно выяснены). При анализе данной системы при ревматических заболеваниях следует учитывать, что тучные клетки представлены в синовиальных тканях суставов в сравнительно большем количестве, составляя 3% от числа всех нормальных синовиальных клеток.
Наиболее известный медиатор воспаления тучных клеток гистамин, способный приводить к быстрому повышению капиллярной проницаемости. Как и большинство других медиаторов этих клеток, он содержится в базофильных гранулах в неактивной форме, но после адекватной стимуляции и дегрануляции клеток выделяется во внеклеточное пространство как активное вещество.
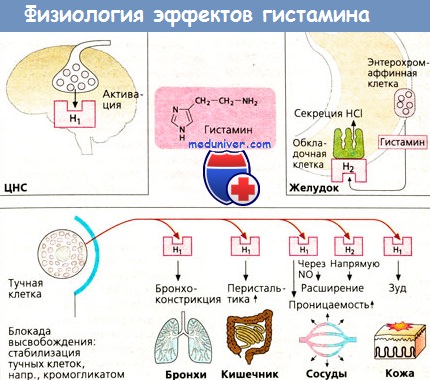
Эффекты гистамина, как указывалось выше, способствуют развитию первой (экссудативной) фазы воспаления. Весьма интересным оказалось открытие двух типов рецепторов гистамина в тканях, а тем самым и своеобразной двойственности действия этого вещества. Выяснилось, что воспалительная реакция является результатом воздействия гистамина на рецепторы первого типа (H1-рецепторы) .
В то же время его влияние на рецепторы второго типа (Н2-рецепторы) приводит к накоплению в клетках циклического аденозинмонофосфата (цАМФ) и тем самым к некоторому противовоспалительному эффекту с ограничением дальнейшего освобождения гистамина и других медиаторов; одновременно тормозится также иммунная активность Т-лимфоцитов. В суммарном действии гистамина, наблюдаемом в клинических условиях, преобладает его влияние на H1-рецепторы с развитием элементов воспаления типа крапивницы или отека Квинке. .
Стимулированные тучные клетки выделяют также несколько веществ, вызывающих хемотаксис как нейтрофилов, так и эозинофилов, что способствует привлечению этих клеток в очаг воспаления. Эти факторы хемотаксиса весьма разнообразны химически: среди них имеются белки, липиды, а один из эозинофильных хемотаксических факторов (так называемый фактор А) представляет собой простой полипептид, состоящий всего из 4 аминокислот.
К другим воспалительным медиаторам, содержащимся в тучных клетках, относятся простагландины, протеолитический фермент химаза и фактор, активирующий тромбоциты. Существенное значение придается фактору, называемому медленно действующим веществом анафилаксии — SRSA (от англ. slow reacting substance of anaphylacsys). Это вещество обладает патофизиологическими свойствами гистамина, но в отличие от последнего действует более длительно и не тормозится антигистаминными препаратами.
Важной особенностью SRSA является его возникновение только после иммунной стимуляции тучных клеток; в нестимулированных клетках это вещество не обнаруживается, что также отличает его от гистамина. За последние годы было установлено, что SRSA относится к лейкотриенам — мощным противовоспалительным агентам, синтезируемым из арахидоновой кислоты под влиянием фермента липоксигеназы. Действие SRSA (лейкотриена С) угнетается ферментом арилсульфатазой, содержащейся в эозинофилах. В последних имеется также фермент гистаминаза, инактивирующая гистамин.
Данные факты, по-видимому, отчасти объясняют местную и общую эозинофилию, наблюдаемую при активировании системы тучных клеток и трактуемую, таким образом, как компенсаторный феномен. Освобождение гистамина и других медиаторов воспаления из тучных клеток с соответствующими сосудистыми реакциями в определенной степени происходит даже при небольшой местной травматизации у здоровых людей. Однако основным механизмом, который приводит к активации (и соответственно дегрануляции) тучных клеток, является иммунный, связанный с образованием циркулирующих антител, относящихся к классу IgE.
Эти антитела фиксируются на поверхности тучных клеток, которые имеют к ним специальные рецепторы. При последующем поступлении в организм соответствующего антигена последний реагирует с IgE, изменяя микроконфигурацию поверхности тучных клеток, что служит стимулом к их дегрануляции и поступлению медиаторов воспаления во внеклеточное пространство. Этот процесс лежит в основе первого (анафилактического) типа иммунных повреждений тканей (см. ниже).
Очень важно иметь в виду, что дегрануляция тучных клеток в ряде случаев происходит под влиянием неиммунных стимулов. К ним относятся фрагменты 3 и 5 компонентов комплемента (С3а и С5а), брадикинин, лекарственные препараты (в частности, рентгеноконтрастные, опиаты, кураре), некоторые полипептиды из лейкоцитов крови, инфильтрирующих очаги воспаления. Поэтому по крайней мере у некоторых больных клинические признаки, неотличимые от классических проявлений аллергии анафилактического типа (крапивница, астмоидный синдром), могут быть не связаны с образованием IgE.
До последнего времени полагали, что воспаление, связанное с активацией системы тучных клеток, является весьма кратковременным, поскольку его главным медиатором считается гистамин, которому действительно свойственны относительно быстро преходящие эффекты. Однако после открытия SRSA и содержащихся в тучных клетках хемотаксических факторов стала ясной возможность хронизации воспаления, связанного с активированием мастоцитов. Это подтверждается клиническими наблюдениями.
В частности, при таком типичном заболевании, связанном с IgE, как аллергический ринит, хорошо известно хроническое течение с выраженным пролиферативным компонентом, проявляющимся в полипозе слизистой оболочки носа. Поэтому нельзя исключить, что персистирующая дегрануляция тучных клеток может играть определенную роль и в поддержании хронического течения артритов (учитывая обилие мастоцитов в синовиальных тканях).
Для регуляции гомеостаза важно содержание в мастоцитах не только целого набора медиаторов воспаления, но и гликозаминогликана гепарина, обладающего слабым противовоспалительным и иммунодепрессивным свойством. Эти его свойства используются и в клинической практике.
Опубликовал Константин Моканов
Тучные клетки и гистамин. Роль гистамина в воспалении бронхов.Тучные клетки бывают разных видов и от этого зависят морфологические изменения, сопровождающие их дегрануляцию: если в коже тучные клетки выделяют интактные гранулы, которые могут быть фагоцитированы фибробластами, то в легких гранулы тучных клеток растворяются внутриклеточно, и часть мембран гранул вместе с клеточной мембраной формируют каналы, через которые содержимое гранул выделяется наружу. Специфические морфологические, биохимические и функциональные черты тучных клеток диктуются специфическим микроокружением: так, тучные клетки кожи после стимуляции морфином in vitro выделяют медиаторы воспаления, а тучные клетки легких, сердца и желудочно-кишечного тракта — нет. Конечно, гетерогенность тучных клеток выходит далеко за рамки ответа на опиаты. Кроме антигензависимой дегрануляции тучных клеток, связанной с реакцией ГНТ, существует большое количество либераторов гистамина (токсины, ферменты, лекарства, различные макромолекулы и др.), вызывающих дегрануляцию тучных клеток неиммунологическим путем. Гистамин считается своеобразным маркером тучной клетки, но последняя выделяет большое количество медиаторов, среди которых лейкотриены С4, Д4, Е4, простагландин Д гепарин, триптаза, причем не исключается, что гистамин и другие цитокины играют роль в генезе хронического воспаления при БА, выделяясь в небольшом количестве даже в фазе ремиссии. Имеются данные об активации тучноклеточной триптазой латентной коллагеназы, что, в итоге, приводит к повреждению соединительной ткани легких. Не исключено, что различные стимуляторы выделения БАВ, воздействуя на тучные клетки, могут избирательно потенцировать выделение или синтез de novo тех или иных медиаторов: так, местное воздействие на слизистую бронхов аденозинмонофосфата достоверно повышает выделение тучными клетками вторичного медиатора-простагландина Д2, но не первичных медиаторов (гистамина и триптазы).
Выделены разные группы больных атопической БА с одинаково повышенным уровнем гистамина и достоверно отличавшихся по уровню гистаминазы; причем эти группы больных отличались также по клинической картине болезни; больные с более высокой активностью гистаминазы были старше, имели более длительный анамнез заболевания и более тяжелое его течение. Участие гистамина в патологических процессах в легких, как органе-мишени, не всегда сопровождается повышением уровня гистамина в крови. Показано, что в ряде случаев уровень гистамина крови после провокации аллергеном был тем меньше, чем большей была гиперреактивность бронхов. Найдено повышение содержания гистамина в конденсате влаги выдыхаемого воздуха и в мокроте больных БА и хроническим бронхитом. В.А. Гончарова и соавт. считают, что из целого ряда БАВ, выявленных в конденсате влаги выдыхаемого воздуха (серотонин, гистамин, ацетилхолин, катехоламины), у больных БА наиболее информативно повышение уровня гистамина. У больных БА с хроническим бронхитом в ряде случаев продуцентами гистамина могут быть содержащиеся в бронхиальном дереве различные бактерии, а не тучные клетки. Вместе с тем, выделяющийся в легких свободный гистамин ответственен за начало ранней стадии воспаления. У больных БА гистамин не является, возможно, главным медиатором, но все же принимает участие в развитии отека слизистой и бронхоспазма. У некоторых больных гистамин реализует свое действие не только прямым влиянием на бронхи, но также путем усиления генерации фагоцитами активных форм кислорода. Активация тучных клеток может зависеть от тяжести течения БА. Rankin J. et al. не нашли повышения уровня гистамина в содержимом бронхоальвеолярного лаважа у больных легкой БА, в отличие от больных тяжелой БА. Гистамин повышает капиллярную проницаемость, повреждает капиллярную стенку и усиливает деполимеризацию основного вещества соединительной ткани. Получены данные о повышении гистамином посткапиллярного сопротивления на фоне относительно постоянного значения сопротивления артериальной части сосудистого русла, что приводит к росту капиллярного гидростатического давления и усилению процессов фильтрации в легочный интерстиций. Действуя на Н1-рецепторы бронхов гистамин вызывает бронхоконстрикцию, а действие гистамина на Н1-рецепторы сосудов малого круга вызывает их сужение. Повышение давления в системе легочной артерии под влиянием гистамина связано с увеличением проницаемости гладкомышечных клеток для внеклеточного кальция и мобилизации внутриклеточного кальция. Возможно, легочная гипертензия, возникающая при гипоксической гипоксии, опосредуется тучными клетками, выделяющими гистамин. Гистамин модулирует активность многих клеток, принимающих участие в иммунном воспалении, и оказывает влияние на клеточные иммунные реакции. Через Н1-рецепторы реализуется провоспалительный эффект гистамина, а все ингибирующие эффекты гистамина на функцию лимфоцитов и противовоспалительное действие реализуются через Н2-рецепторы, и не исключается, что одновременная стимуляция Н1 и Н2-рецепторов на иммунокомпетентных клетках приводит к развитию супрессорной активности, а дефект Н2-рецепторов при аллергических заболеваниях может иметь генерализованный характер и приводить к повышению функциональной активности Н1-рецепторов, усилению воспалительных реакций и увеличению выхода гистамина из тучных клеток. Высказывается предположение, что в ряде случаев для больных БА повышенный уровень гистамина может иметь положительное значение: благодаря существованию двух функционально противоположных типов гистаминовых рецепторов гистамин через отрицательную обратную связь играет роль ограничителя аллергического воспаления, а патологические изменения, вызванные гистамином, возникают лишь при нарушении гомеостатического механизма регуляции через систему Н1 и Н2-рецепторов, т.е. при сдвиге механизмов контроля. Считается, что у больных аллергическими болезнями, в том числе при БА, гистамининдуцированная супрессия иммунного ответа нарушается из-за уменьшения Н2-позитивных Т-лимфоцитов, вырабатывающих HSF (гистамин-индуцированный фактор супрессии). Несмотря на многообразие действия гистамина и его роль «маркера» тучных клеток, не всегда просто выяснить его значение в патогенезе легочных заболеваний, поскольку в организме гистамин высвобождается при любой травме и находится также вне тучных клеток, являясь постоянной составной частью почти всех органов, тканей, жидких сред и выделений. Помимо тучных клеток, существенную роль в выделении гистамина могут играть базофилы, различающиеся по своей плотности и наличию в них гистамина: несмотря на небольшое содержание в крови, базофилы могут становиться многочисленными в зоне воспаления и играть важную роль в поздней фазе аллергических реакций, а также получены данные о повышенном выходе гистамина из базофилов под действием ФАТ. Существенная роль в генезе различных видов воспаления взаимодействия «тучная клетка — эозинофил» дополняется не менее важной осью «тучная клетка — нейтрофил»: медиаторы тучных клеток влияют на выделение нейтрофилами свободных радикалов кислорода, а активированные нейтрофилы стимулируют выделение гистамина из тучных клеток. Сейчас считается, что тучные клетки играют центральную роль в возникновении бронхообструкции в течение ранней астматической реакции, выделяя гистамин, простагландин Д2, цистеиновые ЛТ, ферменты (триптаза, протеаза), не только вызывающие спазм гладкой мускулатуры бронхов, но также влияющие на сосудистую проницаемость, усиливающие деятельность железистого аппарата бронхов, и разрыхляющие соединительнотканный матрикс. Привлечение различными тучноклеточными медиаторами, такими как ИЛ-3, ИЛ-4, ИЛ-5, нейтрофильный хемотаксический фактор, ФАТ, гранулоцитарно-макрофагальный колониестимулирующий фактор других клеток воспаления, приводит к развитию персистирующей воспалительной реакции в бронхах больных БА, что типично для хронического течения этой болезни, а активация протеазами тучных клеток разных коллагеназ приводит к нарушениям соединительной ткани и способствует не только хронизации воспаления, но и формированию необратимых морфологических изменений. — Также рекомендуем «Эйкозаноиды. Воспаление бронхов и выделение эйкозаноидов.» Оглавление темы «Воспаление бронхов.»: |
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 30 июля 2020; проверки требует 1 правка.
Воспале́ние (лат. inflammatio) — это комплексный, местный и общий патологический процесс, возникающий в ответ на повреждение (alteratio) или действие патогенного раздражителя и проявляющийся в реакциях, направленных на устранение продуктов, а если возможно, то и агентов повреждения (exudatio и др.) и приводящий к максимальному восстановлению в зоне повреждения (proliferatio).
Воспаление — защитно-приспособительный процесс.
Воспаление свойственно человеку и животным, в том числе низшим животным и одноклеточным организмам в упрощённом виде[1]. Механизм воспаления является общим для всех организмов, независимо от локализации, вида раздражителя и индивидуальных особенностей организма.
История[править | править код]
Уже в древние времена внешние признаки воспаления описал римский философ и врач Авл Корнелий Цельс (ок. 25 до н. э. — ок. 50 н. э.):
- лат. rubor — краснота (местное покраснение кожных покровов или слизистой).
- tumor — опухоль (отёк).
- calor — жар (повышение местной температуры).
- dolor — боль.
Дополнил Гален (129 — ок. 200 гг. н. э.), добавив - functio laesa — нарушение функции.
В конце XIX столетия И. И. Мечников считал, что воспаление — это приспособительная и выработанная в ходе эволюции реакция организма и одним из важнейших её проявлений служит фагоцитоз микрофагами и макрофагами патогенных агентов и обеспечение таким образом выздоровления организма. Но репаративная функция воспаления была для И. И. Мечникова сокрыта. Подчеркивая защитный характер воспаления, он в то же время полагал, что целительная сила природы, которую и представляет собой воспалительная реакция, не есть еще приспособление, достигшее совершенства. По мнению И. И. Мечникова, доказательством этого являются частые болезни, сопровождающиеся воспалением, и случаи смерти от них[2].
Большой вклад в изучение воспаления внесли Джон Хантер (1728—1794), Франсуа Бруссе (1772—1838), Фридрих Густав Якоб Генле (1809—1885), Симон Самуэль (1833—1899), Юлиус Фридрих Конхайм (1839—1884), Алексей Сергеевич Шкляревский, (1839—1906), Рудольф Вирхов (1821—1902), Пауль Эрлих (1854—1915), Илья Ильич Мечников (1845—1916).
Этиология[править | править код]
Патогенные раздражители (повреждающие факторы) по своей природе могут быть:
- Физическим — травма (механическое повреждение целостности ткани), отморожение, термический ожог.
- Химическими — щелочи, кислоты (соляная кислота желудка), эфирные масла, раздражающие и токсические вещества (алкоголь (спирты) и некоторые лекарственные препараты[3], см. Токсические гепатиты).
- Биологическими — возбудители инфекционных заболеваний: животные паразиты, бактерии, вирусы, продукты их жизнедеятельности (экзо- и эндотоксины). Многие возбудители вызывают специфические воспаления, характерные только для определённого вида инфекции (туберкулёз, лепра, сифилис). К биологическим повреждающим факторам также относят иммунные комплексы, состоящие из антигена, антитела и комплемента, вызывающие иммунное воспаление (аллергия, аутоимунный тиреодит, ревматоидный артрит, системный васкулит). При аллергии не указан следующий механизм неинфекционного воспалительного ответа. Не берется во внимание, что любая аллергическая реакция приводит к повреждению тканей. Что при определенных условиях, когда происходит сенсибилизация организма больного (выработка иммуноглобулина Е) и прикрепление его на внутренней поверхности кровеносных сосудов будущих органов-мишеней, которые повреждаются аллергическими реакциями немедленного типа в результате выхода «медиаторов воспаления». (Аллергология и иммунология: национальное руководство под ред. Р.М. Хаитова, Н.И. Ильиной.- М. ГЭОТАР-МЕДИА, 2009.-656 с.- ISBN 978-5- 9704-0903-9/
Клиника и патогенез[править | править код]
Клинические симптомы воспаления:
- Покраснение (гиперемия).
- Местное повышение температуры (гипертермия).
- Отёк (ацидоз способствует диссоциации солей и распаду белков, что приводит к повышению осмотического и онкотического давления в повреждённых тканях, приводящему к отёкам).
- Боль.
- Нарушение функции.
Процесс воспаления делят на три основных стадии:
- Альтерация — повреждение клеток и тканей.
- Экссудация — выход жидкости и клеток крови из сосудов в ткани и органы.
- Пролиферация (или продуктивная стадия) — размножение клеток и разрастание ткани, в результате чего и происходит восстановление целостности ткани (репарация).
Альтерация[править | править код]
Альтерация (позднелат. alteratio, изменение[4]) — стадия начала воспаления. Патогенный раздражитель, воздействуя на ткани организма, вызывает первичную альтерацию — повреждение и последующий некроз клеток. Из лизосом погибших клеток (в том числе гранулоцитов) высвобождаются многочисленные ферменты (влияющие на белки и пептиды, липиды, углеводы, нуклеиновые кислоты), которые изменяют структуру и нарушают нормальный обмен веществ окружающей очаг воспаления соединительной ткани и сосудов (вторичная альтерация).
В зоне первичной альтерации интенсивность метаболизма снижена, так как функции клеток нарушены, а в зоне вторичной альтерации повышена, в основном за счёт обмена углеводов (в том числе гликолиза полисахаридов). Повышается потребление кислорода и выделение углекислоты, однако потребление кислорода превышает выделение углекислоты, так как окисление не всегда проходит до окончательного образования углекислого газа (нарушение цикла Кребса). Это приводит к накоплению в зоне воспаления недоокисленных продуктов обмена, имеющих кислую реакцию: молочной, пировиноградной, L-кетоглутаровой и др. кислот. Нормальный уровень кислотности ткани с pH 7,32—7,45 может повышаться до уровня 6,5—5,39 (при остром гнойном воспалении), возникает ацидоз[5].
На месте повреждения расширяются сосуды, вследствие чего увеличивается кровоснабжение, происходит замедление кровотока и как следствие — покраснение, местное повышение температуры, затем увеличение проницаемости стенки капилляров ведёт к выходу лейкоцитов, макрофагов и жидкой части крови (плазмы) в место повреждения — отёк, который в свою очередь сдавливая нервные окончания вызывает боль и всё вместе — нарушение функции. Воспаление регулируют медиаторы воспаления — гистамин, серотонин, непосредственное участие принимают цитокины — брадикинин, калликреин (см. Кинин-калликреиновая система), IL-1 и TNF, система свёртывания крови — фибрин, фактор Хагемана, система комплемента, клетки крови — лейкоциты, лимфоциты (Т и В) и макрофаги. В повреждённой ткани усиливаются процессы образования свободных радикалов.
Механизмы возникновения воспаления[править | править код]
Митохондриально-зависимый механизм[править | править код]
Из-за повреждения клеток при травме, митохондриальные белки и мтДНК попадают в кровоток. Далее эти митохондриальные молекулярные фрагменты (DAMPs) распознаются Толл-подобными (TLRs) и NLR рецепторами. Основным NLR-рецептором участвующим в процессе является рецептор NLRP3. В нормальном состоянии белки NLRP3 и ASC (цитозольный адаптерный белок) связаны с ЭПР, при этом белок NLRP3 находится комплексе с белком TXNIP. Активация рецепторов приводит к их перемещению в перинуклеарное пространство, где под действием активных форм кислорода, вырабатываемых поврежденными митохондриями, белок NLRP3 высвобождается из комплекса.[6] Он вызывает олигомеризацию белка NLRP3 и связывание ASC и прокаспазы-1, образуя формирование белкового комплекса называемого NLRP3 инфламмасомой. Инфламмасома вызывает созревание провоспалительных цитокинов, таких как IL-18 и IL-1beta и активирует каспазу-1. (3) Провоспалительные цитокины также могут запускать NF-kB пути воспаления, повышая длительность и уровень воспаления. Также для активации NLRP3 инфламмасомы необходима пониженная внутриклеточная концентрация K+, что обеспечивание калиевыми каналами митохондрий.
Механизм возникновения воспаления через NF-κB сигнальный путь[править | править код]
Классификация[править | править код]
По продолжительности:
- Острое воспаление — длится несколько минут или часов.
- Подострое — несколько дней или недель.
- Хроническое — длится от нескольких месяцев до пожизненного с моментами ремиссии и обострения.
По выраженности реакции организма:
- Нормоэргическое воспаление — адекватная реакция организма, соответствующая характеру и силе воздействия патогенного раздражителя.
- Гиперэргическое — значительно повышенная реакция.
- Гипоэргическое (от гипоэргия[4]) и аноэргическое — слабая или отсутствующая реакция (у пожилых людей (старше 60-ти), при недостаточном питании и авитаминозе[7], у ослабленных и истощённых людей).
По локализации:
- Местное воспаление — распространяется на ограниченный участок ткани или какой-либо орган.
- Системное — распространяется на какую-либо систему организма (систему соединительной ткани (ревматизм), сосудистую систему (системный васкулит)[7]).
Формы воспаления[править | править код]
- Альтеративное воспаление (в настоящее время отвергается)
- Экссудативное воспаление
- Серозное
- Фибринозное
- Дифтеритическое
- Крупозное
- Гнойное
- Гнилостное
- Геморрагическое
- Катаральное — с обильным выделением слизи или мокроты.
- Смешанное
- Пролиферативное воспаление
- Гранулематозное воспаление
- Межуточное (интерстициальное) воспаление
- Воспаление с образованием полипов и остроконечных кондилом
- Воспаление вокруг животных-паразитов и инородных тел (холангит, урертрит, киста)
- Специфическое воспаление — развивается при таких заболеваниях как туберкулёз, сифилис, лепра, сап, склерома[8].
Диагностика[править | править код]
Клинический анализ крови: увеличивается скорость оседания эритроцитов (СОЭ), лейкоцитоз, изменяется лейкоцитарная формула.
Биохимический анализ крови: при остром воспалении повышается количество C-реактивного белка (белок острой фазы), α- и β-глобулинов, при хроническом воспалении — γ-глобулинов; снижается содержание альбуминов[9].
Терминология[править | править код]
Термины воспалений чаще всего являются латинскими существительными третьего склонения греческого происхождения, состоящие из корневого терминоэлемента, обозначающего название органа, и суффикса -ītis (-ит). Примеры: gaster (греч. желудок) + -ītis = gastrītis (гастрит — воспаление слизистой желудка); nephros (греч. почка) + -ītis = nephrītis (нефрит)[10].
Исключения составляют устоявшиеся старые названия воспалительных заболеваний: пневмония (греч. pneumon, лёгкое), ангина — воспаление миндалин, панариций — воспаление ногтевого ложа пальца и др[1].
Так как воспаление — это естественная реакция здоровой ткани на повреждение, его не совсем уместно называть «патологическим» процессом. Термин «патологический» будет оправдано применять только к отклонениям от нормального протекания реакции защиты, которые не приводят к нужному конечному результату[11].
См. также[править | править код]
- Гомеостаз
- Инфламмасома
Примечания[править | править код]
- ↑ 1 2 Пауков, Хитров, 1989, с. 98.
- ↑ А.И. Струков, В.В. Серов. Патологическая Анатомия. — 5-е издание. — 2010. — С. 169. — 848 с. — ISBN 978-5-904090-63-0.
- ↑ Серов, Пауков, 1995, с. 506.
- ↑ 1 2 Советский энциклопедический словарь / Гл. ред. А.М. Прохоров. — 4-е изд. — М.: Советская энциклопедия, 1988. — 1600 с.
- ↑ Тель, Лысенков, 2007.
- ↑ Mitochondria: Sovereign of inflammation?.
- ↑ 1 2 Барышников, 2002, с. 58.
- ↑ Пауков, Хитров, 1989, с. 106—112.
- ↑ Пауков, Хитров, 1989, с. 105.
- ↑ Городкова Ю.И. Латинский язык. — М.: Кнорус, 2015. — С. 124—125. — 256 с.
- ↑ Шилов В. Н. (2006) Молекулярные механизмы структурного гомеостаза. Москва, издательство «Интерсигнал». 286 с., с. 238.
Литература[править | править код]
- Пальцев М. А., Аничков Н. М. Патологическая анатомия. Учебник для медицинских вузов (В 2 т.). — М.: Медицина, 2001 (1-е изд.), 2005 (2-е изд.), 2007 (3-е изд.).
- Пауков В.С., Хитров Н.К. Патология. — Учебник для мед. училищ. — М.: Медицина, 1989. — С. 98—112. — 352 с.
- Тель Л.З., Лысенков С.П., Шарипова Н.Г., Шастун С.А. Патофизиология и физиология в вопросах и ответах. — 2 том. — М.: Медицинское информационное агентство, 2007. — С. 66—75. — 512 с.
- Воспаление. Руководство для врачей / Под ред. В.В. Серова, В.С. Паукова. — М.: Медицина, 1995. — 640 с.
- Барышников С.Д. Лекции по анатомии и физиологии человека с основами патологии. — М.: ГОУ ВУНМЦ, 2002. — С. 57—64. — 416 с.
- Атаман А.В. Патологическая физиология в вопросах и ответах. — Учеб. пособие. — К.: Вища школа, 2000. — С. 133—147. — 608 с.
Видео[править | править код]
- «Воспаление» — Центрнаучфильм (Объединение учебных фильмов), 1980 г.
Ссылки[править | править код]
- Воспаление и иммунитет // ImmunInfo.ru
