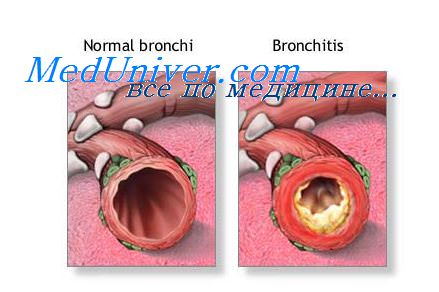
Воспаление на клеточном уровне
Своеобразие вирусного воспаления на клеточном уровне.Особенности вирусного воспаления на клеточном уровне, также как и на субклеточном, обусловлены морфологическими и функциональными особенностями вирусных частиц. Аналогично воспалению, обусловленному другими инфекционными агентами, возможно развитие двух основных форм воспаления: острого и хронического. Принципиальная схема острого воспаления также сходна: повреждение клеток — выход гидролитических ферментов — нарушение проницаемости сосудистой стенки эндотелия и его базальной мембраны под влиянием продуктов деградации тучных клеток и активированных фагоцитов — диапедез форменных элементов крови и появление экссудата. И все-таки существуют принципиальные различия. Бактерии, за редким исключением (гонококки, менингококки), воздействуют на клетки-мишени извне с помощью различных ферментов и токсинов, которые нередко ведут к полному расплавлению наружнрой мембраны. Вирусы осуществляют процесс воспаления как снаружи, так и изнутри клетки. Основой защитной воспалительной реакции при бактериальной инфекции служат нейтрофилы, заглатывающие и переваривающие их, а также выделяющие ряд высокоактивных веществ. При этом возникает целый ряд кислородозависимых и кислородонезависимых защитных реакций, продукты которых (супероксид О2, Н202, ОН и др.) обладают мощным бактерицидным действием и в то же время способны повреждать собственные клетки хозяина. Кроме того, полиморфноядерные лейкоциты (ПМЛ) выделяют лизосомальные гидролазы, катепсины и эластазу, которая отслаивает эндотелиоциты от базальной мембраны. Биоокислители (02, Н202) разрушают ингибиторы протеаз и провоцируют образование медиаторов проницаемости, которые, наряду с системой комплемента, способствуют фокусированию нейтрофилов в очаге воспаления. Значительные скопления ПМЛ в сочетании с тромбоцитами способствуют не только повышению проницаемости стенок сосудов, но и их разрушению, что, чаще всего, имеет место при аллергических процессах в легких, бронхиальной астме, острых сливных пневмониях и респираторном дистресс-синдроме. Сравнительно недавно участие нейтрофилов в развитии воспалительного процесса при респираторных вирусных инфекциях практически отрицалось. Полагали, что это исключительная прерогатива бактерий. Тем не менее, в последние годы представлены убедительные данные о значительном вкладе нейтрофилов в процессы образования активных форм кислорода (АФК) при гриппе. Доказано, что одним из основных механизмов воспалительного процесса при гриппе является образование свободных радикалов кислорода. С генерированием этих форм связаны мутагенез, протеолитическая активация вируса гриппа, цитопатический эффект вирусной инфекции, деструкция капиллярной сети и стенок капилляров, развитие сливных пневмоний с отеком легких. Установлено также, что липидная пероксидация (ЛП), активируемая вирусом гриппа в клетках легкого, является одним из узловых метаболических процессов наряду с генерацией АФК. Именно эти процессы определяют тяжесть и распространенность воспалительной реакции. При резкой активации АФК и ЛП ферментная защита от них в виде супероксиддисмутазы (СОД), каталазы, глютатион-пероксидазы и аскорбиновой кислоты становится недостаточной. Преимущественная генерация при гриппе гипохлорида, который является мощным неспецифическим окислителем, способным окислять не только липиды, но и белки, безусловно, требует переоценки стратегии антиоксидантной терапии при гриппе, с подключением не только токоферола, ионола, но и более эффективной супероксиддисмутазы.
Несмотря на явное участие нейтрофилов в развитии воспаления при вирусных инфекциях, по мнению многочисленных авторов, основой фагоцитарной защитной реакции при вирусной инвазии являются моноциты и их зрелые формы — макрофаги. В чем сходство и отличие фагоцитоза, осуществляемого нейтрофилами и макрофагами? Сходство в наличии ряда аналогичных по функциональной направленности этапов при взаимодействии с чужеродными агентами: хемотаксис, активация, выброс активных веществ, адсорбция, захват, переваривание. Однако много принципиальных отличий. В противоположность нейтрофилам макрофаги — долгоживущие клетки и рассеяны по всему организму, они входят в состав соединительной ткани, содержатся в базальной мембране кровеносных сосудов. Соответствующую фокусировку макрофагов можно обнаружить как в ткани, так и в полостях и экссудатах. При хронической бронхолегочной патологии альвеолярные макрофаги нередко содержат вирусные антигены. Набор выделяемых активированным макрофагом веществ значительно больше и многообразнее, чем у ПМЛ. Соответственно этому спектр выбрасываемых активных веществ при вирусном воспалении значительно шире. К числу секретируемых им веществ следует отнести гидролазные ферменты (лизоцим, кислые гидролазы, нейтральные протеазы, липазы), ингибиторы протеолитических ферментов, факторы, меняющие клеточную пролиферацию и функцию (интерлейкин 1, фактор созревания тимоцитов, ангиогенный фактор, интерферон и фибронектин), производные липидов (простагландины, лейкотриены, фактор активации тромбоцитов), факторы, меняющие процесс свертывания крови (тромбопластин, активатор плазминогена), вирусоцидные агенты (супероксид — радикал О2, Н202, интерфероны), компоненты комплемента и их ингибиторы. Обилие секретируемых макрофагами веществ определяет и большую сложность и многообразие их функций. Активные МФ из очага воспаления участвуют во всех процессах по обеспечению гомеостаза, являясь главными его эффекторами. В отличие от нейтрофилов макрофаги способны фагоцитировать крупные, более 1 мкм объекты, именно они поглощают фрагменты клеток с содержащимися в них вирусами. В силу многообразия секретируемых веществ и выполняемых функций макрофаг активно вступает в контакт с другими клетками, осуществляющими более высокий уровень клеточной защиты организма. Именно макрофаг представляет Т-хелперам вирусный антиген, который находится на поверхности МФ в комплексе с клеточными маркерами главного комплекса гистосовместимости. Макрофаги запускают и регулируют деятельность всех видов лимфоцитов (В, Т с хелперной и супрессорной активностью). Под влиянием активированных МФ Т-лимфоциты продуцируют разнообразные растворимые факторы — лимфокины, которые, в свою очередь, оказывают активирующее воздействие на макрофаги. Макрофаги в значительно большей степени участвуют в развитии наиболее сложных и актуальных в настоящее время хронических форм воспаления. Причин для возникновения хронического воспаления при активации макрофагов значительно больше в силу их более длительного жизненного цикла, полифункциональности и значительной связи с элементами, контролирующими клеточный иммунитет, который при вирусных инфекциях, в отличие от бактериальных, имеет доминирующее значение. Функциональная недостаточность МФ, в том числе альвеолярных, нередко возникает именно под влиянием респираторных вирусов, встраивающихся в мембрану макрофага, повреждающих их рецепторный аппарат и внутренние структуры. Известно также, что для вирусов характерен незавершенный механизм фагоцитоза, при котором сами фагоциты способствуют диссеминации вирусного агента на значительные расстояния от первичного очага воспаления. — Также рекомендуем «Фагоцитоз при вирусной инфекции. Хроническое вирусное воспаление.» Оглавление темы «Воспаление в легких.»: |
Фагоцитоз – это способность определенных клеток (фагоцитов) удерживать и переваривать плотные частицы. Это явление было открыто И. Мечниковым.
Фагоцитоз осуществляется микрофагами (нейтрофилами) и системой мононуклеарных макрофагов.
Мононуклеарные макрофаги
Система (MMS) включает следующие элементы:
- промоноциты (костный мозг);
- моноциты (кровь);
- тканевые макрофаги;
- гистиоциты соединительной ткани;
- печеночные клетки Куппера;
- легочные альвеолярные макрофаги;
- свободные и фиксированные макрофаги лимфатической ткани;
- плевру и перитонеальные макрофаги.
Клетки мононуклеарной системы объединяет общее происхождение гемопоэтических клеток и саморегуляция.
Моноцитопоэз
Моноцитопоэз – это стимулирующий фактор колонии фибробластов и фактор роста макрофагов, но он же подавляет (отрицательная саморегуляция) интерферон фибробластов и лейкоцитов и т. д.
Процесс фагоцитоза делится на четыре стадии:
- Приближение.
- Адгезия.
- Оседание;
- Стадия пищеварения.
Фаза приближения
Фагоцит приближается к объекту – бактериям, мервому клеточному элементу, инородному объекту. При движении под действием хемотаксиса цитоплазма фагоцита образует удлинения (псевдоподии).
Адгезия
Способствует образованию аминополисахаридов на поверхности фагоцитов и перекрытию фагоцитарного объекта белками сыворотки, особенно иммуноглобулинами. Последний механизм по сути является опсонизацией – бактерии и поврежденные клетки перекрываются с IgM, IgG и компонентами комплемента (C3, C5 и др.), что облегчает адгезию к фагоциту.
Адгезия
Поверхность фагоцита заряжена отрицательно, поэтому адгезия лучше, если объект, подлежащий фагоцитозу, заряжен положительно. Менее фагоцитарны отрицательно заряженные объекты, такие как опухолевые клетки.
Оседание
Этап фагоцитации объекта – путь инвагинации. Сначала фагоцит образует углубление, а затем фагосому – вакуоль, содержащую объект, подлежащий фагоцитозу. НАДН-зависимая оксидаза в мембране фагоцитов активируется до образования фагосом; в результате O2 превращается в O 2 ~ (супероксид-анион) и образуется H 2 O 2.
Эти продукты обладают бактерицидным действием, а также вызывают образование свободных радикалов. Под действием пероксидаз и каталаз H 2 O 2 расщепляется и высвобождается молекулярный O 2. Свободные радикалы и активный молекулярный O 2 действуют на мембрану фагоцита и объект, подлежащий фагоцитозу, активируя перекисное окисление липидов.
Липопероксиды и свободные радикалы неустойчивы к лизосомным мембранам и способствуют высвобождению лизосомальных ферментов.
Стадия пищеварения
Лизосомы присоединяются к фагосоме, содержащей фагоцитарный объект. Эти органеллы содержат все ферменты, необходимые для расщепления углеводов, белков, жиров и нуклеиновых кислот. В еще неактивной форме они попадают в вакуоль фагоцитов.
Пищеварительная вакуоль образуется при pH около 5,0, близком к оптимальному для лизосомальных ферментов. Активируются лизосомальные ферменты, и фагоцитарный объект постепенно переваривается. Во время стадии пищеварения проницаемость мембраны фагосомы увеличивается, содержимое фагосомы ускользает в цитоплазму, и микрофаг умирает (этому процессу способствует ацидоз). В этом случае фагоцитарный микроорганизм также может сохранять жизнеспособность.
Роль макрофагов в воспалительном процессе
Макрофаги начинают участвовать в фагоцитозе позже микрофагов. Макрофаги также более устойчивы к гипоксии и ацидозу, например, моноциты жизнеспособны даже при pH 5,5.
В очаге воспаления макрофаги выполняют несколько функций:
- Фагоцитируют бактериальные остатки, оставшиеся после эвакуации гноя и продуктов распада тканей – очищающая функция;
- Высвобождают лизосомальные ферменты – гиалуронидазу, аминопептидазу и др;
- Синтезируют компоненты системы комплемента и простагландины.
Взаимодействие макрофагов и лимфоцитов при хроническом воспалении
В то же время воспаленная тканевая среда также стимулирует образование фибробластов и фиброцитов. Постепенно появляется новая, богатая сосудами грануляционная ткань.
Фагоцитоз стимулируется продуктами повреждения тканей – внутриклеточные белки, ферменты, полипептиды, аминокислоты, электролиты и т. д., биологически активными веществами, половыми гормонами, тироксином, адреналином, лихорадкой. Но подавляется недостатком стимулирующих факторов, глюкокортикоидов, гликолортикоидов, ацетилхолина, ацетилхолина.
Фагоцитоз
Считается, что клетки плаценты и злокачественные опухоли способны секретировать вещество, которое подавляет функцию макрофагов, иммунологические реакции лимфоцитов и эмиграцию лейкоцитов, что приводит к значительному ослаблению или даже прекращению воспаления.
Объекты, которые фагоциты не могут переваривать, остаются в этих клетках в течение длительного времени и покрываются тонкой пленкой аминополисахаридов. После гибели фагоцитов они повторно фагоцитируются или выводятся из организма. Процесс, при котором фагоцит после переваривания высвобождает часть продуктов своего фагоцитоза в окружающую среду, называется экструзией.
Фагоцитоз – не единственный в организме механизм борьбы с воспалением. Большинство микроорганизмов погибают в условиях ацидоза, а также от ферментов, высвобождаемых во время гибели клеток и функционирования иммунокомпетентной системы.
Нейтрофилы во внеклеточном пространстве секретируют катионные белки, которые могут убивать ферменты без ферментов и фагоцитоза. Таким образом, воспалительные очаги постепенно избавляются от микроорганизмов и мертвых клеток.
Асептическое и острое воспаление
Дальнейшее течение воспаления зависит от того, является ли воспаление асептическим или бактериальным.
В асептических воспалительных условиях, например, вокруг хирургического шва, инородного тела, стенка микрофагов (нейтрофилов) начинает формироваться в течение нескольких часов, достигая максимума в течение дня.
Позже появляется следующий вал макрофагов, который достигает максимума через 2-3 раза. в день. Эмигрировавшие лейкоциты постепенно становятся неподвижными, больше не могут делиться и погибают в течение 3-5 дней. 2-3. на 5 сутки начинает формироваться стенка фибробластов, а на 5 сутки – соединительнотканная капсула.
Таким образом, в случае острого воспаления патогенный агент в организме преобразует белки, которые участвуют в реакции антиген-антитело, медиаторы и модуляторы воспаления, систему фагоцитов и миграцию клеток. В результате заканчивается острое воспаление. Однако, если инфекционные агенты попадают в участок асептического воспаления, например, в результате травмы, это воспаление становится септическим (бактериальным) воспалением.
Бактериальные воспалительные состояния бактерий и токсинов, не вызывающие гиперемии, экссудации и эмиграции лейкоцитов. Между клетками воспаленных тканей и особенно вокруг кровеносных сосудов накапливается все больше и больше микрофагов. Лизосомы микрофагов содержат множество активных ферментов, и эти клетки также начинают процесс фагоцитоза. При пальпации воспаленная ткань в это время кажется плотной, поэтому это называется стадией воспалительной инфильтрации.
По мере прогрессирования воспаления лейкоциты и те тканевые клетки, которые претерпели необратимые изменения во время воспаления, погибают. В этих клетках высвобождаются лизосомальные ферменты, которые расщепляют тканевые белки, белковые и липидные комплексы и другие структуры. Это стадия гнойного размягчения воспаления.
Эти стадии наблюдаются, например, у пациентов с гнойным воспалением перикарда (фурункул), гнойным воспалением апокринных потовых желез (гидраденит) и гнойным воспалением соединительной ткани (флегмона). При вдыхании воспаленная ткань выглядит мягкой, с характерным раскачиванием – флюктуацией. Образуется замкнутое скопление гноя – абсцесс.
Гнойное воспаление перикарда
Гной разрывается в направлении наименьшего сопротивления (либо наружу, либо внутри тела). Если гной попадает в кровоток (пемия), в организме может развиться множество очагов гноя, но под действием микроорганизмов и токсических веществ – угрожающее общее заболевание (сепсис, септикопиемия). Поэтому важно диагностировать накопление гноя и обеспечить хирургический дренаж гноя наружу.
Продолжение статьи
- Часть 1. Этиология и патогенез воспаления. Классификация.
- Часть 2. Особенности обмена веществ при воспалении.
- Часть 3. Физико – химические изменения. Роль нервной и эндокринной систем в развитии воспаления.
- Часть 4. Изменения в периферическом кровообращении при воспалении.
- Часть 5. Экссудация. Экссудат и транссудат.
- Часть 6. Эмиграция лейкоцитов. Хемотаксис.
- Часть 7. Фагоцитоз. Асептическое и острое воспаление.
- Часть 8. Распространение. Последствия. Принципы лечения воспаления.
Поделиться ссылкой:
Воспалительные изменения на уровне субклеточных структур при вирусной инфекции.Вызываемое вирусами развитие клинических проявлений болезни и видимые признаки воспаления есть конечный результат множества событий. Большая часть процессов, связанных с репликацией вируса, а следовательно, с начальными воспалительными реакциями на микроструктурном уровне, недоступна для распознавания на клиническом уровне. Эта особенность, характерная для многих вирусных инфекций и впервые описанная С.А. Mims и А.Н. Sharpe], представляет собой важную концепцию для понимания вирусного воспаления. Зачастую привычные признаки: краснота, припухлость, инфильтрация составляют лишь видимую с большим опозданием и весьма незначительную часть того воспаления, которое захватывает многочисленные структуры пораженного организма. В правом столбце таблицы перечислены события, происходящие внутри клетки, именно они определяют ее конечную судьбу: гибель, трансформацию, резервирование персистентного вируса и т.д. В левом столбце приведены события на уровне организма или ткани, ведущие к заражению клеток и развитию защитных иммунных реакций. Эта схема значительно упрощена, многое зависит от специфики вируса и хозяина. Респираторные вирусы чаще проникают в организм через верхние дыхательные пути. Первичное прикрепление вируса к эпителиальным клеткам зависит от множества факторов: его устойчивости к неспецифическим защитным факторам (протеолитические ферменты, слизь, движение ресничек, соли желчных кислот), к секреторным антителам, а также от наличия специфических комплементарных рецепторов на поверхности клетки, способных к воссоединению с рецепторами вируса. Как показали исследования последних лет, комплементарность вирусных и клеточных рецепторов зачастую обусловлена генетическими маркерами организма: группой крови и HLA-принадлежностью. Так, самые тяжелые осложненные формы гриппа чаще возникают у носителей антигенов А-Н и HLA-8, склонность к персистированию превалирует у лиц с группой крови ВШ и HLA-A9. Таким образом, развитие тех или иных форм воспаления отчасти предопределено генетически. Не исключено, что каждому из респираторных вирусов соответствует свой излюбленный генотип.
Вторым, не зависящим от специфических рецепторов, механизмом органотропности является протеолитическое расщепление гликопротеиновых оболочек парамиксовирусов (парагрипп, PC-вирус) в присутствии трипсиноподобных ферментов, содержащихся в инфицируемых клетках. Аналогичное свойство присуще вирусу гриппа, у которого ферментативному расщеплению подвергается гемагглютинин. При отсутствии в ткани необходимых ферментов многоцикловая инфекция не воспроизводится. Прикрепление вируса к клетке является пусковым моментом для развития симптомокомплекса воспаления, который включает в себя альтерацию, экссудацию, трансформацию и пролиферацию в сочетании с нарушениями микроциркуляции и повреждениями функциональной активности. Краткая схема этого сложного и многообразного процесса не может отразить всех возможных вариантов и особенностей, но может облегчить восприятие основных моментов. Большая часть перечисленных в таблице 2 признаков воспаления, прежде всего деструкция и дистрофия, являются общими для всех респираторных вирусов и не могут служить надежными признаками дифференциации. Однако характер вирусных включений: их размеры, локализация, структура в сочетании с определенным типом поражения клеток (образование гигантских структур, пластов, скопления гроздевидных округлых клеток и т.д.) имеют определенное диагностическое значение при рассмотрении воспаления на субклеточном и клеточном уровне. Так, уже в начальной стадии воспаления, через 6-8 часов от момента заражения, при гриппе определяются базофильные включения, содержащие вирусные частицы. Чаще всего они локализуются в апикальной части эпителия; эозинофильные включения реже содержат вирус и чаще рассматриваются в качестве реактивных образований. При парагриппе и PC-инфекции выявляются цитоплазматические фуксинофильные включения, нередко группирующиеся вокруг ядра. При герпетической и цитомегаловирусной инфекции чаще регистрируются четко контурируемые внутриядерные включения, округлые, крупные, эозинофильные и оксифильные, нередко отгороженные от остальной цуклеплазмы светлой зоной. При аденовирусной инфекции также преобладают внутриядерные включения, на ранних стадиях инфекции (через 16 часов) — мелкие, округлые, базофильные или оксифильные; одни из них однородны, другие имеют форму колец с прозрачным центром. В дальнейшем число внутриядерных включений увеличивается, встречаются слоистые и ячеистые формы. На поздних этапах инфекции включения обнаруживаются и в цитоплазме клеток. Наиболее точная дифференцировка специфичности включений осуществляется с помощью прямого и непрямого иммунофлуоресцентного метода с использованием меченых антител. Формирование вирусных включений интересно не только с точки зрения патогенных возможностей респираторных вирусов, но и с точки зрения анализа самого понятия воспаления. С одной стороны, это несомненный результат непосредственного воздействия вируса на клетку, вероятно это защитная реакция клетки, стремящейся локализовать патогенные частицы, а с другой стороны — это и возможность длительной резервации вируса. Таких двояких по целесообразности моментов в процессе вирусного воспаления достаточно. Так, под действием вирусов может происходить своеобразная активация фагоцитарной способности клеток, что проявляется в усилении цитофагоцитоза, когда инфицированные клетки активно фагоцитируют другие клетки, а также ферменты распавшихся структур. С одной стороны, это полезно с точки зрения утилизации и удаления дегенерировавших элементов, с другой стороны — нередко способствует большему распространению вирусной инфекции по клеточному пласту. Большинство респираторных вирусов на ранних стадиях инфицирования вызывает ряд изменений клеточных структур, которые можно рассматривать как защитно-компенсаторные: набухание, гиперплазия ряда клеточных элементов, увеличение функционирующих локусов митохондрий, и лишь на более поздних стадиях возникают явления дистрофии, деструкции, либо необратимого перерождения. Перечисляя изменения клеточных элементов, обусловленных вирусной репродукцией, было бы несправедливым забыть о главной их способности — нарушать синтез клеточных макромолекул. В случае развития вирусного инфицирования в клетке появляется два источника информации: клеточный и вирусный геномы. В подавляющем большинстве случаев ведущим оказывается вирусный геном, под руководством которого осуществляются процессы, направленные на воспроизводство вирусного потомства, в то время как синтез клеточных макромолекул (РНК, ДНК, белка) претерпевает значительное подавление. После длительных экспериментальных поисков было доказано, что в основе ингибирования синтеза клеточных РНК и ДНК в инфицированных клетках лежит феномен блокирования процесса транскрипции, т.е. «считывания» информации, закодированной в клеточном геноме, без нарушения целостности структур ДНК и РНК, а также РНК-полимераз. Ингибитором, ответственным за этот процесс, оказался аргининсодержащий белок — гистон. Большая часть исследователей полагает, что синтез белков-ингибиторов осуществляется самой клеткой в результате реализации информации, закодированной в ее геноме. Вирус лишь стимулирует синтез этих ингибиторов. Помимо подавления синтеза клеточных РНК, гистоны подавляют функцию и синтез ДНК, а также синтез АТФ и перенос аминокислот. Таким образом, появление индуцированных вирусом и воспроизведенных клеткой гистонов является одной из основных причин нарушения синтеза клеточных структур, а, следовательно, и дистрофии, являющейся одним из признаков воспаления. — Также рекомендуем «Своеобразие вирусного воспаления на клеточном уровне.» Оглавление темы «Воспаление в легких.»: |