Значение венозной гиперемии при воспалении
Оглавление темы «Сосудистые реакции при воспалении.»:
1. Ацетилхолин. Нейропептиды. Цитокины. Интерлейкины.
2. Интерфероны. Хемокины. Лейкокины. Фибронектины.
3. Ферменты в очаге воспаления. Липидные медиаторы воспаления.
4. Образование и эффекты простагландинов и лейкотриенов.
5. Нуклеотиды. Нуклеозиды. Плазменные медиаторы воспаления. Кинины.
6. Факторы системы комплемента. Факторы гемостаза.
7. Изменения функций органов и тканей при воспалении.
8. Ишемия при воспалении. Артериальная гиперемия при воспалении.
9. Венозная гиперемия при воспалении. Стаз при воспалении.
10. Экссудация. Виды эксудата. Причины эксудации.
Параллельно с вышеуказанными изменениями, как правило, появляются признаки венозной гиперемии в виде увеличения просвета посткапилляров и ве-нул и замедления в них тока крови.
Предстаз
Через некоторое время появляются периодические маятникообразные движения крови «вперёд назад». Это является признаком перехода венозной гиперемии в состояние, предшествующее стазу (предстаз). Причина маятникооб-разного движения крови: в очаге воспаления возникает механическое препятствие оттоку крови по посткапиллярам, венулам и венам. Препятствие создают возникающие при замедлении тока крови и гемоконцентрации агрегаты форменных элементов крови в просвете сосуда и пристеночные микротромбы. Таким образом, во время систолы кровь движется от артериол к венулам, а во время диастолы — от венул к артериолам.
Причины венозной гиперемии и предстаза
Известны следующие основные причины венозной гиперемии и предстаза.
• Сдавление венул экссудатом.
• Сужение просвета венул микротромбами, агрегатами форменных элементов крови, набухшими клетками эндотелия.
• Снижение тонуса стенок венул в результате уменьшения возбудимости их нервно-мышечных элементов, а также повреждения их волокнистых структур и межклеточного вещества под действием флогогенного фактора, избытка медиаторов воспаления, в том числе ферментов (эластаз, коллаге-наз, других гидролаз).
• Сгущение крови, повышение её вязкости и понижение в связи с этим текучести, что определяется повышенным выходом плазмы крови в ткань при экссудации.
• Скопление большого количества лейкоцитов у стенок посткапилляров и венул (феномен краевого стояния лейкоцитов).
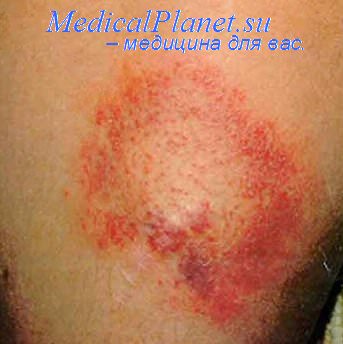
Стаз при воспалении
Четвёртая стадия сосудистых реакций — стаз — характеризуется дискоордини-рованным изменением тонуса стенок микрососудов и как следствие — прекращением тока крови и лимфы в очаге воспаления. Длительный стаз ведёт к развитию дистрофических изменений в ткани и гибели отдельных её участков.
Значение венозной гиперемии и стаза при воспалении
Значение венозной гиперемии и стаза в очаге воспаления состоит в изоляции очага повреждения (благодаря препятствию оттоку крови и лимфы из него и тем самым содержащихся в них микробов, токсинов, продуктов метаболизма, ионов, БАВ и других агентов, способных повредить другие ткани и органы организма).
При венозной гиперемии и стазе происходят дальнейшие расстройства специфической и неспецифической функций тканей, дистрофические и структурные изменения в них вплоть до некроза.
Повышение проницаемости стенок микрососудов способствует образованию экссудата.
— Читать далее «Экссудация. Виды эксудата. Причины эксудации.»
Значение венозной гиперемии и стаза в очаге воспаления состоит в изоляции очага повреждения (благодаря препятствию оттоку крови и лимфы из него и, тем самым, содержащихся в них микробов, токсинов, продуктов метаболизма, ионов, БАВ и других агентов, способных повредить другие ткани и органы организма).
При венозной гиперемии и стазе происходят дальнейшие расстройства специфической и неспецифической функций тканей, дистрофические и структурные изменения в них вплоть до некроза.
Повышение проницаемости стенок микрососудов способствует образованию экссудата.
Экссудация плазмы и выход форменных элементов крови
Артериальная и венозная гиперемия, стаз и повышение проницаемости стенок микрососудов в очаге воспаления сопровождаются выходом плазмы, а также форменных элементов крови из микрососудов в ткани и/или полости тела с образованием экссудата (рис. 6–15).
Ы ВЁРСТКА вставить файл «ПФ Рис 06 15 Экссудация»
Рис.6–15.Формирование экссудата в очаге воспаления.
Экссудация
Процесс экссудации начинается вскоре после действия повреждающего фактора на ткань и продолжается до начала репаративных реакций в очаге воспаления.
Ы Вёрстка Таблица
| ЭКССУДАТ |
| • жидкость, выходящая из микрососудов, |
| содержащая большое количество белка |
| и, как правило, форменные элементы крови. Накапливается в тканях и/или полостях тела при воспалении. |
Причины экссудации
Основная причина экссудации – увеличение проницаемости стенок микрососудов под влиянием факторов, повреждающих их стенку и представленных на рис. 6–16 (см. также рис. 23–54 и сопровождающий рисунок текст).
Ы ВЁРСТКА вставить файл «ПФ Рис 06 16 Причины повышения проницаемости стенок микрососудов»
Рис.6–16.Причины повышения проницаемости стенок микрососудов при остром воспалении.
К процессам, повреждающим стенку сосуда в очаге воспаления, относят следующие: – усиление неферментного гидролиза компонентов базальной мембраны микрососудов в условиях ацидоза; – повреждение клеток эндотелия и базальной мембраны стенок микрососудов факторами лейкоцитов (гидролитическими ферментами лизосом, активными формами кислорода, пероксинитритом), а также внеклеточными агентами очага воспаления (гидроперекисями липидов, токсинами микробов, токсичными метаболитами повреждённых и/или погибших клеток, мембраноатакующим комплексом системы комплемента); –перерастяжение и — в связи с этим — истончение стенки сосудов (особенно — венул) вследствие их полнокровия; – сокращение актиновых нитей и их разрушение, а также разрушение других элементов цитоскелета эндотелиоцитов с их округлением и появлением между ними промежутков, в норме отсутствующих; – активация механизма трансэндотелиального переноса жидкости («трансцитоза») из просвета микрососуда в интерстиций, что осуществляется путём пиноцитоза с последующим экзоцитозом пиноцитозных пузырьков.
Имеется группа факторов, потенцирующих образование экссудата.Это: – увеличение перфузионного давления (усиливает фильтрацию жидкости через сосудистую стенку); – возрастание площади экссудации (в результате растяжения стенок микрососудов); – повышение проницаемости базальной мембраны сосудов (под влиянием медиаторов воспаления); – увеличение осмотического и онкотического давления в очаге воспаления; – усиление трансцитоза; – снижение эффективности резорбции жидкости в посткапиллярном отделе сосудов микроциркуляторного русла.
Виды экссудата
Выделяют три основных типа экссудата: серозный, фибринозный и гнойный. В зависимости от наличия клеток, их типа, химического состава в экссудате различают также геморрагический и гнилостный его разновидности.
Серозный экссудат состоит из полупрозрачной жидкости, богатой белком (до 2–3%), и немногочисленных клеток, в том числе форменных элементов крови.
Фибринозный экссудат содержит большое количество фибриногена и фибрина.
Гнойный экссудат представляет собой мутную густую жидкость, содержащую до 6–8% белка и большое количество различных форм лейкоцитов, микроорганизмов, погибших клеток повреждённой ткани.
Геморрагический экссудат содержит большое количество белка и эритроцитов, а также другие форменные элементы крови.
Гнилостный экссудат. Любой вид экссудата может приобрести гнилостный (ихорозный) характер при попадании в очаг воспаления гнилостной микрофлоры (анаэробы).
Смешанные формы экссудата могут быть самыми разнообразными (например, серозно‑фибринозный, гнойно‑фибринозный, гнойно‑геморрагический и др.).
Клеточный и химический состав экссудата имеет определённое диагностическое значение и зависит от причины воспаления, ткани, в котором развивается воспаление, реактивности организма и ряда других факторов.
Значение венозной гиперемии и стаза в очаге воспаления состоит в изоляции очага повреждения (благодаря препятствию оттоку крови и лимфы из него и, тем самым, содержащихся в них микробов, токсинов, продуктов метаболизма, ионов, БАВ и других агентов, способных повредить другие ткани и органы организма).
При венозной гиперемии и стазе происходят дальнейшие расстройства специфической и неспецифической функций тканей, дистрофические и структурные изменения в них вплоть до некроза.
Повышение проницаемости стенок микрососудов способствует образованию экссудата.
Экссудация плазмы и выход форменных элементов крови
Артериальная и венозная гиперемия, стаз и повышение проницаемости стенок микрососудов в очаге воспаления сопровождаются выходом плазмы, а также форменных элементов крови из микрососудов в ткани и/или полости тела с образованием экссудата (рис. 6–15).
Ы ВЁРСТКА вставить файл «ПФ Рис 06 15 Экссудация»
Рис.6–15.Формирование экссудата в очаге воспаления.
Экссудация
Процесс экссудации начинается вскоре после действия повреждающего фактора на ткань и продолжается до начала репаративных реакций в очаге воспаления.
Ы Вёрстка Таблица
| ЭКССУДАТ |
| • жидкость, выходящая из микрососудов, |
| содержащая большое количество белка |
| и, как правило, форменные элементы крови. Накапливается в тканях и/или полостях тела при воспалении. |
Причины экссудации
Основная причина экссудации – увеличение проницаемости стенок микрососудов под влиянием факторов, повреждающих их стенку и представленных на рис. 6–16 (см. также рис. 23–54 и сопровождающий рисунок текст).
Ы ВЁРСТКА вставить файл «ПФ Рис 06 16 Причины повышения проницаемости стенок микрососудов»
Рис.6–16.Причины повышения проницаемости стенок микрососудов при остром воспалении.
К процессам, повреждающим стенку сосуда в очаге воспаления, относят следующие: – усиление неферментного гидролиза компонентов базальной мембраны микрососудов в условиях ацидоза; – повреждение клеток эндотелия и базальной мембраны стенок микрососудов факторами лейкоцитов (гидролитическими ферментами лизосом, активными формами кислорода, пероксинитритом), а также внеклеточными агентами очага воспаления (гидроперекисями липидов, токсинами микробов, токсичными метаболитами повреждённых и/или погибших клеток, мембраноатакующим комплексом системы комплемента); –перерастяжение и — в связи с этим — истончение стенки сосудов (особенно — венул) вследствие их полнокровия; – сокращение актиновых нитей и их разрушение, а также разрушение других элементов цитоскелета эндотелиоцитов с их округлением и появлением между ними промежутков, в норме отсутствующих; – активация механизма трансэндотелиального переноса жидкости («трансцитоза») из просвета микрососуда в интерстиций, что осуществляется путём пиноцитоза с последующим экзоцитозом пиноцитозных пузырьков.
Имеется группа факторов, потенцирующих образование экссудата.Это: – увеличение перфузионного давления (усиливает фильтрацию жидкости через сосудистую стенку); – возрастание площади экссудации (в результате растяжения стенок микрососудов); – повышение проницаемости базальной мембраны сосудов (под влиянием медиаторов воспаления); – увеличение осмотического и онкотического давления в очаге воспаления; – усиление трансцитоза; – снижение эффективности резорбции жидкости в посткапиллярном отделе сосудов микроциркуляторного русла.
Виды экссудата
Выделяют три основных типа экссудата: серозный, фибринозный и гнойный. В зависимости от наличия клеток, их типа, химического состава в экссудате различают также геморрагический и гнилостный его разновидности.
Серозный экссудат состоит из полупрозрачной жидкости, богатой белком (до 2–3%), и немногочисленных клеток, в том числе форменных элементов крови.
Фибринозный экссудат содержит большое количество фибриногена и фибрина.
Гнойный экссудат представляет собой мутную густую жидкость, содержащую до 6–8% белка и большое количество различных форм лейкоцитов, микроорганизмов, погибших клеток повреждённой ткани.
Геморрагический экссудат содержит большое количество белка и эритроцитов, а также другие форменные элементы крови.
Гнилостный экссудат. Любой вид экссудата может приобрести гнилостный (ихорозный) характер при попадании в очаг воспаления гнилостной микрофлоры (анаэробы).
Смешанные формы экссудата могут быть самыми разнообразными (например, серозно‑фибринозный, гнойно‑фибринозный, гнойно‑геморрагический и др.).
Клеточный и химический состав экссудата имеет определённое диагностическое значение и зависит от причины воспаления, ткани, в котором развивается воспаление, реактивности организма и ряда других факторов.
Венозная гиперемия – это состояние повышенного кровенаполнения органа или ткани, обусловленное затрудненным оттоком крови по венам.
Венозное полнокровие может быть местным и распространенным. Местное венозное полнокровие возникает при затруднении оттока крови по некрупным венозным стволам вследствие закупорки их тромбом, эмболом или при сдавлении вены извне опухолью, рубцом, отеком и т.п.. Особой разновидностью местного венозного полнокровия является коллатеральная гиперемия, например, при циррозе печени, тромбозе воротной или печеночной вен, вследствие чего развивается сброс венозной крови, оттекающей от кишечника, в обход печени через портокавальные анастомозы (вены желудка, передней брюшной стенки, пищевода, таза).
Условием, способствующим венозному застою, является длительное не физиологическое положение той или иной части тела, неблагоприятное для местного оттока крови. При этом формируется гипостаз – гравитационная венозная гиперемия. Так, гипостаз легко возникает в венах нижних конечностей при малоподвижной работе стоя, в венах задних отделов легких – у больных, находящихся на постельном режиме и т.д.
Наиболее частыми причинами распространенного венозного полнокровия являются сердечная недостаточность вследствие ревматических и врожденных пороков клапанов сердца, миокардитов, инфаркта миокарда, декомпенсации гипертрофированного сердца, а также уменьшения присасывающего действия грудной клетки при экссудативном плеврите, гемотораксе и т.д. При этом венозное полнокровие распространяется на бассейн большого или малого кругов кровообращения. Так, при правожелудочковой сердечной недостаточности венозная гиперемия возникает в сосудах большого круга кровообращения, при левожелудочковой – в малом круге, при тромбозе и стенозе воротной вены – в системе v.porta.
По темпу развития и длительности существования данная патология может носить острый и хронический характер. Длительная венозная гиперемия возможна только при недостаточности коллатерального венозного кровообращения.
Микроциркуляторные расстройства при венозной гиперемии характеризуются:
· расширением капилляров и венул;
· замедлением кровотока по сосудам микроциркуляторного русла вплоть до стаза;
· утратой деления кровотока на осевой и плазматический;
· повышением внутрисосудистого давления;
· маятникообразным или толчкообразным движением крови в венулах;
· уменьшением интенсивности кровотока в области гиперемии;
· нарушением лимфообращения;
· увеличением артериовенозной разницы по кислороду.
К внешним признакам венозной гиперемии относятся:
· увеличение, уплотнение органа или ткани;
· развитие отека;
· возникновение синюшности, то есть цианотичной окраски.
В данном случае цианоз по механизму развития является периферическим. При застое в венах малого круга возможен центральный цианоз, то есть синюшность теплой кожи и видимых слизистых оболочек, обусловленная нарушением артериализации крови в легких. Периферический цианоз сопровождается местным снижением температуры, что связано с венозным застоем. Венозные сосуды при длительном застое не просто расширяются, а приобретают извитой характер.
Венозная гиперемия ухудшает состояние организма, поскольку сопровождается гипоксическим повреждением тканей, сдавлением их отечной жидкостью. При остром венозном полнокровии может наблюдаться выход эритроцитов из мелких сосудов в окружающие ткани. Скопление значительного их количества в слизистых и серозных оболочках, коже формирует мелкие, точечные кровоизлияния. Вследствие усиления транссудации в тканях накапливается отечная жидкость. Количество ее может быть весьма значительным в подкожной клетчатке (анасарка), плевральных полостях (гидроторакс), брюшной полости (асцит), перикарде (гидроперикард), желудочках мозга (гидроцефалия). В условиях гипоксии в клетках паренхиматозных органов развиваются зернистая и жировая дистрофия, мукоидное набухание межуточного вещества. Эти изменения носят, как правило, обратимый характер, и при устранении причины острая венозная гиперемия завершается полным восстановлением структуры и функции тканей.
Острое венозное полнокровие сосудов малого круга кровообращения ведет к возникновению отека легких и острой дыхательной недостаточности: обильная пенистая мокрота с примесью крови, влажные хрипы, притупление перкуторного звука; при рентгенологическом исследовании выявляются расширение корней легких, признаки гидроторакса.
При хроническом венозном полнокровии происходят развитие дистрофических процессов в тканях, атрофия паренхиматозных элементов с одновременным заместительным разрастанием клеток стромы и накоплением в ней коллагеновых волокон. Необратимое склерозирование и уплотнение органа сопровождается нарушением ею функций и называется цианотической индурацией. Особенно тяжелые последствия возникают при затруднении оттока крови из бассейна воротной вены при циррозе печени, что ведет к стойкой венозной гиперемии органов брюшной полости и нарастающему асциту. Так, хроническая венозная гиперемия формирует картину «мускатной печени». Характерный мускатный рисунок среза печени зависит от того, что высокоаэробные центролобулярные гепатоциты атрофируются, некротизируются в условиях гипоксии, а периферические клетки претерпевают стеатоз. Развивается застойный фиброз печени. Уплотнение легких при хроническом венозном полнокровии сопровождается накоплением гемосидерина, образующегося из гемоглобина эритроцитов и придающего легочной ткани бурый, ржавый цвет, что послужило основанием обозначить это явление как «бурое» уплотнение легких. При этом мокрота приобретает «ржавую» окраску за счет значительного количества сидерофагов.
Последствиями длительной венозной гиперемии могут быть и варикозное расширение вен, и нарушение лимфообращения.
ОТЕКИ
Отек – это типовой патологический процесс, который характеризуется увеличением содержания воды во внесосудистом межклеточном пространстве. В основе его развития лежит нарушение обмена воды между плазмой крови и периваскулярной жидкостью. Отек наиболее часто встречающаяся форма нарушения обмена воды в организме.
Отеки различных органов и тканей получили соответствующее название: анасарка — отек подкожной клетчатки, асцит — скопление жидкости в брюшной полости, гидроторакс — скопление жидкости в плевральной полости и т.д.
Обмен жидкости между капиллярами и тканями происходит через эндотелий микроциркуляторного русла. На артериальном конце капилляра гемодинамическое давление (в норме 35-45 мм рт.ст.) выдавливает через стенку капилляра ультрафильтрат плазмы в ткань, несмотря на онкотическое давление в крови в 25 мм рт.ст. (в тканях – около 10-12 мм рт.ст.), которое препятствует выходу ультрафильтрата. На венозном конце капилляра гидростатическое давление падает до 10-15 мм рт.ст., а осмотическое остается неизменным. Поэтому тканевая жидкость поступает через стенку капилляра в его просвет. В нормальных условиях объем ультрафильтрата должен соответствовать объему реабсорбции. Но, если и есть избыток жидкости сверх объема ультрафильтрата, то он возвращается в кровеносное русло через лимфатические капилляры и сосуды.
Выделяют несколько патогенетических механизмов формирования отеков, что послужило основанием для их патогенетической классификации: 1) гидростатические; 2) онкотические; 3) осмотические; 4) мембраногенные; 5) лимфогенные; 6) нейроэндокринные .
1. Роль гидростатического (гемодинамического) фактора. Повышение гидростатического давления на артериальном конце капилляра сопровождается ростом давления и площади фильтрации при одновременном снижении давления и объема реабсорбции из-за роста давления на венозном конце капилляра. Наступает задержка жидкости в ткани. По такому механизму развивается отек при тромбофлебитах, беременности, сердечные отеки и другие.
2. Роль онкотического фактора. Изменения онкотического давления (уменьшение онкотического давления в крови, например, в результате гипопротеинемии или его повышения в тканях) ведут к формированию онкотических отеков. Гипопротеинемия может возникнуть в результате действия многих факторов:
1) дефицит белка в пище,
2) нарушение синтеза альбуминов печенью,
3) избыточная потеря белка почками (протеинурия), с кровью (геморрагии), лимфой (плазморея и лимфорея при ожогах и обширных раневых поверхностях и т.д.).
Гиперонкия – повышение онкотического давления в тканях может быть обусловлена диспротеинемией (нарушение соотношения альбуминов и глобулинов в крови – в норме 2:1). Альбумины могут возмещаться избытком глобулинов, а общее содержание белка остается нормальным. Следует, однако, иметь в виду, что именно альбумины определяют уровень онкотического давления. Гиперонкия межклеточной жидкости, как правило, носит локальный характер, что и определяет регионарную форму отеков. Гиперонкия может возникнуть в результате следующих патологических состояний:
1. Перемещение части белков плазмы в ткань при патологическом повышении проницаемости стенки сосудов;
2. Выход белков из цитоплазмы при альтерации клеток;
3. Повышение гидрофильности белков в межклеточных пространствах под влиянием гипер- -ионии, гипер- -ионии, гистамина, серотонина или дефицита тироксина, ионов кальция.
Описанные механизмы играют важную роль в формирования почечных, печеночных и кахектических отеков (нефроз, туберкулез, злокачественные опухоли, болезни эндокринной системы, желудочно-кишечного тракта).
3. Роль осмотического фактора. Отек может возникать вследствие понижения осмотического давления в крови или повышения его в межклеточной жидкости. В принципе, гипоосмия крови возникать может, но быстро формирующиеся при этом тяжелые расстройства гомеостаза опережают развитие отека. Гиперосмия тканей, как и их гиперонкия, носит ограниченный характер. Гиперосмия тканей может возникать в следующих случаях:
1. Нарушение вымывания электролитов из тканей вследствие расстройств микроциркуляции;
2. Снижение активности транспорта ионов через клеточные мембраны при тканевой гипоксии;
3. Массивной утечки ионов из клеток при их альтерации;
4. Увеличение степени диссоциации солей при ацидозе.
В ряде случаев возможно постепенное увеличение осмотического давления в интерстициальном пространстве. Подобное наблюдается при длительной активной задержке ионов натрия в организме с последующим накоплением его, а затем и воды в тканях. Активная задержка натрия обычно возникает вследствие расстройства нейроэндокринной регуляции обмена натрия, в частности при избытке альдостерона. Сигналом для запуска цепочки взаимосвязанных изменений – альдостерон ® задержка натрия ® гиперосмия крови ® секреция вазопрессина ® задержка воды – служит снижение объема циркулирующей крови. Наиболее частой причиной острой гиповолемии является кровопотеря, и данный механизм носит компенсаторный характер. Однако подобный сигнал возникает при острой сердечной недостаточности как реакция на снижение систолического выброса. Этот, по сути, ложный сигнал, тем не менее, заставляет срабатывать вышеуказанную цепь событий, приводящих к формированию стойкой гипернатриемии и гиперволемии.
4. Мембраногенный механизм развития отека. Этот вид отека формируется вследствие значительного повышения проницаемости сосудистой стенки. Главными факторами изменения проницаемости могут быть:
1. Перерастяжение стенок микроциркуляторного русла (например, артериальная гиперемия);
2. Повышение порозности эндотелия под действием медиаторов воспаления и аллергии;
3. Повреждение эндотелия токсинами, гипоксией, ацидозом и т.п.;
4. Нарушение структуры базальной мембраны при активации ферментов.
Повышение проницаемости стенок сосудов облегчает выход из крови жидкости, меняет соотношение площадей фильтрации и реабсорбции в капиллярах. Кроме того, при повышении проницаемости эндотелия белки плазмы получают возможность выходить из плазмы в тканевую жидкость.
5. Лимфогенный фактор. Лимфогенные отеки возникают вследствие значительного снижения оттока жидкости по лимфатическим сосудам. Последнее носит регионарный характер и обусловлено повреждением лимфатических сосудов или лимфузлов (воспаление, тромбоз, паразиты). Частным вариантом таких отеков является слоновость — отек конечности (увеличение их до гигантских размеров), возникающий в результате поражения регионарных лимфузлов паразитами филляриями (филляриоз). В таких случаях отечная жидкость богата белками, которые в норме реабсорбируются лимфатическими капиллярами.
Обычно в формировании отека принимает участие не один, а несколько или все перечисленные факторы, включаясь последовательно по мере нарушения водно-электролитного баланса. Однако среди этих факторов выделяют такой, который выполняет центральную организующую роль. В связи с этим все отеки по их патогенезу условно делят на гемодинамические, онкотические и другие (см. выше). По причинам происхождения выделяют следующие виды отеков:
1) застойные,
2) печеночные,
3) почечные,
4) воспалительные,
5) аллергические,
6) токсические,
7) кахектические,
8) нейроэндокринные.
1. Сердечные отеки. Причиной возникновения сердечных отеков является сердечная недостаточность, которая проявляется, в первую очередь, снижением минутного объема сердца (МОС). На первом этапе вследствие нарастания центрального венозного давления (гемодинамический фактор) снижается реабсорбция жидкости в капиллярах. Клинически на этом этапе отек еще не проявляется, избыток межтканевой жидкости связывается тканевыми коллоидами. Параллельно включается последовательная цепочка нейроэндокринных реакций «волюм-рефлекс ® осмо-рефлекс», запускаемая сигналом с волюм-рецепторов (снижение сердечного выброса) и приводящая к задержке натрия и воды. Этот результат, целесообразный в случае падения объема циркулирующей крови, в данном случае становится основой дальнейшего развития отека.
Гиперволемия усиливает перегрузку пораженного миокарда, способствуя дальнейшему повышению центрального венозного давления. Избыток натрия накапливается в тканях, куда он перемещается из сосудистого русла. Это изменение означает начало второго (собственно отечного) этапа развития отека — скопления избытка свободной воды в межклеточном пространстве, выявляемого клинически. Одновременно активируется почечное звено развития отека: снижение почечного кровотока (обусловленного сердечной недостаточностью) служит сигналом для активации ренин-ангиотензин-альдостеронового механизма, усиливающего задержку воды в организме, и, следовательно, потенцирующего развитие отека.
Недостаточность кровообращения обусловливает развитие гипоксии (вначале гемического, в дальнейшем смешанного типа) и ацидоза. В результате этого усиливаются проницаемость стенок сосудов и выход из них воды в ткани вместе с белками плазмы. С повышением центрального венозного давления нарушается лимфоток, что означает подключение лимфогенного фактора развития отека. Венозный застой в печени и возникающие в ней дистрофические процессы вызывают нарушения ее белково-синтетической функции, что обуславливает гипоонкию крови. Таким образом, сердечный отек в процессе его развития превращается из первоначально гемодинамического в смешанный (Табл.1).
2. Почечные отеки (нефритические и нефротические). Нефритический отек развивается при аллергических и воспалительных заболеваниях почек с преимущественным диффузным поражением клубочкового аппарата. Нарушения кровообращения в корковом слое почек обуславливает усиление секреции ренина юкстагломерулярными клетками. В связи с этим включается осмотический фактор развития отека, связанный с активацией системы ренин-ангиотензин-альдостерон-антидиуретический гормон (АДГ), что сопровождается задержкой в организме избытка натрия и воды. Важно иметь в виду, что для диффузного гломерулонефрита характерно повреждение мембран микрососудов и, прежде всего, капилляров во многих органах и тканях организма. Повышение их проницаемости является важным механизмом развития нефритических отеков (Табл. 2).
Нефротический отек. Он возникает вследствие преимущественного поражения тубулярного (канальцевого) аппарата почек. Для нефроза характерна длительная массивная потеря белка с мочой (протеинурия), которая ведет к гипопротеинемии и соответственно гипоонкии и, как следствие, увеличение фильтрации и снижение реабсорбции воды в капиллярах органов и тканей. В силу этого избыток воды в тканях сочетается с увеличением клубочковой фильтрацией в почках. При значительном выходе жидкости из сосудистого русла в ткани развивается гиповолемия, что служит сигналом для включения нейроэндокринных механизмов регуляции объема жидкости (волюм-рефлекс – осмо-рефлекс) и приводит к задержке в организме натрия и воды. Однако ограничение выведения воды с мочой приводит к дальнейшему потенцированию почечного отека, поскольку гипоонкия крови сохраняется (и даже может увеличиваться в связи с гемодилюцией). «Сэкономленная» почками жидкость не удерживается в крови и переходит в ткани (Табл. 3).
Таблица 1
Патогенез сердечного отека.
Таблица 2.
Патогенез нефритических отеков.
